北京大学戴志飞教授《AHM》:纳米声敏剂增效的声动力治疗诱导细胞焦亡并提高PD-L1阻断剂对肝癌的治疗
时间:2023-12-03 14:32:38 热度:37.1℃ 作者:网络
声动力治疗在肝癌中的应用潜力
肝癌是导致全球癌症相关死亡的主要原因之一,近年来,肝癌在各个国家的发病率和死亡率依然逐步上升,因此愈发受到关注。然而,目前所有肝癌治疗方案都无法实现完全治愈,包括手术切除、射频消融、经导管动脉化疗栓塞(TACE)等,均容易复发和发生远处转移,或对正常组织脏器造成损伤,对肝癌的治疗效果有限。声动力疗法 (SDT)协同使用声敏剂(如酞菁)和低强度聚焦超声,来产生具有细胞毒性的活性氧 (ROS),具有一定的肝癌治疗优势和潜力,比如超声波具有显著的组织穿透深度、对特定目标组织进行聚焦、可以重复治疗和有限的热效应等特点,能够作为肝癌的替代治疗方式。

细胞焦亡对肿瘤免疫微环境的调控
另外,近年来关于细胞焦亡的研究在癌症治疗领域中备受关注。细胞焦亡是由氧化应激和炎症小体介导的一种细胞程序性死亡形式,通过ROS水平提高破坏线粒体,可以导致Gasdermin蛋白激活,从而发生细胞发生焦亡。越来越多的证据证实了细胞焦亡在癌症治疗中的重要作用。细胞焦亡是一种炎性细胞死亡,与ROS导致的氧化应激有着密切关系,细胞焦亡与凋亡不同,它炎性的细胞死亡方式,与Gasdermin蛋白家族有关,可以在细胞质膜上形成孔洞,从而导致肿瘤细胞裂解,以及炎症介质的。SDT技术具有可以达到瞬间足够的有效高浓度的ROS 水平并诱导细胞急性焦亡的能力,通过设计声敏剂靶向肿瘤,并利用聚焦超声和适合的超声剂量精准治疗肿瘤,可以实现对肿瘤周围正常组织的保护,减少其受SDT过程中产生ROS的影响,从而避免造成毒副作用。
声动力治疗通过诱导细胞焦亡治疗肝癌
近期,北京大学戴志飞教授等人设计了一种安全有效的超小酞菁共轭介孔二氧化硅纳米粒子(PMSN)作为声敏剂,通过介孔结构在SDT作用过程中产生空化效应,用于放大声化学反应,以增强氧化应激,从而诱导肿瘤发生细胞焦亡、杀死肿瘤细胞,并且通过提高肿瘤免疫微环境的炎性,进一步促进免疫细胞在肿瘤中的浸润,协同PD-L1抗体对肝癌进行免疫治疗。相关工作以“Pyroptosis Induction with Nanosonosensitizer-Augmented Sonodynamic Therapy Combined with PD-L1 Blockade Boosts Efficacy Against Liver Cancer”为题发表在Advanced Healthcare Materials上。
【文章要点】
在这项研究中,研究团队结合了有机和无机声敏剂的特点,制备了PMSN作为纳米声敏剂,并对其成药性进行了研究。PMSN具有高表面积、良好稳定性和生物相容性,可以用特殊配体进行表面功能化,并具有将载药和药物递送的能力。通过引入c(RGDyC)配体,可以靶向肝癌细胞表面的整合素αvβ3受体,提高对肿瘤的靶向性,减少在SDT过程中对正常组织的损伤,且可以通过肾代谢排出体外。另外,介孔二氧化硅骨架在体循环中具有高度的结构稳定性,可以确保到肿瘤中的高效的药物递送,而具有介孔通道结构的硅纳米通过机械加速效应,在超声辐射后,能够增强超声的空化效应,从而放大声动力反应。本研究探索了该纳米体系下声敏剂的微观结构、储存稳定性,以及动物体内的血生化、代谢途径、组织病理学和生物分布,对比了一系列超声参数(中心频率、峰值负声压、占空比和作用时间等)对SDT的影响(图1)。
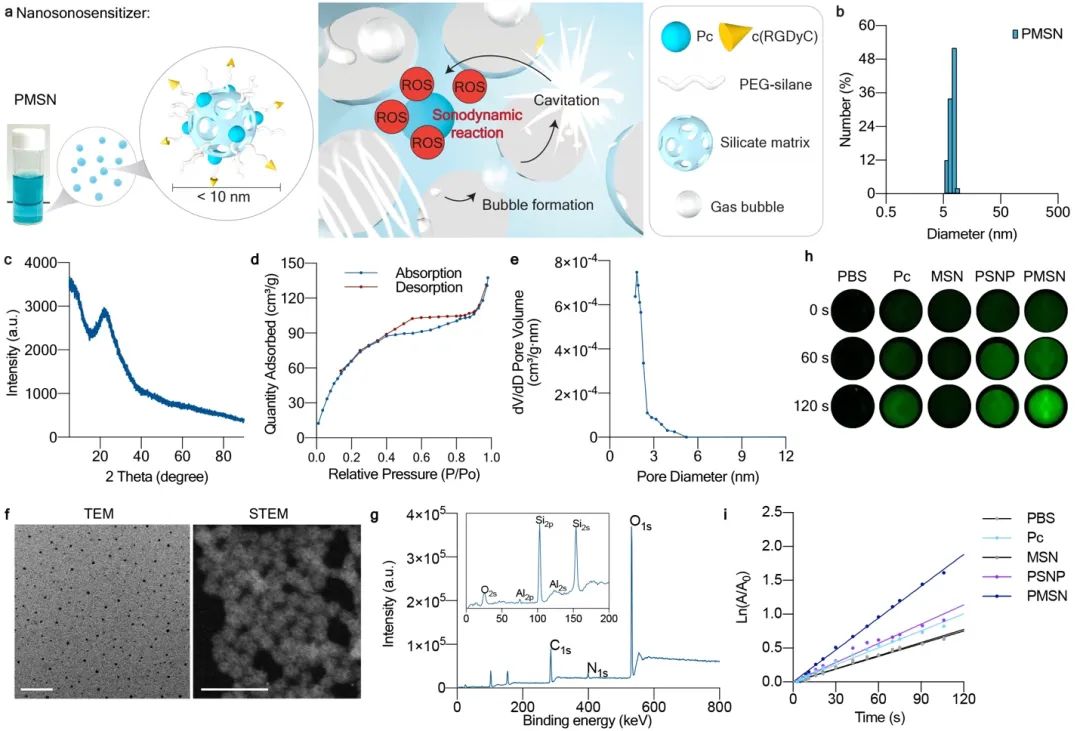
图1 PMSN的结构与表征
双侧肿瘤模型是研究肿瘤免疫微环境对治疗的响应性的常用模型,为探究SDT治疗后对肝癌肿瘤免疫微环境的调控作用,研究对建立的双侧肝癌小鼠模型静脉给不同药物,待4 小时后,进行单侧肿瘤的超声处理,并且在第二天时取肿瘤进行切片。研究通过免疫组化染色切片结果的观察和对阳性的免疫细胞进行定量,以及对肿瘤的多色流式细胞术分析,评估SDT后免疫细胞在肿瘤组织中的招募和浸润情况。其中,PMSN介导的SDT,相对于其他对照组,可以显著提高治疗处肿瘤和远端处肿瘤的各类免疫细胞浸润(图2)。
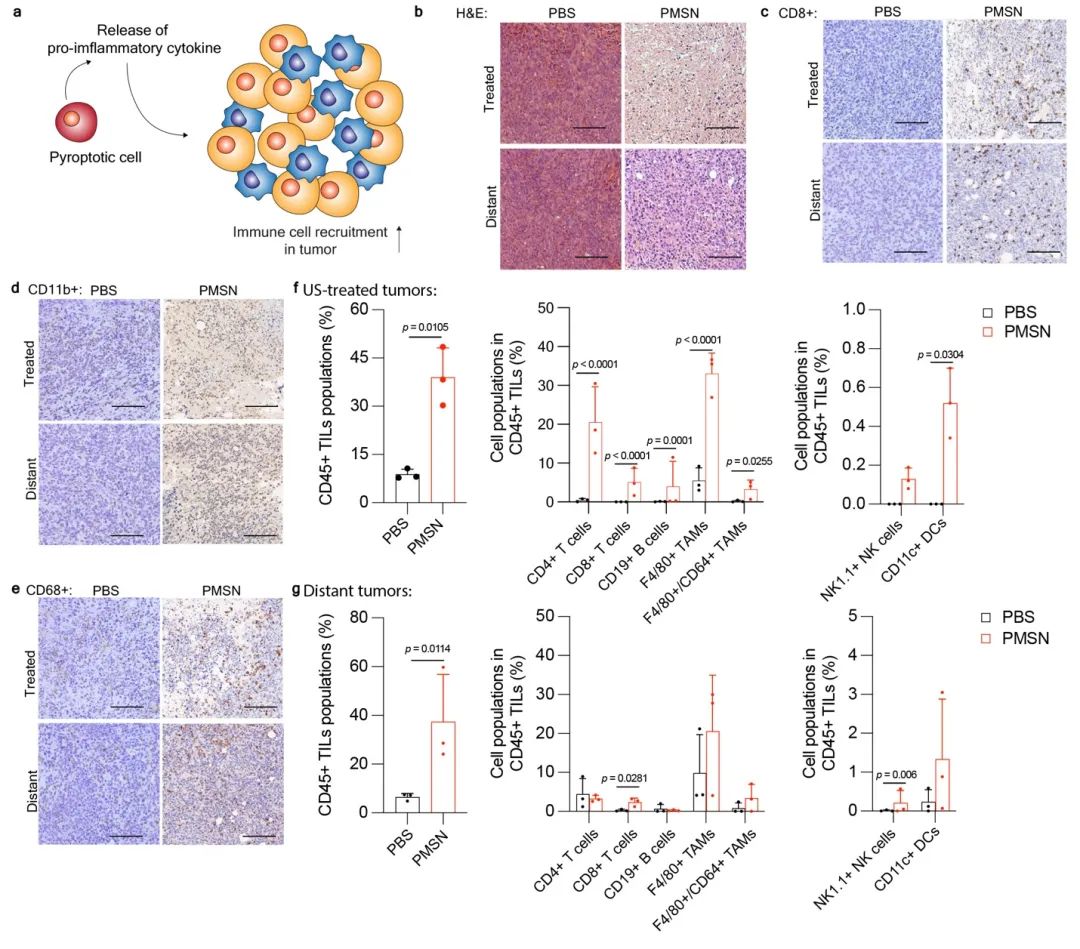
图2在PMSN介导的SDT作用下实现免疫细胞在肿瘤中的浸润
为了实现对肝癌小鼠的有效治疗,研究首先探索了PMSN介导的SDT诱导的细胞焦亡对肝癌的治疗情况。在建立了双侧肿瘤小鼠模型后,在第0、2、4天时,对各组小鼠进行不同声敏剂药物的静脉注射,并对小鼠的其中一侧肿瘤进行超声处理。进一步,为验证PMSN介导的SDT可以提高肝癌的PD-L1抗体治疗,在建立双侧肿瘤小鼠模型后,在第0天和第4天时,对小鼠的单侧肿瘤进行不同声敏剂药物介导的SDT处理,并在第2天和第6天时,对小鼠进行PD-L1抗体的腹腔注射治疗。实验结果表明,PMSN介导的SDT实现对肿瘤免疫微环境的调控和有效的抗肿瘤治疗效果,并且由于具有诱导细胞焦亡的能力,导致的炎症性肿瘤微环境提高了PD-L1抗体的治疗效果和免疫治疗响应效率(图3)。
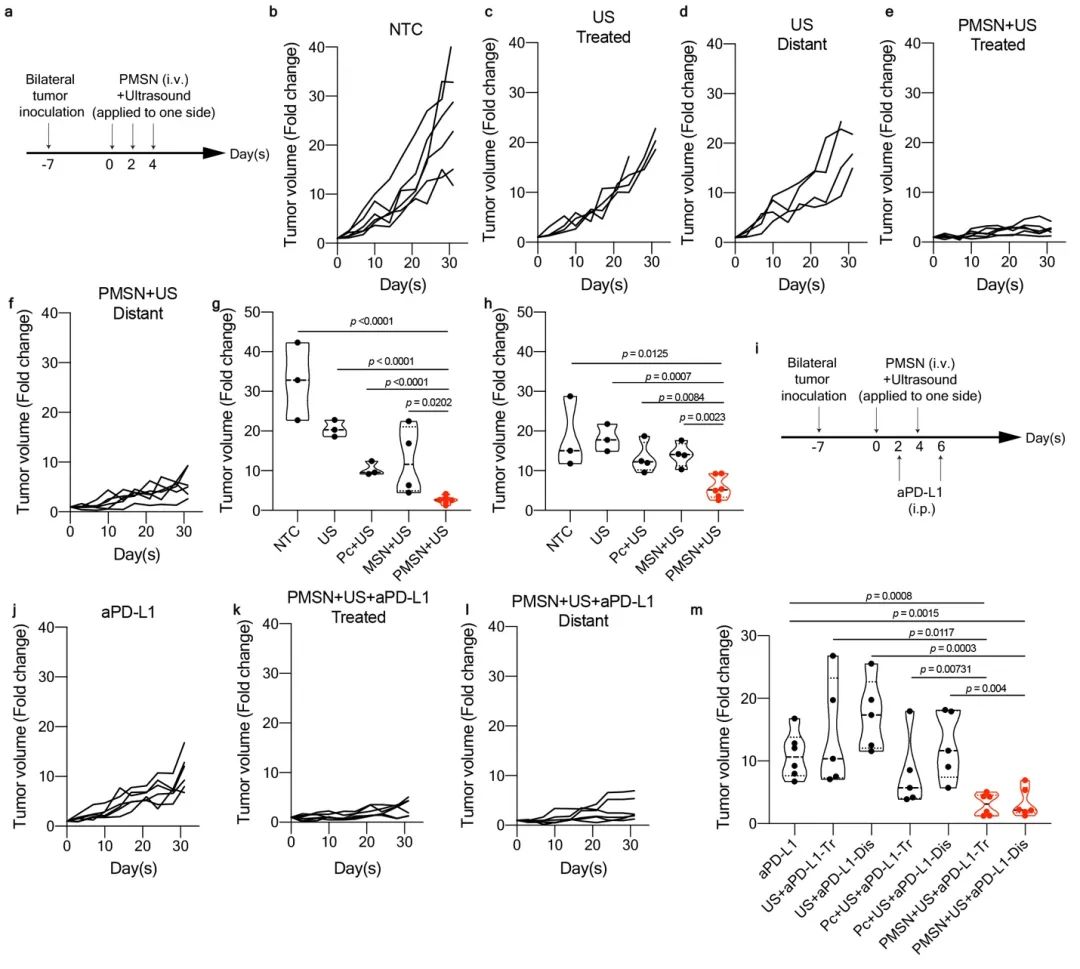
图3 PMSN介导的SDT实现小鼠肝癌的治疗,并协同提高PD-L1抗体疗效
【结论与展望】
作者最后介绍到,尽管SDT是一种对深部组织疾病和肿瘤具有临床转化潜力的新型癌症治疗方式,但目前仍处于临床前和临床试验的早期阶段,距离实际的临床应用还有一段距离。随着声动力技术的不断发展,相关理论和机制的不断完善,SDT在肝癌的诊断和治疗等方面,将会有更重大的突破,基于纳米技术的声动力癌症治疗的研究涵盖了药物精准递送,声敏剂载体构建,以及SDT过程中对免疫系统的作用等方面,本研究将超声医学、纳米医学、有机合成和免疫调控交叉融合,设计了声敏剂纳米体系,实现了精准、有效、安全、可控的治疗方案。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202302606


