Nature:哺乳期母体骨质流失的救星:母体CCN3激素在骨代谢调控中的关键作用
时间:2024-07-13 11:00:49 热度:37.1℃ 作者:网络
引言
在哺乳期母亲中,为了满足奶水生产对高钙(Ca2+)的需求,骨骼会出现显著的骨质流失。虽然雌激素(oestrogen)通常通过促进骨形成来对抗过度的骨吸收,但这种性激素在产后期间会急剧下降。7月10日Nature的研究报道“A maternal brain hormone that builds bone”,发现由下丘脑弓状核(arcuate nucleus,ARC)中的KISS1神经元分泌的脑源性细胞通信网络因子3(CCN3),弥补了这一空缺,并在哺乳期雌性中作为一种强效的促骨生成因子来促进骨骼生成。通过该研究,展示了先前报道的雌性特异性致密骨表型是由一种促骨质增加的体液因子引起的,该因子作用于骨骼干细胞(skeletal stem cells),增加其数量和成骨软骨生成潜力。进一步的研究确定这种循环因子是由ARC的KISS1神经元分泌的脑源性激素CCN3,这种激素能够刺激小鼠和人类的骨骼干细胞活性,增加骨重塑并加速年轻和年老小鼠的骨折修复。
正常雌性生理中CCN3的作用在检测到哺乳期ARC的KISS1神经元中CCN3表达的爆发后得以揭示。当减少ARC的KISS1神经元中的CCN3时,哺乳期母亲失去骨质,并且在低钙饮食条件下不能维持其后代的生存。这些发现确立了CCN3作为一种潜在的新型治疗性促骨生成激素,并定义了在哺乳动物中确保物种生存的一种新的母体脑激素。
骨质疏松症显著影响健康衰老,女性比男性更容易经历这一问题。雌性通过雌二醇(estradiol, E2)增加能量消耗并作为一种促骨生成激素通过调节骨细胞(osteocytes)、成骨细胞(osteoblasts)和成骨软骨骨骼干细胞(osteochondral skeletal stem cells, ocSSCs)来保持骨量。对于女性而言,绝经后或抗激素治疗后的雌激素减少会导致骨量下降,这突显了雌激素对骨的促生成特性。然而,在哺乳期间,雌激素与骨之间的密切关系被解耦,当晚期妊娠中的E2激增急剧下降时,骨重塑在啮齿动物和灵长类动物中急剧增加,以满足后代对钙的高需求。
该研究在突变雌性小鼠中鉴定一种促骨生成激素,首先展示这种因子在血液中循环。CCN3(也称为NOV)作为最佳候选因子脱颖而出,符合所有预测标准。也就是说,它是分泌性的,其在ARC中的出现与骨表型的发生和消失相吻合,并且它增强骨形成和骨折修复。通过分析CCN3在正常雌性生理中的基本作用,该研究揭示了其在哺乳期母亲中作为促骨生成激素的重要性。

骨质疏松症显著影响健康老龄化,尤其在女性中更为普遍。雌激素(oestrogen)通常通过促进骨形成来对抗过度的骨吸收。然而,在哺乳期间,母体为了满足奶水生产的高钙(Ca2+)需求,骨骼会出现显著的骨质流失,而此时雌激素水平却急剧下降。该研究旨在揭示哺乳期母体通过何种机制来弥补这一空缺,并维持骨骼的健康和功能。
该研究使用Esr1fl/fl、Esr1Nkx2.1-cre、Esr1Kiss1-cre和Esr1Prodynorphin-cre小鼠,这些小鼠在不同的脑区特异性敲除雌激素受体α(ERα),以研究ERα对骨代谢的影响。通过立体定向注射技术,将腺相关病毒(AAV2-Cre)注射到小鼠的下丘脑弓状核(arcuate nucleus,ARC),以特异性敲除ERα基因。通过经典的并体实验,将雌性小鼠外科手术连接,形成对照-对照(WT-WT)和对照-突变(WT-Mut)配对组,以研究体液因子的作用。
使用微型计算机断层扫描(micro-computed tomography,μCT)对小鼠的股骨远端进行扫描,以测量骨量和骨密度。通过移植实验,将小鼠骨骼干细胞(skeletal stem cells,SSCs)移植到其他小鼠的肾被膜下,观察其成骨能力。分离小鼠的骨骼干细胞,进行单细胞RNA测序,分析基因表达变化。采用qPCR和Western blot等方法,检测特定基因和蛋白质的表达水平。使用荧光原位杂交(RNAscope)技术,检测特定脑区基因表达的空间分布。
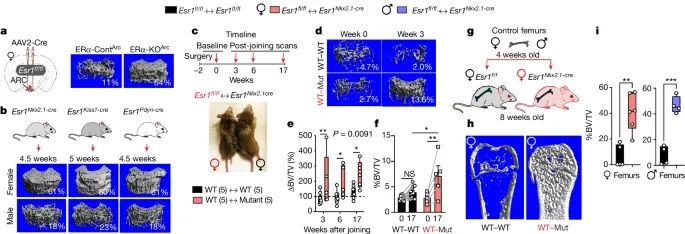
通过基因敲除、并体实验和骨移植实验,证实了弓状核(ARC)中的雌激素受体α(ERα)敲除后,体内存在一种能够显著增加骨量的循环因子,这种因子能够通过刺激骨骼干细胞的活性,促进骨形成(Credit: Nature)
基因敲除与骨量变化:使用AAV2-Cre病毒介导的ERα敲除模型,发现敲除ERα的弓状核(ARC)区域的小鼠表现出显著的骨量增加。对比ERα敲除组(ERα-KOArc)和对照组(ERα-ContArc)小鼠的股骨远端,通过μCT扫描显示敲除ERα的小鼠骨体积分数(BV/TV)显著高于对照组。
并体实验:将野生型(WT)小鼠与敲除ERα的小鼠(Esr1Nkx2.1-cre)通过手术连接形成并体模型,以研究体液因子的作用。结果显示,在并体实验中,对照-突变(WT-Mut)配对组中,野生型小鼠的骨量显著增加,而突变小鼠也恢复了显著的骨量。
骨移植实验:将4周龄的野生型小鼠的股骨移植到8周龄的对照和突变小鼠体内。结果显示,移植到突变小鼠体内的骨骼表现出更高的矿化水平,骨体积分数显著增加,证明了突变小鼠体内存在促进骨形成的体液因子。
骨骼干细胞的作用:通过骨移植实验,进一步证实了这种体液因子对骨骼干细胞的促进作用。在突变小鼠体内,骨骼干细胞的数量和成骨潜力显著增加,显示出更高的成骨活性。
CCN3的发现和作用
研究发现,ARC的KISS1神经元分泌的脑源性细胞通信网络因子3(CCN3)在哺乳期母体中作为一种强效的促骨生成因子,弥补了雌激素水平下降带来的骨质流失问题。在CCN3表达减少的哺乳期小鼠中,骨质显著流失,并且在低钙饮食条件下,母体无法维持后代的生存。CCN3能够刺激小鼠和人类骨骼干细胞的活性,增加骨重塑和骨折修复能力。
CCN3对骨骼干细胞的影响
CCN3能够显著增加小鼠和人类骨骼干细胞的数量和成骨软骨生成潜力,从而增强骨重塑和骨折修复能力。在体外实验中,CCN3处理的小鼠骨骼干细胞表现出更高的成骨活性。
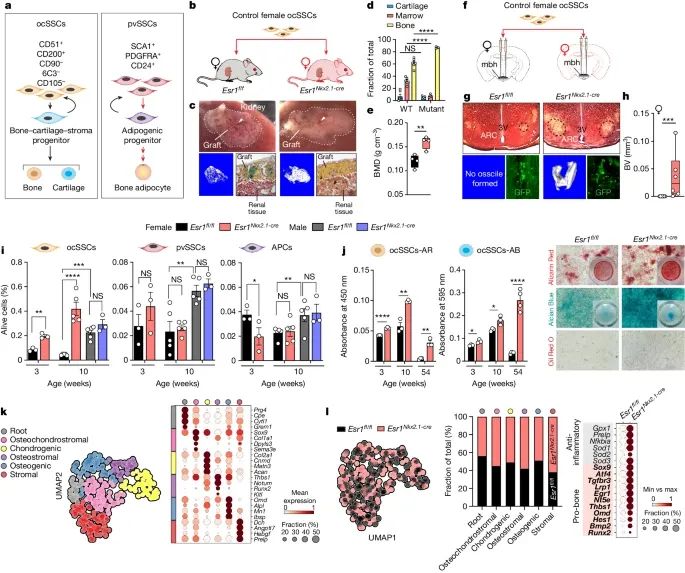
弓状核(ARC)中的雌激素受体α(ERα)敲除后,体内存在一种循环因子能够显著增加骨软骨干细胞(ocSSCs)的数量和成骨能力,这种因子通过增强ocSSCs的成骨活性,促进骨形成(Credit: Nature)
骨骼干细胞的分离与移植:通过荧光激活细胞分选(FACS)技术,从非血液、非内皮细胞中分离出骨骼干细胞(skeletal stem cells,SSCs),包括骨软骨干细胞(osteochondral skeletal stem cells,ocSSCs)和血管周围干细胞(perivascular skeletal stem cells,pvSSCs)。将分离出的野生型雌性小鼠的ocSSCs移植到Esr1fl/fl和Esr1Nkx2.1-cre突变小鼠的肾被膜下,观察其成骨能力。
ocSSCs在突变小鼠中的成骨活性:在Esr1Nkx2.1-cre突变小鼠体内,移植的ocSSCs形成的异位骨移植物表现出更高的矿化水平,骨密度和骨矿物质密度(BMD)显著增加,显示出更高的成骨活性。μCT成像和Movat五色染色显示,突变小鼠移植物中的骨形成和矿化显著增强,而造血间质减少。
ocSSCs在脑内的成骨活性:通过立体定向技术,将分离的ocSSCs移植到Esr1fl/fl和Esr1Nkx2.1-cre突变小鼠的弓状核(ARC)附近,观察其成骨能力。μCT成像显示,在突变小鼠的ARC中,ocSSCs形成的矿化小体显著增加,而在野生型小鼠大脑中未检测到矿化小体。
突变小鼠中ocSSCs的数量和分化潜力:流式细胞术分析显示,在青春期前(3周龄)和成年(10周龄)突变雌性小鼠中,ocSSCs的数量显著增加。功能实验显示,突变小鼠的ocSSCs具有更高的骨和软骨形成潜力,尤其是在老龄小鼠中,这一现象更为显著。
单细胞RNA测序分析:通过单细胞RNA测序技术,分析突变小鼠和对照小鼠ocSSCs的基因表达谱,发现突变小鼠的ocSSCs在成骨和软骨形成相关基因的表达上显著增加。
基因敲除与基因表达分析
在雌性小鼠中敲除ARC的ERα基因,发现KISS1神经元通过分泌CCN3,显著增加骨量和骨密度。使用基因敲除模型和荧光原位杂交技术,确认了CCN3在KISS1神经元中的表达,并在哺乳期显著增加。
血液循环因子的作用
通过经典的并体实验,确认了CCN3作为一种循环因子,通过血液影响全身骨骼健康。在小鼠模型中,通过骨移植实验,进一步证明了CCN3对骨骼干细胞的促进作用。
基因表达分析和单细胞RNA测序
使用单细胞RNA测序技术,发现CCN3能够调控多个基因,促进成骨细胞的分化和骨形成。基因表达分析显示,CCN3在不同的生理条件下(如妊娠和哺乳期)表达水平显著变化。
该研究揭示了CCN3作为一种新的促骨生成激素的潜力,并定义了其在哺乳期母体中的重要作用。CCN3通过刺激骨骼干细胞的活性,增加骨量和骨密度,显著改善了骨骼健康。这一发现不仅为骨质疏松症的治疗提供了新的思路,还强调了母体在哺乳期间通过复杂的神经内分泌机制来维持骨骼健康的能力。
CCN3的临床潜力
作为一种新型的促骨生成激素,CCN3有望应用于骨质疏松症和骨折修复的治疗。未来的研究可以进一步探讨CCN3在不同动物模型中的效果,并进行临床试验验证其安全性和有效性。CCN3的应用可能不仅限于骨质疏松症,还可以扩展到其他需要促进骨形成和修复的疾病,如骨折、骨缺损和骨肿瘤等。
哺乳期母体骨骼健康管理
该研究强调了哺乳期母体的骨骼健康管理的重要性。通过合理的营养和激素调节,可以在哺乳期保护母体的骨骼健康,确保后代的正常发育。提高公众对哺乳期母体骨骼健康的认知,制定相关的保健措施和政策,促进母婴健康。
未来的研究可以深入探讨CCN3的分子机制,了解其在不同生理条件下的作用。同时,可以研究其他潜在的促骨生成因子,以及它们与CCN3的相互作用。研究CCN3在不同物种中的保守性和特异性,为其在临床应用中的跨物种推广提供依据。探索CCN3与其他骨代谢调控因子(如雌激素、甲状旁腺素相关蛋白(PTHrP)等)的相互作用,全面揭示骨代谢的复杂网络。
参考文献
Babey ME, Krause WC, Chen K, Herber CB, Torok Z, Nikkanen J, Rodriguez R, Zhang X, Castro-Navarro F, Wang Y, Wheeler EE, Villeda S, Leach JK, Lane NE, Scheller EL, Chan CKF, Ambrosi TH, Ingraham HA. A maternal brain hormone that builds bone. Nature. 2024 Jul 10. doi: 10.1038/s41586-024-07634-3. Epub ahead of print. PMID: 38987585.
https://www.nature.com/articles/s41586-024-07634-3


