读书报告 | 放射治疗联合免疫检查点抑制剂和抗血管生成药物治疗肝细胞癌
时间:2023-12-06 18:34:26 热度:37.1℃ 作者:网络
导读
接受放射治疗联合免疫检查点抑制剂(ICIs)和抗血管生成疗法治疗肝细胞癌大多数肝细胞癌的患者被诊断为不能切除的阶段,治疗选择有限,预后很差。NCCN指南中批准阿替利珠单抗联合贝伐单抗作为新的一线治疗方法,从根本上改变了对不能切除或转移性肝癌的治疗,尽管IMbrave 150研究证明抗血管生成治疗联合ICIs提高了晚期肝癌患者的中位总生存率(mOS),中位无进展生存期(mPFS)为4.6-6.8个月,客观有效率(ORR)为24%-27.3%,但仍有很大的提升空间。
现代放射治疗(RT)技术的发展为部分肝癌患者提供了良好的局部控制(LC),与射频消融(RFA)和经动脉化疗栓塞术(TACE)一样有效。RT对晚期肝癌的治疗效果有限,提示迫切需要联合治疗。RT不仅会导致肿瘤中致死性的DNA损伤,还会诱导免疫原性细胞死亡,促进免疫细胞向肿瘤微环境的渗透。ICIs可以逆转RT介导的T细胞耗竭。此外,越来越多的临床研究表明,外照射RT与免疫治疗相结合可以改善实体癌如肺癌、黑色素瘤和头颈癌的抗肿瘤反应。然而,ICIs和RT联合应用对晚期肝癌具有潜在协同抗肿瘤作用的证据尚不充分。
本研究回顾性评估了ICIs和抗血管生成治疗联合RT(三联治疗)在巴塞罗那分期(BCLC)C期肝癌患者中的安全性和有效性,观察到三联治疗的PFS和OS明显长于ICIs联合抗血管生成治疗,ORR也更高(75.9% vs.24.1%,p<0.001),总体安全性不低于ICIs联合抗血管生成治疗。结论:在初治或复发的BCLC C期肝癌患者中三联疗法优于目前标准的阿替唑单抗加贝伐单抗作为一线治疗(Int J Radiat Oncol Biol Phys. 2023 Jul 9;S0360-3016 (23) 07626-5. doi: 10.1016/ j.ijrobp. 2023.07.001)。
研究背景
1.目前晚期不可切除肝癌的一线治疗方案是阿替利珠单抗联合贝伐,但疗效有限。
尽管(IMbrave 150)阿特珠单抗联合贝伐珠单抗提高了晚期肝癌的中位mOS, mPFS及ORR 。
2.在晚期肝癌中,单纯RT的治疗效果有限,表明迫切需要联合治疗。
现代放射治疗(RT)技术的发展为特定的肝癌患者提供了良好的局部控制(LC),与射频消融(RFA)和经动脉化疗栓塞术(TACE)一样有效。
3. 缺乏证据表明ICIs和RT联合治疗晚期肝癌具有潜在的协同抗肿瘤作用。
RT不仅会导致肿瘤中致命的DNA损伤,还会诱导免疫原性细胞死亡,促进免疫细胞向肿瘤微环境的渗透。ICIS可以逆转RT介导的T细胞耗竭。此外,越来越多的临床研究表明,外照射结合免疫疗法可以改善肺癌等实体肿瘤的抗肿瘤反应。如黑色素瘤和头颈癌。
研究目的及意义
1.研究目的:这项回顾性研究评估了ICIS和抗血管生成治疗联合RT在巴塞罗那(BCLC)肝癌分期为C期患者中的安全性和有效性。
研究方法
1.入排标准
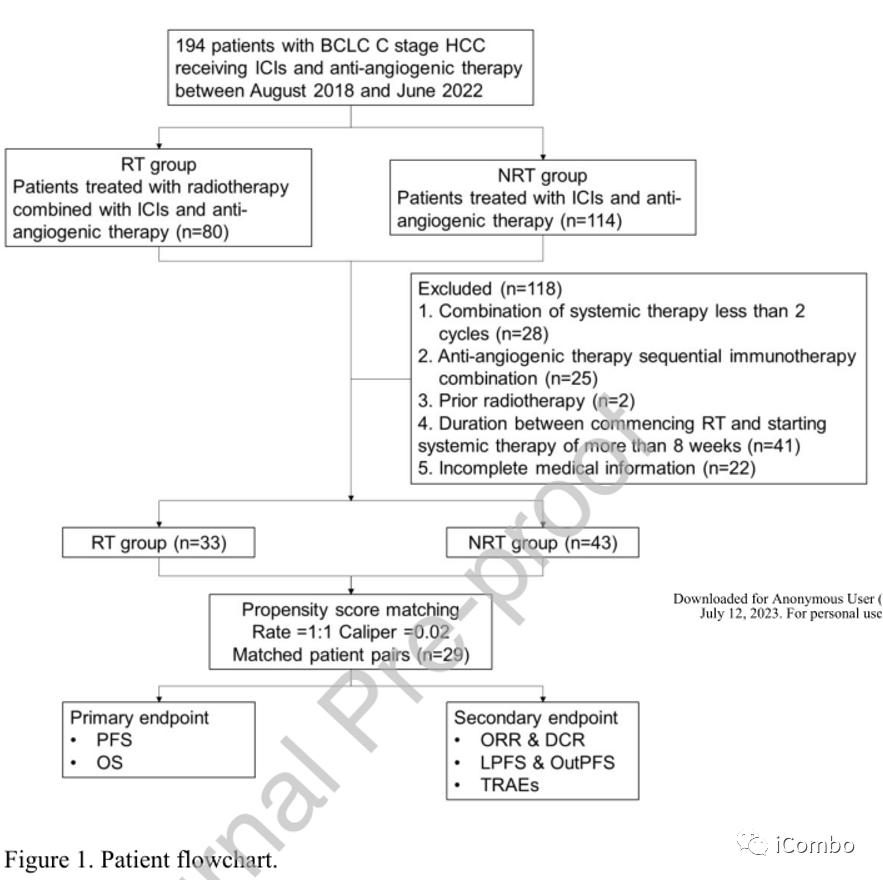
① 入组标准:从2018年8月至2022年6月在协和医院接受系统治疗(ICIS加抗血管生成药物)的194例晚期肝癌(大血管侵犯或肝外转移)患者,均经组织病理或临床确诊。
② 排除标准包括联合全身治疗少于2个周期,血管生成药物序贯ICIS联合,先前放疗,开始放疗和开始全身治疗之间的时间超过8周,以及缺少影像或随访信息
③ 所有患者在开始放疗前都接受了多学科评估,通常由于合并症、技术原因或先前治疗失败(即RFA或肝切除术)而被认为不符合其他标准治疗的条件。
2.治疗
①放疗:
-
IMRT:临床靶区体积(CTV),即肿瘤床加上1.0厘米的边缘。
计划靶区(PTV)由CTV在前后、左右、头尾方向分别扩张0.6~0.8cm、0.5~0.7cm、0.8~1.0cm构成。
处方剂量为30~60Gy/8~30F,覆盖PTV的95%。
-
SBRT:在开始SBRT之前,植入4~6个基准标记物,以基于CT模拟图像确定治疗位置。
PTV使肿瘤体积(GTV)增大0.3~0.5cm。处方剂量为40~60Gy/8~10F,等剂量曲线包络100%的GTV。
3.系统治疗
① ICIS包括PD-1或PD-L1抗体治疗,如帕博丽珠单抗、卡瑞丽珠单抗、信迪利单抗和阿特珠单抗。
② 抗血管生成药物包括多靶点络氨酸酶抑制剂(乐伐替尼、索拉菲尼和多纳非尼)和其他血管内皮生长因子(VEGF)抑制剂(贝伐单抗和阿帕替尼),这些药物通常与ICIS同时使用。
③ TACE包括动脉内注射碘化油、5-氟尿嘧啶和奥沙利铂,然后注射栓塞剂以阻断血流。
当发生不可接受或严重的不良事件(AEs)或疾病进展时,这些治疗被中断或停止。
4.治疗原则
① 治疗的选择主要以中国临床肿瘤学会(CSCO)指南为指导,并辅之以患者的经济状况、偏好和医疗保险覆盖范围的考虑。
② 本研究对晚期肝癌的放疗指征包括:
-
a. 不能切除的肉眼血管癌栓,用于延长生存期和/或联合介入治疗;
-
b. 16,17例有症状的转移灶,如骨、脑和腹膜后淋巴结,用于症状控制和/或并发症预防;
-
c. 18~20例有肿块影响和/或远离肠道的转移灶,如肝门脉淋巴结,用于肿瘤减负;
-
d. 21例补充治疗,用于介入治疗不能覆盖的病灶。
此外,应该注意的是,在放疗组中,并不是所有的病灶都进行了放射线治疗,而在非放疗组中出现了可以进行放射线治疗的病灶。
5.评估
1. 肿瘤评估在基线上进行。影像评估(增强CT或磁共振成像)每6-8周进行一次。
2. 主要终点:PFS和OS,
次要终点包括ORR、疾病控制率(DCR)、局部PFS(LPFS)、除治疗病灶外PFS(OutPFS)和安全性。
3. 根据改良的实体瘤疗效评价标准(MRECIST)评价总体疗效。
4. 有RT的LC被定义为治疗量中没有进展或复发。
5. OutPFS被定义为除治疗病灶外的疾病进展或复发的持续时间。
6. 治疗相关不良事件(TRAE)使用美国国家癌症研究所不良事件通用术语标准5.0版进行分级。
在具有相同毒性的多个病例中,根据给定类别考虑每个患者的最高等级。
晚期毒性定义为放射治疗90天后发生的TRAEs。
肝功能恶化的迹象是ChildPugh评分增加到≥2。
结果
筛选流程图及研究设计
患者基线特征
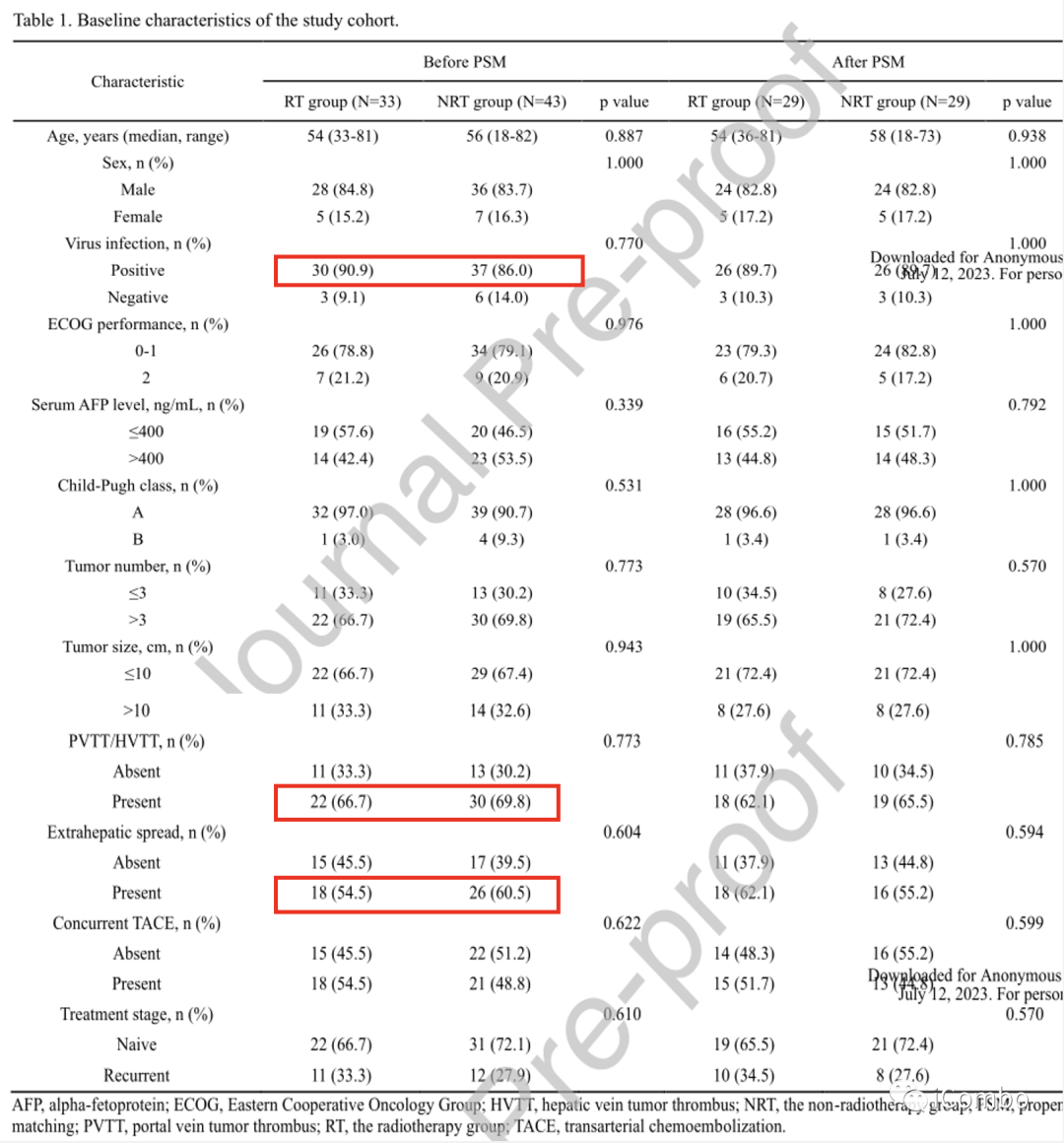
1.PSM前后两组患者的基线特征总体上是平衡的(表1)。
PSM前①两组男性患者比例相似(RT组84.8%,NRT组83.7%)。
② 67例患者中有88.2%(n=67)有肝炎病毒感染。③ 68.4%(n=52)和57.9%(n=44)的患者被诊断为PVTT(门静脉癌栓)/HVTT(肝静脉癌栓)和肝外转移。
经PSM治疗后,两组(n=29)的基线特征无显著差异。
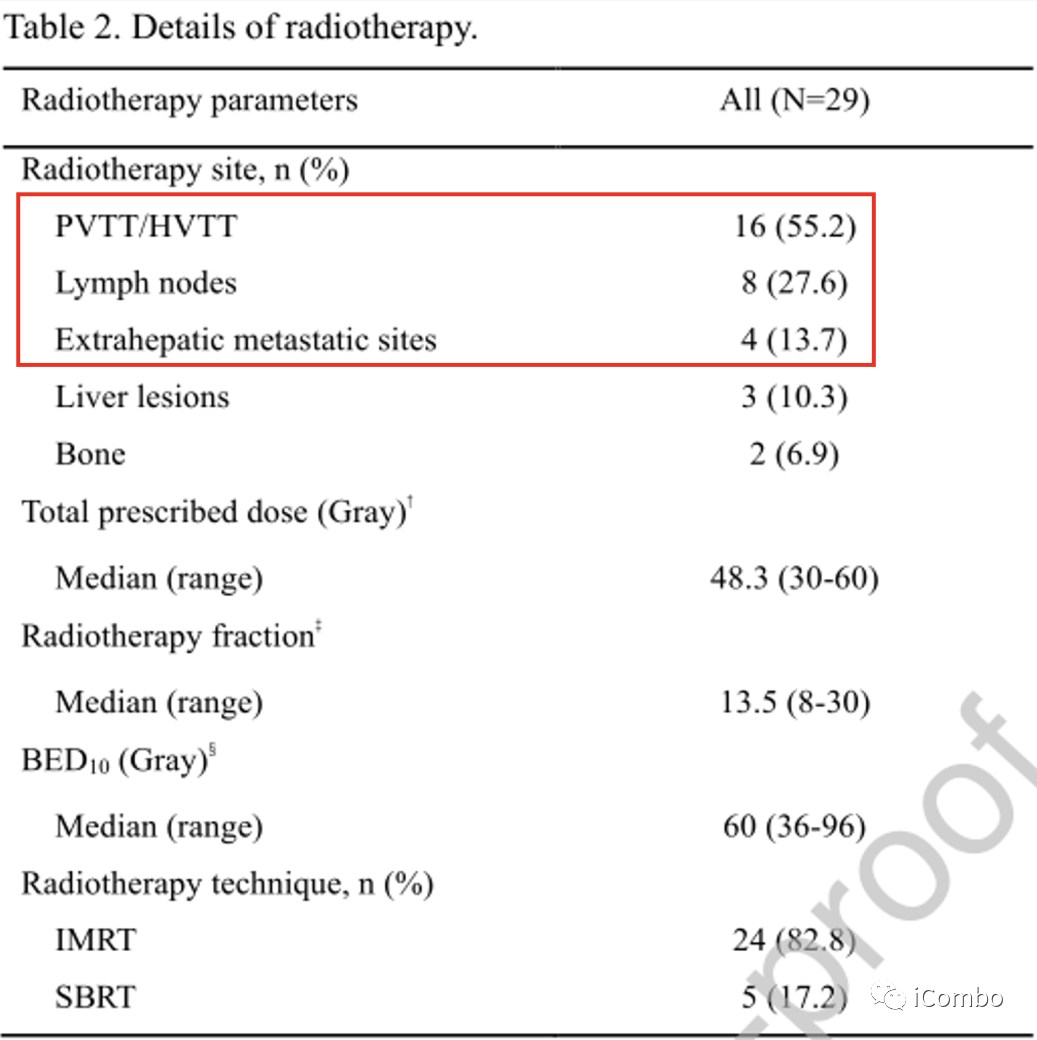
④ RT部位主要分布在PVTT/HVTT(55.2%)、淋巴结(27.6%)和肝外转移部位(13.7%)。
中位数处方剂量为48.3Gy30~60Gy 13.5f(8~30)。
中位BED10为60Gy36~96Gy.。
采用的主要放疗技术为调强放疗(82.8%),其次为SBRT(17.2%)。
此外,从系统治疗开始到放疗开始之间的中位持续时间为27天(1-56)。
放疗细节
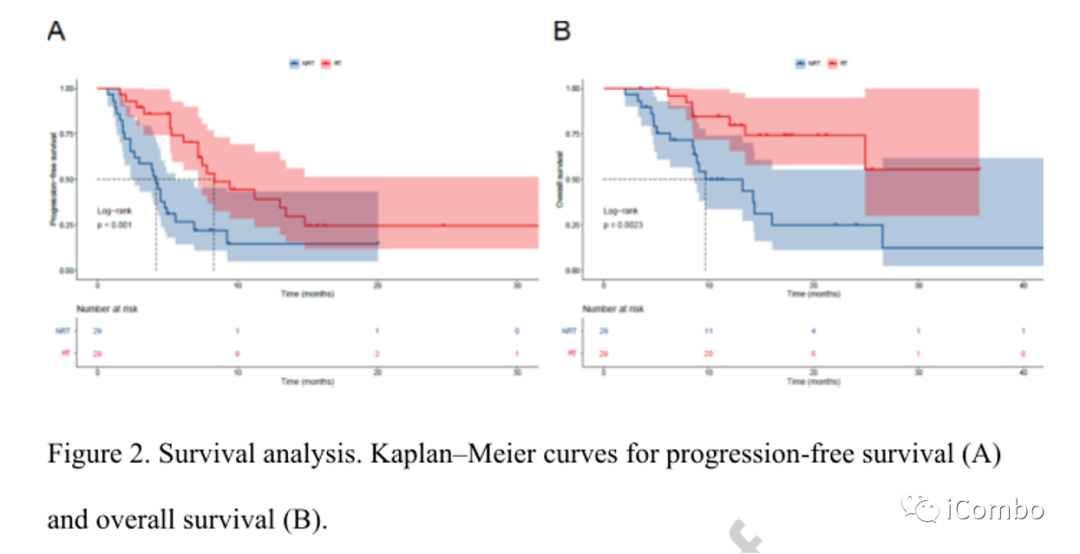
PFS 及OS
中位随访时间为15.5m;RT组和NRT组分别有18例(62.1%)和23例(79.3%)发生了mRECIST定义的进展或死亡事件。
PFS
① RT组vs NRT组:mPFS 8.3m(IMbrave150 6.8m)vs 4.2m (HR=0.38;p<0.001;图2A)。
② 合并TACE的RT亚组(7.2m vs.3.9m[95%CI:1.7-6.1];HR=0.32;p=0.007)的mPFS显著长于NRT亚组。
③ PFS的亚组分析表明,RT为所有分析亚组提供了临床获益(图S1B)。
OS
① RT组VS NRT组:mPFS NR vs 9.7m(HR=0.28;p=0.002;图2B)。
② 此外,观察到明显的mOS倾向于同时行TACE的RT亚组(NRvs.14.3m[95%可信区间:6.522.0];HR=0.34;p=0.055)。
③ OS亚组分析表明,RT为所有分析亚组提供了临床获益(图S1D)。
LPFS及out PFS
1. 只有一名患者因腹主动脉瘤破裂而中断放射治疗,放射治疗组的所有其他患者都完成了治疗方案。
2. 在匹配的放疗患者中,分别有10例(34.5%)(其中4例出现了野内进展),18例(62.1%)患者获得了LPFS和outPFS的结果。
3. RT组中位LPFS为13.2个月(6.3~20.1个月),中位OutPFS为10.8个月(95%CI:7.0~14.7个月)。1年和2年LC率分别为50.2%(95%CI:25.9~74.5)和43.9%(95%CI:19.6~68.2)。
多变量分析结果及独立预后因素
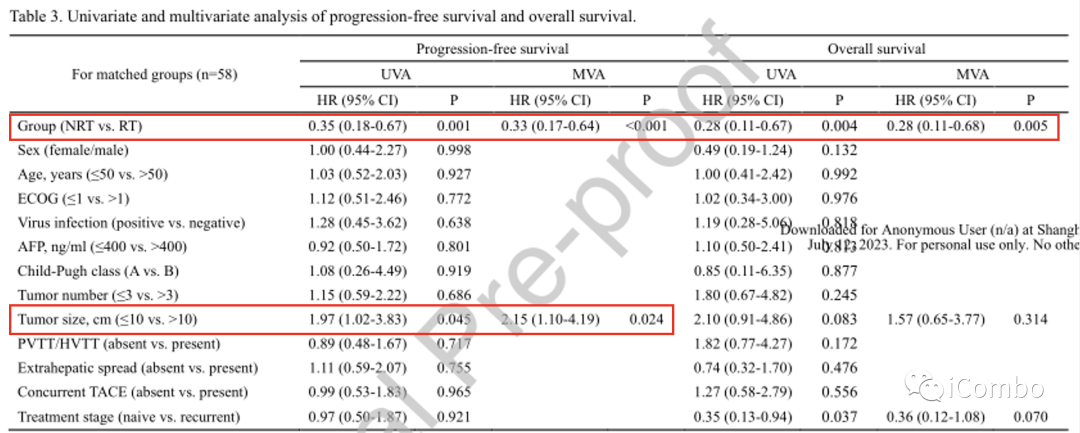
1. 经过多变量分析(MV A;表3),NRT与RT是PFS和OS的独立危险因素。
2. 此外,基线肿瘤大小>10厘米是预测较短PFS的预后因素。
3. 然而,对于PFS、LPFS和OS,BED10(≤60或>60GyRT)不包括在MV A中(表S1)。
ORR, DCR及DFS
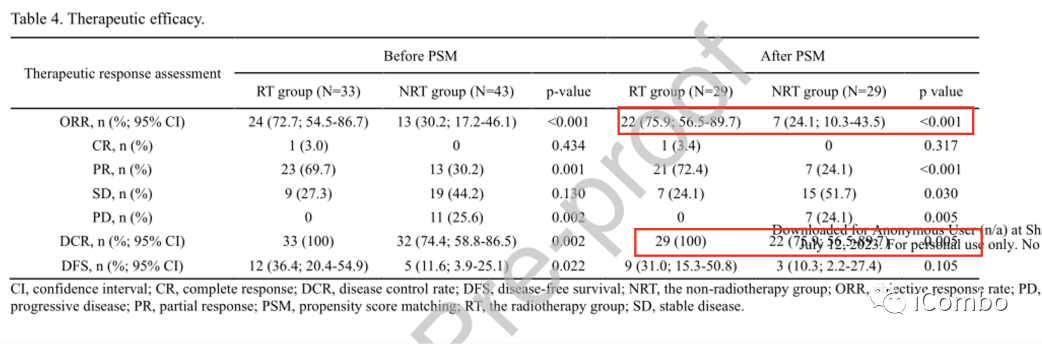
1. 根据mRECIST标准,匹配RT组的ORR显著高于匹配NRT组(75.9%vs.24.1%,P<0.001)。
此外,两组的DCR有显著差异(100%vs.75.9%,p=0.005)。
2. 值得注意的是,放疗组有12例(36.4%)患者通过序贯放疗或降级手术获得了无病生存(DFS),而非放疗组仅有5例患者接受了有治疗意图的手术;因此,RT组患者的无病生存率较高(36.4%比11.6%,P=0.022)。在PSM后,RT组的DFS率继续高于NRT组,尽管没有达到统计学意义(31.0%对10.3%,p=0.105)。
安全性
1. 整体情况:对于匹配组,55名患者(94.8%)至少经历了1级TRAE(表4)。在此期间,没有发生与治疗有关的死亡。
2. 最常见不良反应:
-
匹配RT:腹痛(41.4%)、不适(41.4%)和血小板减少(41.4%)。
-
匹配NRT:不适(27.6%)、血小板减少(27.6%)、腹泻(24.1%)、食欲减少(24.1%)。
-
RT组1级或2级腹痛(p=0.016)、淋巴细胞计数下降(p=0.023)、中性粒细胞计数下降(p=0.010)的发 生率明显高于NRT。
3. 3级和4级TRAE的发生率:无显著差异。
4. RT组有1例出现非典型放射性肝病(RILD),未观察到典型RILD。
5. 晚期毒性反应:
-
在RT组中,24例(82.8%)1级晚期毒性,中位发生时间为6.8m。
-
最常见是腹痛(17.2%)、血小板减少(17.2%)和淋巴细胞减少(17.2%)。
6. 此外,6个月时匹配RT组的≥2分级发生率较低(20.7%vs.44.8%,P=0.050)。治疗后12个月和18个月时,单纯放疗组≥-2评分恶化的患者明显少于常规放疗组,但差异无统计学意义(分别为p=0.089和p=0.703)。
讨论与总结
结果表明,在初治或复发的BCLC C期肝癌患者中,三联疗法优于目前标准的阿替唑单抗加贝伐单抗作为一线治疗。
1. ICIS和抗血管生成治疗联合RT导致的PFS和OS明显长于ICIS联合抗血管生成治疗。
2. 与ICIS和抗血管生成治疗联合RT相比,ICIS和抗血管生成治疗联合RT的ORR也更高(75.9%vs.24.1%,p<0.001),总体安全性并不低于ICIS联合抗血管生成治疗。
这些数据表明,
还需要进一步的研究来探索双局部治疗与全身治疗相结合的潜在机制。
在基于是否合并TACE的分层分析中,RT亚组的mPFS和mOS显著长于NRT亚组。TACE加RT是一种经证实的治疗有宏观血管侵犯的肝癌的方法,可以维持肝功能和控制肝内肿瘤。


