Mol Cancer:山东大学杨其峰团队发现三阴性乳腺癌的潜在治疗新靶点
时间:2024-06-11 19:00:48 热度:37.1℃ 作者:网络
乳腺癌是最常见的恶性肿瘤,转移是导致预后不良的主要原因。葡萄糖代谢重编程是癌症的重要标志之一,为肿瘤生长和转移提供营养和能量。然而,糖酵解与乳腺癌进展之间的潜在机制联系尚未完全阐明。
2024年6月8日,山东大学杨其峰团队在Molecular Cancer 在线发表题为“Exosomal circSIPA1L3-mediated intercellular communication contributes to glucose metabolic reprogramming and progression of triple negative breast cancer”的研究论文,该研究通过RNA-seq分析,circSIPA1L3被确定为能量应激下代谢适应的关键介质。功能获得和功能丧失实验显示circSIPA1L3对乳腺癌的进展和糖酵解有促进作用。值得注意的是,circsipa1l3介导的糖酵解增强引起的乳酸分泌升高促进了肿瘤相关巨噬细胞的募集及其促瘤作用。
从机制上讲,EIF4A3诱导circSIPA1L3的环化和胞质输出,通过增强UPS7-IGF2BP3的相互作用,抑制泛素介导的IGF2BP3降解。此外,circSIPA1L3通过加强与IGF2BP3或海绵miR-665的相互作用,提高乳酸输出载体SLC16A1和葡萄糖摄入促进子RAB11A mRNA的稳定性,从而增强糖酵解代谢。在临床上,基于238例乳腺癌患者的队列研究,circSIPA1L3表达升高提示预后不良。circSIPA1L3在乳腺癌患者血清中高表达,对乳腺癌患者具有较高的诊断价值。总之,该研究强调了circSIPA1L3通过介导葡萄糖代谢的致癌作用,它可能作为一种有前景的乳腺癌诊断和预后生物标志物和潜在的治疗靶点。

乳腺癌是世界范围内最常见的恶性肿瘤,也是女性癌症相关死亡的第二大原因。尽管在早期发现和多模式治疗方面取得了进步,但乳腺癌患者的预后仍然令人不满意。转移是导致预后不良的重要原因,转移性乳腺癌患者的平均5年生存率仅为25%。三阴性乳腺癌(Triple negative breast cancer, TNBC)是乳腺癌的组织学亚型之一,具有进展快、侵袭性强、远处转移潜力大、预后差等特点。虽然TNBC在乳腺癌中的比例仅为15-20%,但在转移性乳腺癌中占50%以上。乳腺癌的转移是一个以遗传和表观遗传异常为特征的复杂过程,因此,更好地理解乳腺癌进展的分子机制将是扩大治疗选择和优化患者预后的重要一步。
既往研究报道,肿瘤组织中葡萄糖浓度低于正常组织,特别是快速生长的肿瘤,面临严重的营养缺乏环境。为了满足细胞增殖和转移的需要,肿瘤细胞发展出与正常细胞明显不同的代谢模式,这被认为是癌症的一个标志。有氧糖酵解,也称为Warburg效应,是癌症中的一个突出现象,即使在氧气充足的环境下,癌细胞也倾向于通过糖酵解而不是氧化磷酸化来获取能量。越来越多的证据支持有氧糖酵解与肝癌、结肠癌、胃癌等多种肿瘤转移风险高、预后差密切相关。TNBC作为一种高度恶性亚型,对能量和营养物质的需求可能会增加,这表明有氧糖酵解对TNBC的进展具有关键作用。然而,糖酵解在乳腺癌中的具体作用和确切机制仍然是未知的。
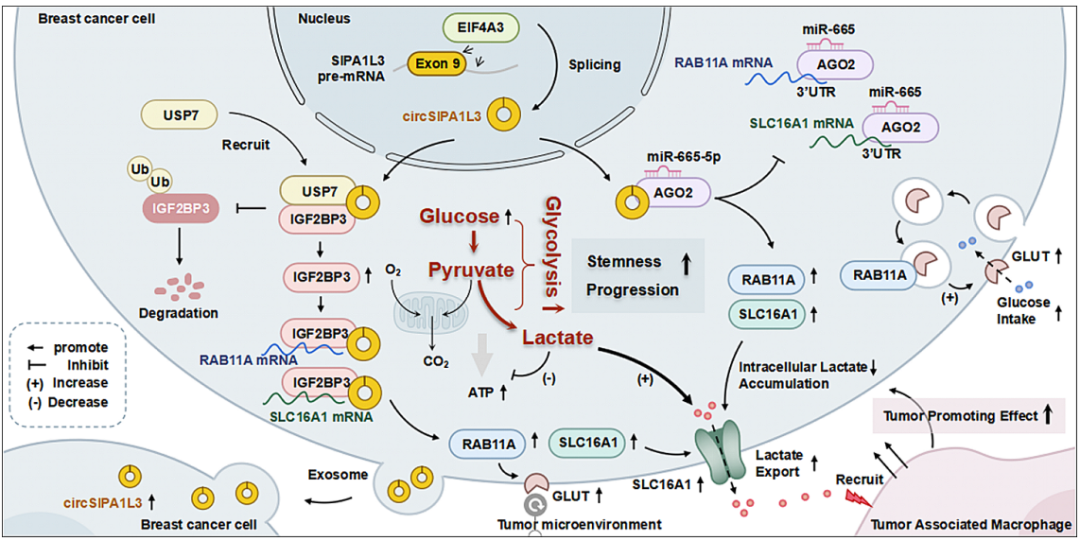
文章模式图(图源自Molecular Cancer )
非编码RNA参与多种肿瘤进展已被广泛报道。其中环状RNA (circular RNA, circRNA)是由pre-mRNA反向剪接形成共价闭合转录物,具有较高的稳定性、丰度和保守性。越来越多的证据强调了环状RNA在癌症相关生物学过程中的重要作用。外泌体是一种膜结合的细胞外囊泡,大小在40 ~ 120 nm之间,可以调节肿瘤微环境,通过传递各种生物活性分子实现细胞内通讯,在肿瘤发展过程中对肿瘤生长、免疫应答、代谢重编程和耐药等具有重要影响。在这一过程中,外泌体包膜的环状RNA引起了研究人员的高度关注,它可以塑造周围细胞的行为,随后改变肿瘤生态位。然而,外泌体环状RNA是否可以通过调节有氧糖酵解介导乳腺癌的进展及其潜在的机制需要进一步确定。
该研究通过RNA-seq分析鉴定葡萄糖代谢相关的circRNAs,发现circSIPA1L3受能量应激诱导显著,与乳腺癌患者预后不良相关。此外,circSIPA1L3可以被包装到外泌体中并传播到周围的肿瘤细胞,进一步促进乳腺癌的进展。机制上,EIF4A3参与上调circSIPA1L3,导致IGF2BP3及其靶基因的表达增加,进而通过促进糖酵解协同作用,对乳腺癌的发生和进展发挥刺激作用。综上所述,该研究描绘了外泌体circSIPA1L3在支持糖酵解癌症进展中的新作用,有望作为潜在的治疗靶点用于乳腺癌的临床干预。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02037-4


