【BCJ】循环CD19 CAR-T细胞及其亚群的动力学及对DLBCL结局的影响
时间:2024-06-11 18:01:20 热度:37.1℃ 作者:网络
循环CAR-T细胞亚群
CAR-T细胞疗法在治疗难治/复发性弥漫性大B细胞淋巴瘤(DLBCL)方面取得了重大进展,但只有不到半数患者实现长期疾病控制。一般认为,CAR-T治疗DLBCL的疗效与患者的免疫系统、CAR-T产品的组成、CAR-T细胞在体内扩增的大小和持久性有关。西班牙学者使用二代流式细胞术评估了血液中循环抗CD19 CAR-T细胞及其亚群的动力学,并确定它们在预测治疗反应方面的潜在效用。结果近日发表于《Blood Cancer Journal》。

研究结果
该研究纳入58例复发/难治性DLBCL患者(男性36例,女性22例;中位年龄62岁[32-79]岁),接受抗CD19 axicabtagene ciloleucel (axial -cel)或tisagenlecleucel (tisagenlecleucel)治疗。
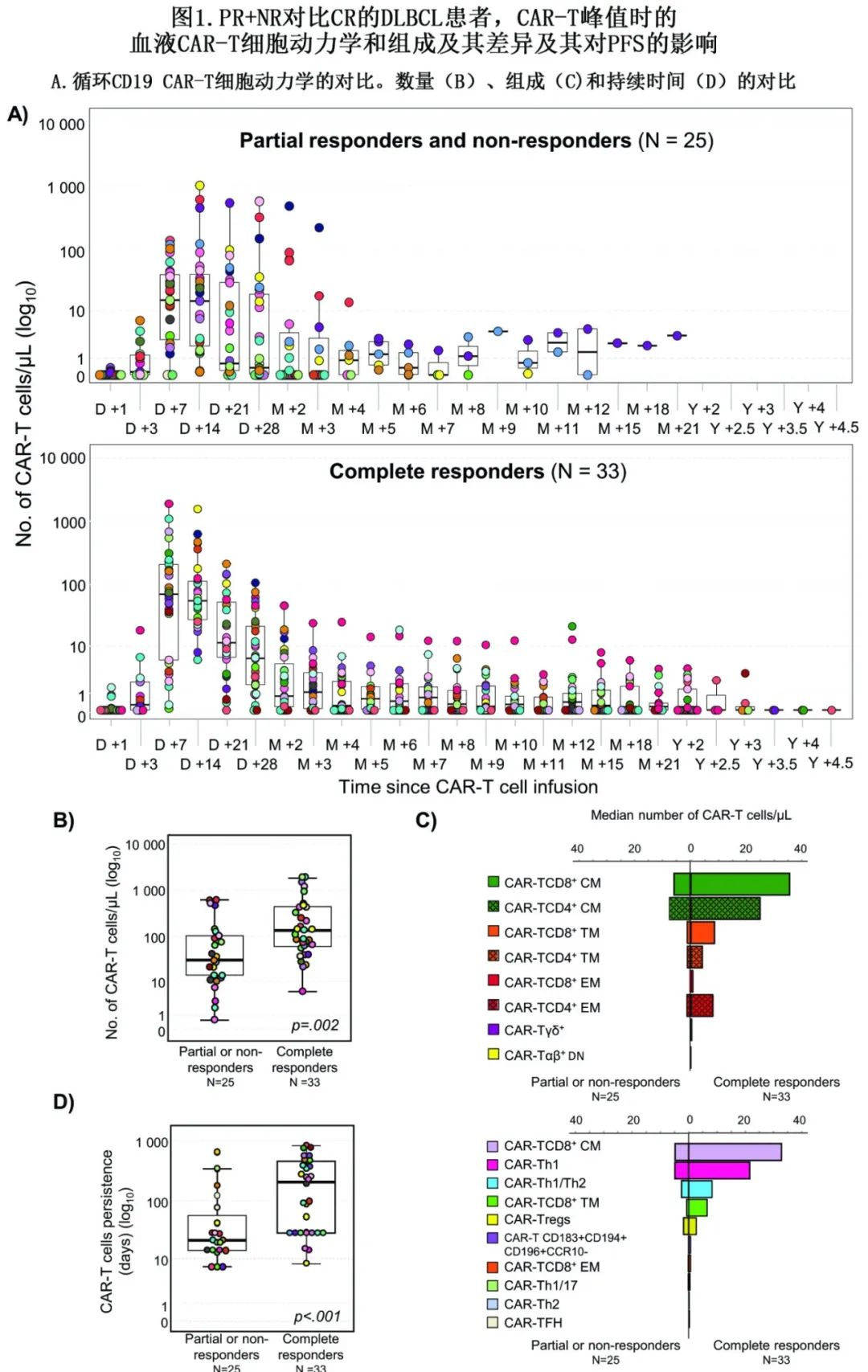
在整个人群中,抗CD19 CAR-T细胞在注射后第7天(50%)或第14天(43%)达到峰值,峰值中位数为68个CAR-T细胞/μL,由>75个不同CAR-T细胞亚群组成,其中12/75个亚群比例较高。CAR-TCD4+细胞 (中位40个细胞/μL)多于CAR-TCD8+细胞 (中位26个细胞/μL),其平衡分布分别为45%和54%。总体而言,CAR-TCD4+细胞和CAR-TCD8+细胞中,中枢记忆(CM) T细胞最多(分别为17和18个细胞/μL), CAR-TCD8+移行记忆(TM)细胞(4.3个细胞/μL)和CAR-TCD4+效应记忆(EM)细胞(3.8个细胞/μL)次之。CAR-T辅助1 (Th1)细胞(11个细胞/μL)、CAR-Th1/Th2细胞(4.9个细胞/μL)和调节性CAR-T细胞(2.2个细胞/μL)是扩增最多的功能性CAR-TCD4+细胞群;其他CAR-T细胞亚群多数<1细胞/μL。
正如预期,在整个监测期间,血液CAR-T细胞的数量与循环淋巴瘤细胞(CLC;r=-0.2;p<0.001)和正常残余B淋巴细胞(r=-0.3;p<0.001)的数量均呈负相关,只有8/58(14%)患者在CAR-T下降后B细胞发育不全持续恢复。另外10/58例患者(17%)短暂出现<5个正常残余B淋巴细胞/μL(中位数:0.4 vs 72 个B细胞/μL;p<0.001),随后在未维持正常B淋巴细胞恢复的情况下,检测到循环CAR-T细胞计数恢复/增加。
除7例患者CAR-T细胞治疗无效并早期死亡外,患者均在输注后随访≥3个月,总缓解率(ORR)为67%:33/58例(57%)患者在中位30天后达到完全缓解(CR),6/58(10%)患者部分缓解(PR),而19/58(33%)患者无反应(NR)且疾病进展。中位缓解持续时间未达到,且30例患者在输注后中位随访2年后仍持续CR高达4.5年。研究结束时,大多数DLBCL患者(30/58,52%)呈持久CR,25例(43%)未达到CR,3例(5.2%)CR后复发。CR患者与PR/NR患者相比,前者更多在早期时间点达到CAR-T峰值(第7天分别为55%和48%) (图1A),且CAR-T细胞扩增更大(分别为132和29个细胞/μL;p=0.002)(图1B, C)。CR与PR/NR患者相比,血液中CAR-T细胞的中位寿命显著更长(分别为8.3个月和1个月;p < 0.001)(图1D),即使在输注后>3年,前者血液中仍可检测到CAR-T细胞(图1A)。
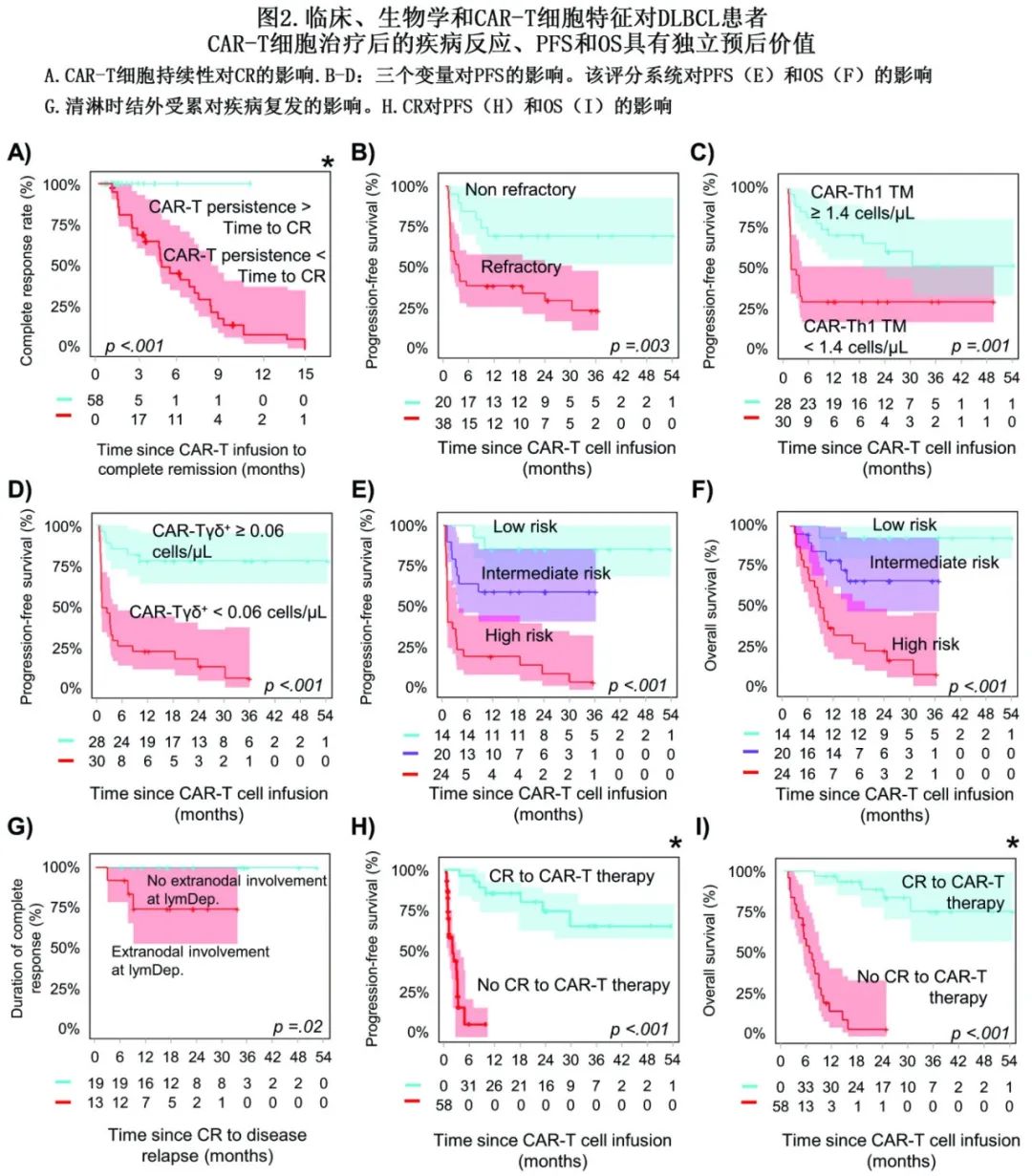
重要的是,在达到CR后保持可检测的CAR-T细胞(≥0.01细胞/μL)的患者也显示出显著较高的持续CR率(图2A)。
CR与PR/NR患者相比,输注后+1至+28天之间CAR-T细胞的中位扩增更高,以曲线下面积(AUC0-28)计算为:1505 vs 270天x细胞/μL (p=0.001)。同样,与PR/NR DLBCL相比,CR患者血液中大多数CAR-T细胞亚群的数量也更高,包括CAR-TCD4+的中位数(细胞/μL) (46 vs 15;p=0.006)、CAR-TCD8+ (53 vs. 9.2;p=0.001)和CAR-Tγδ+ (0.2% vs <0.001%;p<0.001)及其成熟相关CAR-TCD4+ CM (25 vs. 5.3;p=0.002)、CAR-TCD8+CM (33 vs. 4.4;p=0.002)和CAR-Tγδ+CM (0.2% vs <0.001%;p<0.001),以及更高的CAR-TFH (0.2 vs <0.001;p<0.03)、CAR-Th1 (22 vs. 4.3;p<0.001)和CAR-Th1/Th2 (9.9 vs. 1.8;p=0.02)功能亚群计数 (图1)。
CAR-T治疗后B细胞恢复的患者中有8/8达到CR(PR/NR患者中为0/25;p=0.007),其中1例在输注后8个月出现疾病复发。单采时或输注前出现CLC并不影响治疗反应。
多因素分析发现,单采前疾病状态 (OR=11.3)、CAR-Tγδ+细胞数/μL (OR=8.8)和CAR-Th1TM细胞/μL (OR=6.2)为CR的独立预测因子(图2B-D)。基于三个变量构建了一个评分系统以预测CR,包括单采时存在难治性疾病为2分、CAR-Tγδ+计数较低(峰值<0.06 细胞/μL)为1.5分、CAR-Th1 TM计数<1.4细胞/μL为1分(其他情况为0分)。将DLBCL患者分层为低危(评分0-1,14例[24%])、中危(评分1.5-3,20例[35%])和高危(评分≥3.5,24例[41%])DLBCL, CR率分别为100%、70% (OR=0.5)和仅21% (OR=0.3)(p<0.001)。
中位PFS为10个月,2年PFS率为45%。大多数达到CR的患者表现出持续缓解(30/ 33,91%),2年和4年CR率为90%。1例患者CD19阴性复发,另1例为CD19阳性复发,第三例患者通过PET扫描检测到复发,但组织学未证实。清淋时结外受累是影响CR患者疾病复发的唯一因素,因为所有3例复发的CR患者在清淋时均有结外受累,而无结外受累的CR患者均无复发(0/19)(p=0.03)(图2G)。研究结束时,27/58(47%)患者死于疾病进展(23/27,85%)和感染(4/27,15%),中位OS为2.5年,2年OS率为52%。正如预期,与CR相关的参数也是PFS和OS的预后特征(图2E-F)。
正如预期,CR是PFS和OS的唯一独立预测因子(两者的p<0.001)(图2H-I)。
总结
CR患者血液中CAR-T细胞的动力学和组成与非CR患者相比有显著差异。CAR-Tγδ+和CAR-Th1TM细胞的数量及单采时的疾病状态可在早期(CAR-TCD19峰值时)作为鉴别治疗失败(相对于CR)的高风险患者的独立预测因素。该结果强调了CAR-T细胞监测在CAR-T治疗DLBCL管理中的意义,以指导早期治疗决策,并首次指出CAR-Tγδ+细胞在治疗反应中的关键作用。在CAR-T细胞治疗的DLBCL患者中,TCRγδ+细胞的临床意义可能不仅是因为其强大的细胞毒能力和抗肿瘤活性(即使在没有HLA介导的抗原呈递的情况下),还因为它们能够从血液迁移到外周组织(在复发/难治性DLBCL中,结外浸润淋巴瘤细胞经常发生)。此外,与标准的抗CD19 CAR-Tαβ+细胞不同,CAR-Tγδ+细胞在体外和体内均表现出对CD19阳性和CD19阴性肿瘤细胞的反应性,表明CAR-Tγδ+细胞即使在抗原丢失后也可能靶向CD19肿瘤细胞,并通过其TCR保持特异性。
该研究强调了CAR-T治疗后T细胞反应的复杂性和多样性,可能不仅仅取决于CAR-Tαβ+细胞。因此,在制备过程中选择或消耗特定的CAR-T细胞亚群(例如CAR-Tγδ+细胞)(也包括从CAR-T细胞产品中选择或消耗),可能有助于增加治疗的成功或失败,因此强调了体外表征和监测血液CAR-T细胞以及单采时的疾病状态的价值,可用于早期识别有治疗失败风险的DLBCL患者。
参考文献
Martín-Martín, L., Gutiérrez-Herrero, S., Herrero-García, M. et al. Impact of the kinetics of circulating anti-CD19 CAR-T cells and their populations on the outcome of DLBCL patients. Blood Cancer J. 14, 83 (2024). https://doi.org/10.1038/s41408-024-01065-z


