读书报告 | KRAS突变位点可预测FTD/TPI治疗转移性结直肠癌的生存获益风险
时间:2023-11-30 14:31:11 热度:37.1℃ 作者:网络
导读
近年来,结直肠癌的发病率不断上升,已成为一个全球性的公共卫生挑战。曲氟尿苷替吡嘧啶片 (FTD/TPI,TAS-102)是晚期转移性结直肠癌(mCRC)的新型三线治疗药物。用于曾经接受氟尿嘧啶,奥沙利铂和伊立替康为基础的化疗,及抗VEGF和抗EGFR治疗的转移性结直肠癌患者的治疗。该化疗药物对部分患者有持久而明显的疗效,但在未经选择的mCRC患者中的临床获益有限,中位OS仅约1.8个月。因此,迫切需要寻找一种生物标志物,以识别适合接受FTD/TPI化疗的患者。虽然RAS/RAF突变基因检测被广泛应用于mCRC的诊疗常规,且已被证明可用于预测EGFR抗体的疗效,但是目前临床缺乏用于指导化疗的基因组生物标志物。若能找到类似的用于预测FTD/TPI化疗疗效的基因标志物,可减少患者的不必要毒性和经济负担。在mCRC中44%患者携带KRAS突变,其中28%的患者存在KRAS G12突变,8%的患者携带KRAS G13突变。
该研究通过对37例mCRC患者接受曲氟尿苷替吡嘧啶片(FTD/TPI)化疗的全基因组分析,确定KRAS密码子G12(KRASG12)突变是潜在的耐药性生物标志物。研究者还收集了960名接受FTD/TPI化疗的mCRC患者的真实世界数据,无论在总体研究人群,还是RAS/RAF突变患者, KRAS G12突变,相比无KRAS G12突变患者有较差的OS。另外,研究者还分析了全球、双盲、安慰剂对照的3期RECOUSE试验(n=800名患者)的数据,验证了与安慰剂相比,KRASG12突变是FTD/TPI化疗患者总生存期(OS)获益降低的预测性生物标志物。最后,研究者进行了基础试验,证明了KRASG12突变通过抑制FTD诱导的DNA损伤以降低mCRC对FTD/TPI化疗的反应,但是不影响对5-FU(主要阻碍RNA合成)的敏感性。
Nicola Valeri 团队使用来自三个不同国家的两个独立的真实世界数据集和一个基于全球、双盲、安慰剂对照、Ⅲ期RECURSE试验的独立验证队列,证明了KRAS不同密码子突变可预测mCRC中接受FTD/TPI化疗患者的OS获益。KRAS G12突变者接受FTD/TPI化疗无明显OS获益;KRASG13突变代表更差的预后以及对FTD/TPI更高的敏感性。由于KRASG12和KRASG13突变的mCRC具有不同的临床特征。因此,提示我们不要在生物标志物分析和临床试验设计中将不同密码子的KRAS突变集中在一起,因为不同的生物学和生化特性可能与不同的临床结局有关(Nat Med. 2023 Mar;29(3):605-614. doi: 10.1038/s41591-023-02240-8)。
背景
曲氟尿苷替吡嘧啶片 (FTD/TPI,TAS-102) 是晚期转移性结直肠癌(mCRC)的新型三线治疗药物。用于曾经接受氟尿嘧啶,奥沙利铂和伊立替康为基础的化疗,抗VEGF和抗EGFR治疗的转移性结直肠癌患者的治疗。该化疗药物对部分患者有持久而明显的疗效,但在未经选择的mCRC患者中的临床获益有限,中位OS仅约1.8个月。因此,迫切需要寻找一种生物标志物,以识别适合接受FTD/TPI化疗的患者。
目前临床缺乏用于指导化疗的基因组生物标志物。RAS/RAF突变基因检测被广泛应用于mCRC的诊疗常规,且已被证明可用于预测EGFR抗体的疗效,若能找到类似的用于预测FTD/TPI化疗疗效的基因标志物,可减少患者的不必要毒性和经济负担。
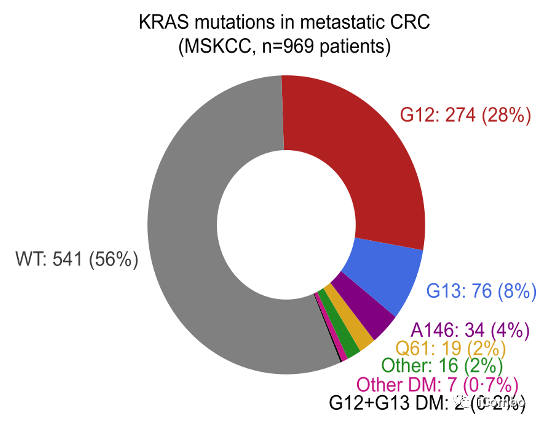
在mCRC中44%患者发现了KRAS突变;28%的患者存在KRAS密码子G12突变,8%的患者携带KRAS G13密码子突变。
摘要
Nicola Valeri 团队证明了KRASG12突变可用于预测FTD/TPI方案的耐药性。
该研究通过对37例mCRC患者接受曲氟尿苷替吡嘧啶片 (FTD\/TPI)化疗的全基因组分析,确定KRAS密码子G12(KRASG12)突变是潜在的耐药性生物标志物。
研究者收集了960名接受FTD/TPI化疗的mCRC患者的真实世界数据,无论在总体研究人群,还是RAS/RAF突变患者,KRAS G12突变,相比无KRAS G12突变患者有较差的OS。
研究者还分析了全球、双盲、安慰剂对照的3期RECOUSE试验(n=800名患者)的数据,验证了与安慰剂相比,KRASG12突变是FTD/TPI化疗患者总生存期(OS)获益降低的预测性生物标志物。
最后,研究者进行了基础研究,证明了KRASG12突变通过抑制FTD诱导的DNA损伤以降低mCRC对FTD/TPI化疗的反应,但是不影响对5-FU(主要阻碍RNA合成)的敏感性。

寻找标志物

研究者对37名荷兰的FTD/TPI治疗的mCRC患者的全基因组分析,共发现了10个与mCRC OS相关的基因标志物,其中KRASG12突变与OS降低的关系最密切。因此,研究者认为KRASG12突变有潜力作为预测FTD/TPI化疗疗效的基因标志物。
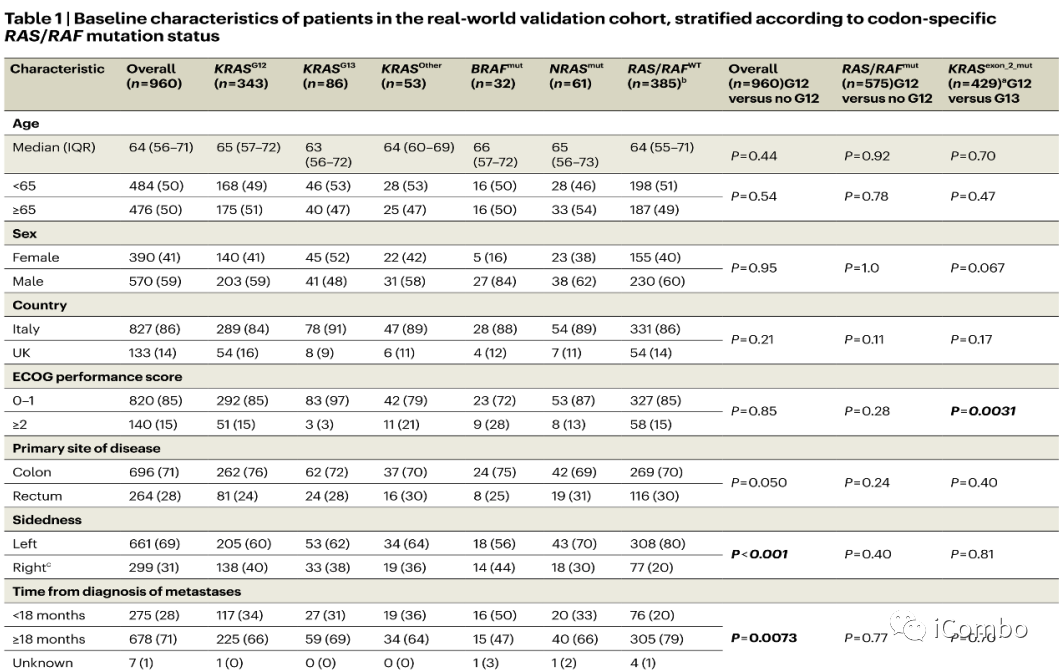
在意大利和英国的36个中心960名接受FTD/TPI治疗的mCRC患者的真实世界数据。
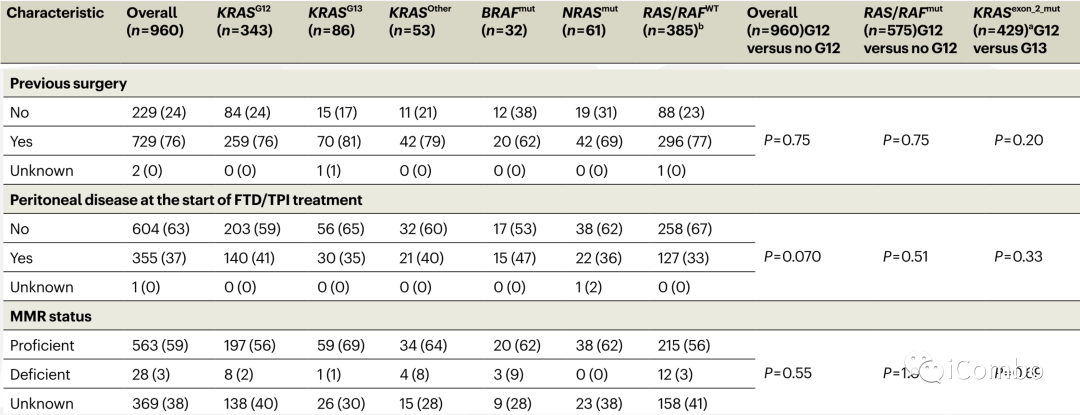
该队列包含385名RAS/RAF野生型(WT)343名KRASG12突变患者、86名KRASG13突变患者、53名G12或G13以外密码子处的KRAS突变患者(KRASother)、32名BRAF突变患者和61名NRAS突变患者。
真实世界中接受FTD/TPI治疗的960名mCRC患者的RAS/RAF突变与OS的相关性
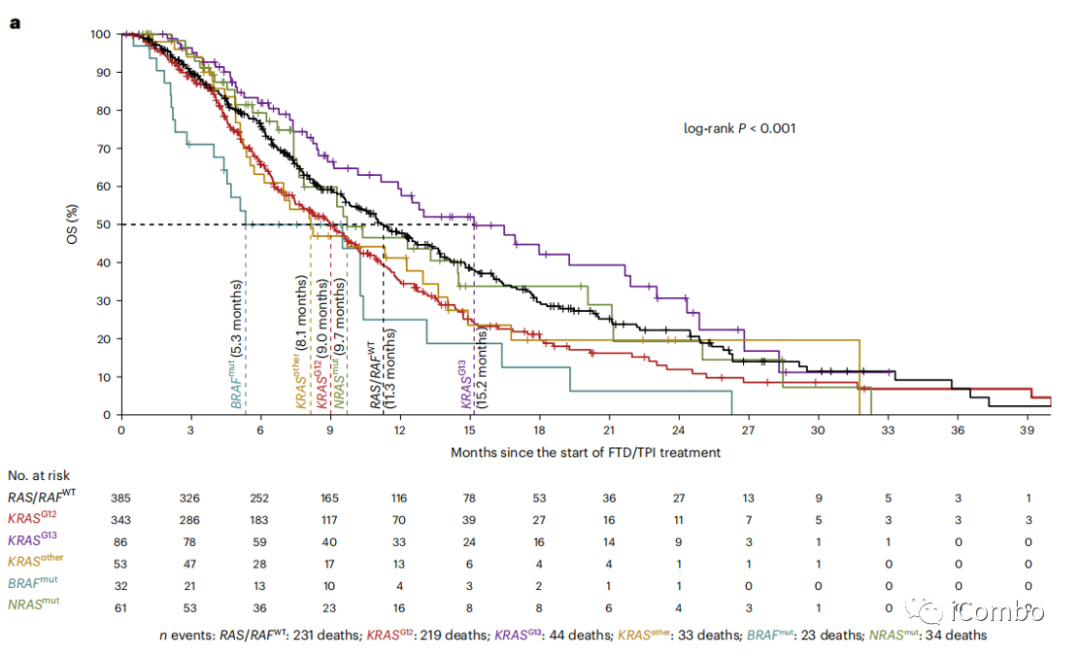
密码子特异性RAS/RAF突变与FTD/TPI治疗的OS明显差异显著相关。
KRASG12突变与较差的治疗后OS显著相关
真实世界中证明KRAS G12突变与FTD/TPI化疗疗效的关系
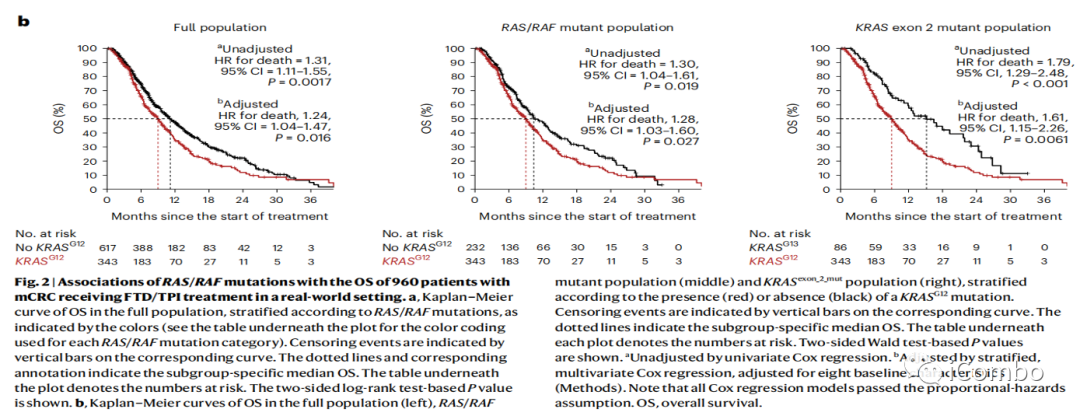
无论是在总体研究人群,还是RAS/RAF突变患者, KRAS G12突变,相比无KRAS G12突变患者有较差的OS
在KRAS exon 2 突变患者中,KRAS G13突变者的治疗后OS显著优于KRAS G12突变。
说明KRAS基因不同密码子的突变具有不同的生物学特征和FTD/TPI的治疗效果。
RECOURSE trial中KRAS突变与FTD/TPI治疗后生存的关系
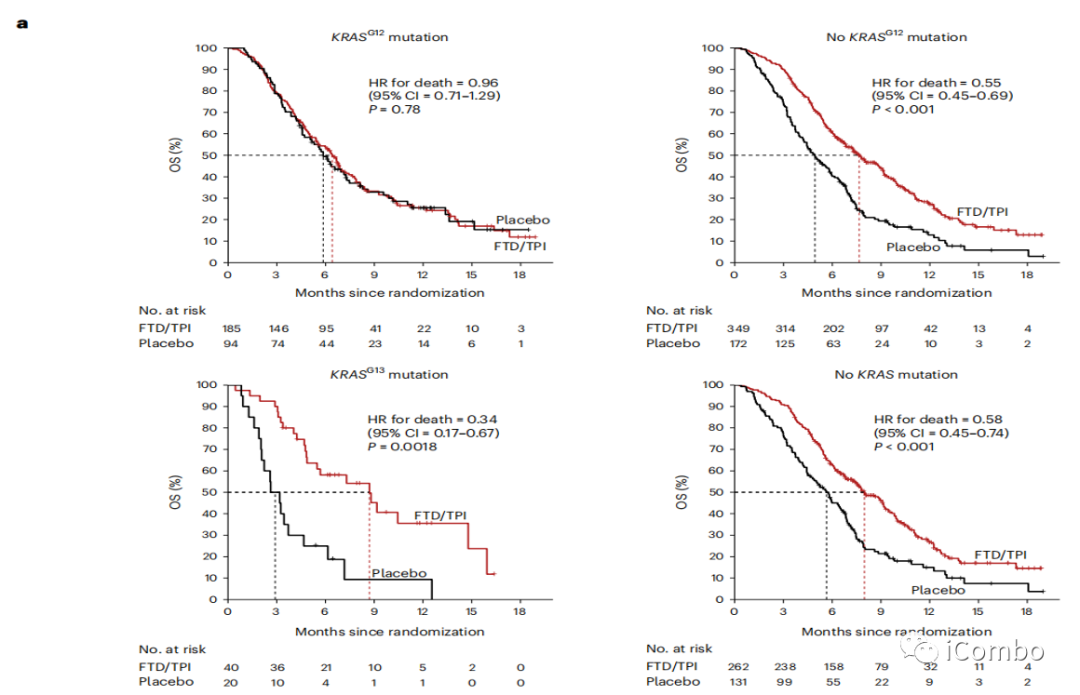
在KRASG12突变患者中,治疗组和安慰剂组OS无明显差异(P=0.78)。
无KRASG12突变的患者,FTD/TPI与安慰剂相比产生了显著的OS益处,mOS延长2.8个月。
KRASG13突变的患者在FTD/TPI组中表现出明显的OS益处,FTD/TPI组的中位OS是安慰剂组的三倍(8.7个月对2.9个月);
无KRAS突变的患者,FTD/TPI与安慰剂相比,OS延长2.3个月。
RECOURSE trial中800名多线治疗后mCRC患者按2:1的比例接受FTD/TPI或安慰剂治疗。
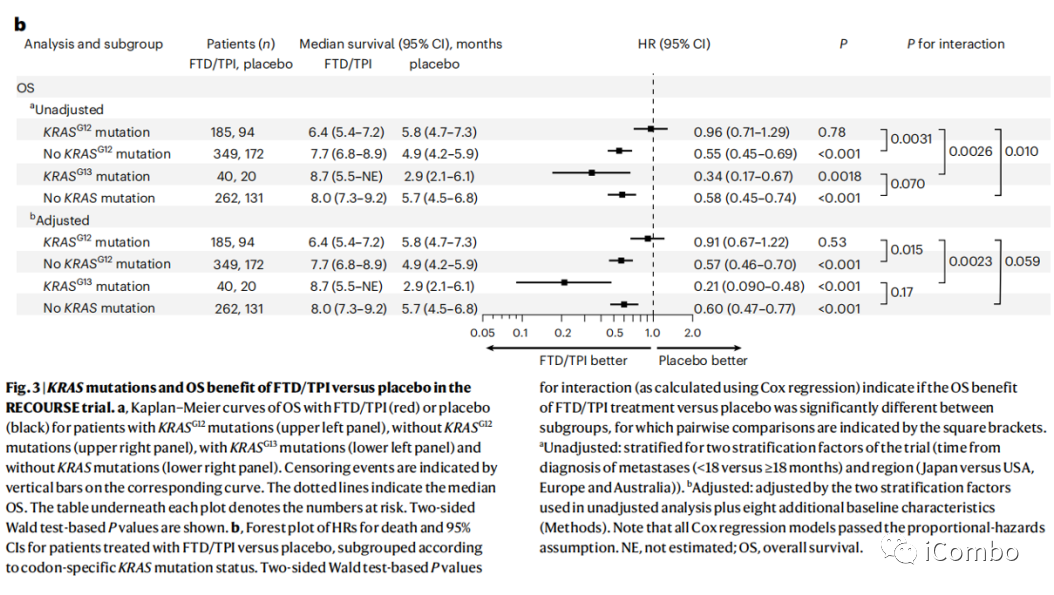
在安慰剂组中,KRASG13突变者的OS(2.9月)显著低于KRASG12突变者(5.8个月),在治疗组中,KRASG13突变者有明显的FTD/TPI治疗后OS获益(8.7个月)。
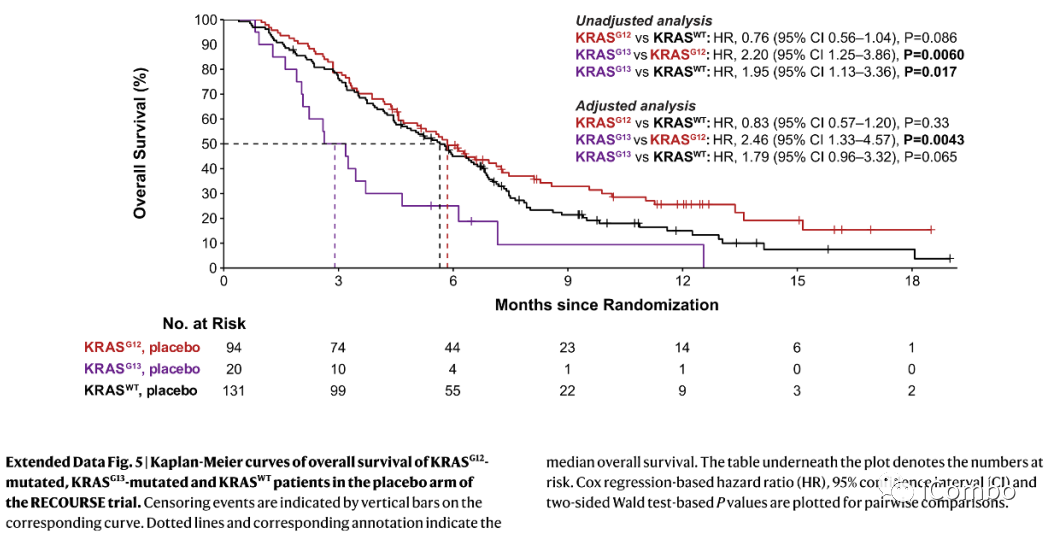
RECOURSE trial中
安慰剂组,KRAS G13突变OS较G12突变更差
治疗组,KRAS G13突变OS获益更明显
mCRC细胞系和肿瘤类器官中KRAS G12突变与FTD的体外耐药性
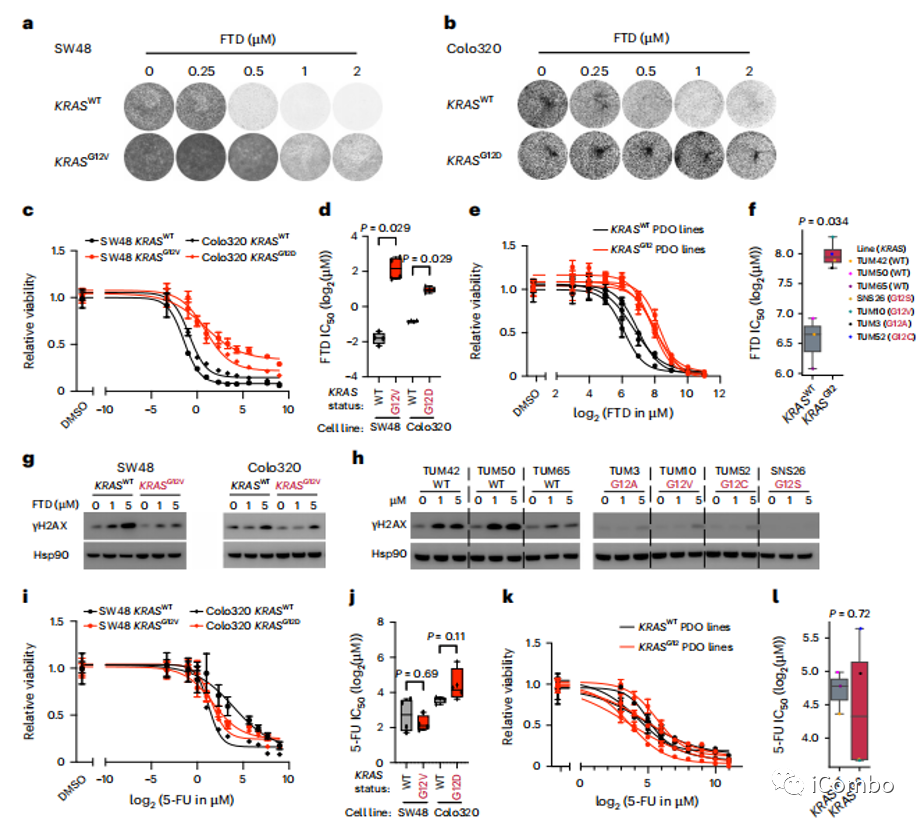
图4a~d:在两种结直肠癌细胞系中,相较于KRAS野生型,KRASG12突变的细胞系可以在更高浓度的FTD中存活。
图4d~f:在患者来源类器官(PDOs)中重复该试验得到了相同结果,KRASG12突变株始终显示出FTD反应性降低。
图4g~h:与KRASWT对比,FTD治疗后KRASG12A,G12V、G12C、G12S的DNA损伤标记物γH2AX表达更低。
图4i~l:KRASG12突变对5-FU的敏感性并无明显影响。
结论和讨论
该研究使用来自三个不同国家的两个独立的真实世界数据集和一个基于全球、双盲、安慰剂对照、3期RECURSE试验的独立验证队列,证明了密码子特异性KRAS突变可预测mCRC中接受FTD/TPI化疗患者的OS获益。
KRASG12突变者接受FTD/TPI化疗无明显OS获益;
KRASG13突变代表更差的预后以及对FTD/TPI更高的敏感性。
KRASG12和KRASG13突变的mCRC具有不同的临床特征。该研究提醒人们不要在生物标志物分析和临床试验设计中将不同密码子的KRAS突变集中在一起,因为不同的生物学和生化特性可能与不同的临床结局有关。
KRASG12突变导致FTD/TPI疗效下降的机制是限制了FTD的DNA损伤作用,且对5-FU无效。
该实验仅找到不适合接受FTD/TPI化疗的基因标志物,但未寻找适合接受FTD/TPI化疗的基因标志物。


