CMI:复旦大学团队研究表明靶向GSDME介导的巨噬细胞极化增强肝癌抗肿瘤免疫
时间:2024-11-10 20:00:16 热度:37.1℃ 作者:网络
尽管抗PD1疗法对肝细胞癌(HCC)患者疗效显著,但大多数患者出现耐药性。
2024年11月4日,复旦大学Dai Zhi唯一通讯在Cellular & Molecular Immunology在线发表题为“Targeting GSDME-mediated macrophage polarization for enhanced antitumor immunity in hepatocellular carcinoma”的研究论文,该研究收集了9例接受抗PD1单药治疗的HCC患者的肿瘤组织,并进行RNA测序。结果显示抗PD1耐药患者中肿瘤相关巨噬细胞(TAM)表达的GSDME显著上调。
此外,HCC组织中GSDME+巨噬细胞水平升高的患者预后较差。单细胞测序数据和流式细胞术分析显示,抑制非肿瘤细胞中GSDME表达导致HCC肿瘤微环境(TIME)中M2型巨噬细胞的比例降低,同时增强CD8+ T细胞的细胞毒性。巨噬细胞内GSDME的非N端片段与PDPK1结合,从而激活PI3K-AKT通路并促进M2型极化。小分子Eliprodil抑制了GSDME位点1介导的PDPK1磷酸化。依利普地尔和抗PD1联合治疗在c-Myc+/+、Alb-Cre+/+小鼠和流体动力学尾静脉注射HCC模型中均有效,为新型联合免疫疗法提供了一种潜在方法。

肝细胞癌(HCC)占原发性肝脏恶性肿瘤的绝大部分(75-85%),是2020年全球第六大最普遍和第三大致命癌症。尽管手术切除、肝移植和全身药物治疗等方法成效显著,但由于复发率和转移率高,HCC患者的生存概率仍然低于20%。检查点抑制剂免疫疗法是临床转化研究的重点,在部分HCC患者中表现出显著的抗肿瘤效果。然而,耐药性的普遍性阻碍了其治疗效果。因此,免疫检查点阻断(ICB)与其他疗法的整合有望成为治疗HCC的一种创新策略。
M1(促炎)和M2(抗炎)巨噬细胞是两种公认的巨噬细胞亚型。在实体瘤组织中,肿瘤相关巨噬细胞(TAM)经常转化为M2表型,加速肿瘤进展。此外,TAMs不仅影响肿瘤细胞的存活和死亡途径,还具有强大的免疫抑制作用,可促进肿瘤生长和治疗耐药性。TAM对CD8+ T细胞的活性有直接或间接的抑制作用。然而,巨噬细胞的耗竭可以增强CD8+ T细胞的抗肿瘤效果。由于TAM在肿瘤微环境中的调节功能,当前研究关注TAM对肿瘤免疫治疗的作用,重编程或复极化TAM以表现出抗肿瘤特征,并将其与PD1抗体联合使用达到改善免疫治疗的目的。
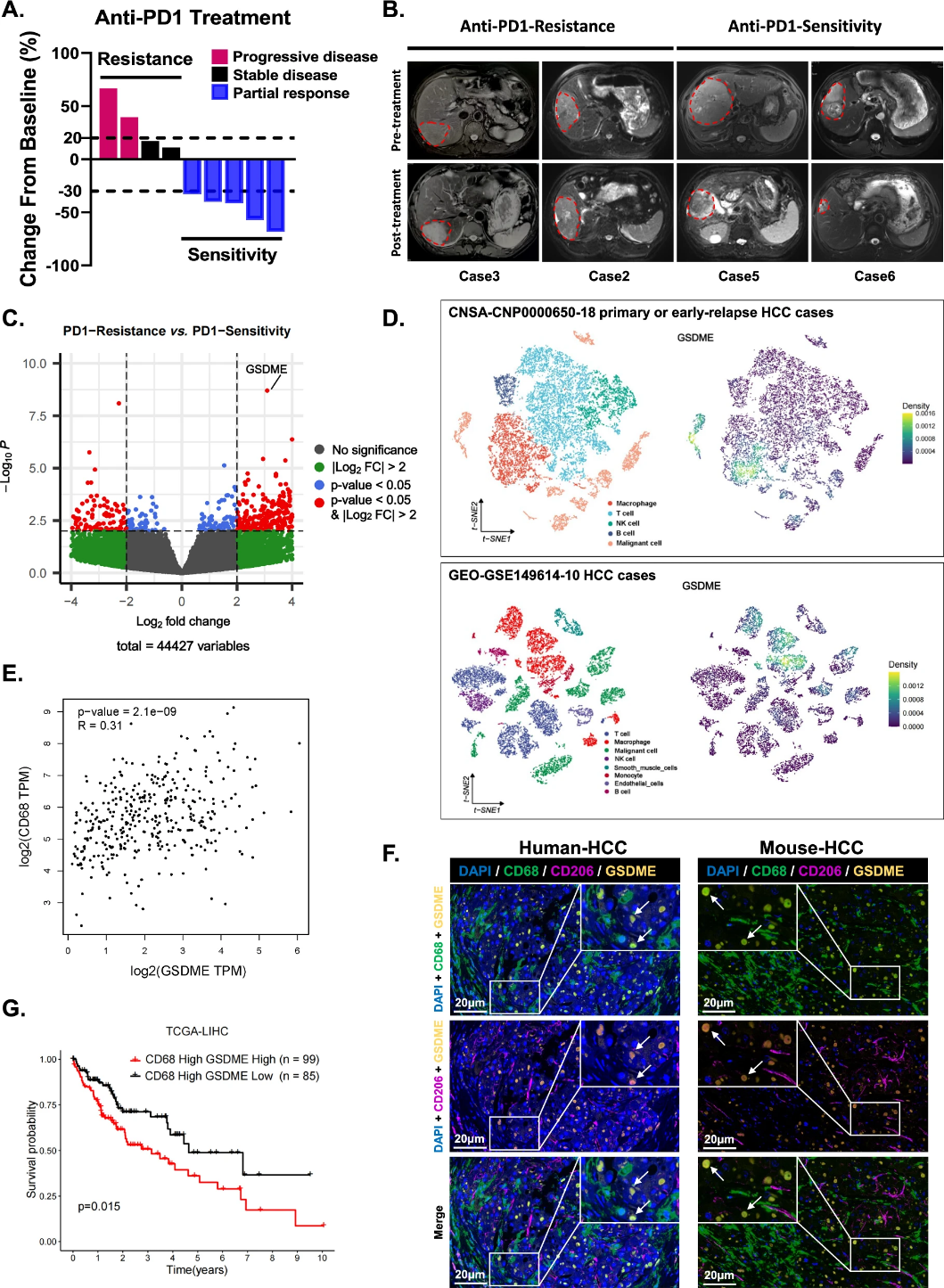
图1 GSDME阳性巨噬细胞可能与HCC患者的抗PD1治疗耐药和不良预后有关(摘自Cellular & Molecular Immunology)
DFNB59、GSDMA、GSDMB、GSDMC、GSDMD和GSDME是gasdermin(GSDM)家族的6种同源基因编码蛋白。大多数GSDM被裂解产生N端片段,该片段可能形成膜孔,破坏膜完整性并诱导细胞焦亡。与其他家族成员不同,GasderminE(GSDME)的活性形式基于caspase-3(一种参与肿瘤细胞死亡的酶),可以诱导焦亡。既往研究表明,GSDME促进细胞焦亡,释放促炎物质,产生促免疫微环境并抑制肿瘤发展。然而,新研究表明,GSDME促进胰腺癌和结肠炎相关的结直肠癌发展。
RNA测序结果显示,对抗PD1治疗产生耐药性的HCC患者GSDME水平升高,且TAMs是表达GSDME的主要细胞,这可能与GSDME介导的焦亡机制相冲突。因此,需要进一步研究GSDME在特定情况下可能存在的致癌机制。该研究旨在探讨GSDME在巨噬细胞极化诱导的抗PD1耐药中的调节机制,确定了一种新的联合疗法来改善抗PD1耐药性并增强HCC的治疗效果。
参考消息:
https://www.nature.com/articles/s41423-024-01231-0


