广州医科大学附属第六医院赵国军教授等STTT综述:线粒体自噬途径及其对人类疾病的影响
时间:2023-09-01 20:01:51 热度:37.1℃ 作者:网络
线粒体是具有多种功能的动态细胞器。它们参与细胞坏死和程序性凋亡,对细胞的新陈代谢和存活至关重要。线粒体自噬作为一种细胞保护机制,可以去除多余或功能失调的线粒体,并维持线粒体数量以平衡细胞内稳态。越来越多的证据表明,线粒体自噬作为一种急性组织应激反应,在维持线粒体网络健康方面发挥着重要作用。由于及时清除异常线粒体对细胞存活至关重要,细胞进化出了多种线粒体自噬途径,以确保在各种环境下都能及时激活线粒体自噬。更好地了解线粒体自噬在各种疾病中的作用机制对于疾病治疗和治疗靶点设计至关重要。
2023年8月16日,广州医科大学附属第六医院赵国军教授,阿尔伯塔大学医学院章大卫教授在《Signal Transduction and Targeted Therapy》杂志发表题为“The mitophagy pathway and its implications in human diseases”的综述文章。本文由广州医科大学附属第六医院王守亮,龙海姣和侯连杰等共同撰写。
本文总结了线粒体自噬介导线粒体消除的分子机制,线粒体自噬如何在系统和器官水平上维持线粒体的平衡,以及线粒体自噬的改变与神经、心血管、肺、肝、肾等疾病的发生发展有何关系等最新进展。最后,本文突出总结了潜在的临床应用,并概述了线粒体自噬调节剂进入临床试验前应当满足的条件。线粒体自噬信号转导的研究进展将对精准医疗新治疗策略的开发具有重要作用。
线粒体自噬的途径和机制
研究最早,最经典的途径为PINK1-Parkin介导的线粒体自噬。泛素链在线粒体上的组装对于PINK1-Parkin介导的线粒体自噬来说至关重要。该组件包含三个关键组件:PINK1作为线粒体损伤传感器,Parkin作为信号放大器,泛素链作为信号效应器。它们共同确定受损线粒体如何激活线粒体自噬。此后,线粒体上的泛素链被自噬接头(P62、NBR1、NDP52/CALCOCO2、TAX1BP1 和 OPTN)识别,自噬体封装泛素标记的线粒体以进行溶酶体降解(图1)。
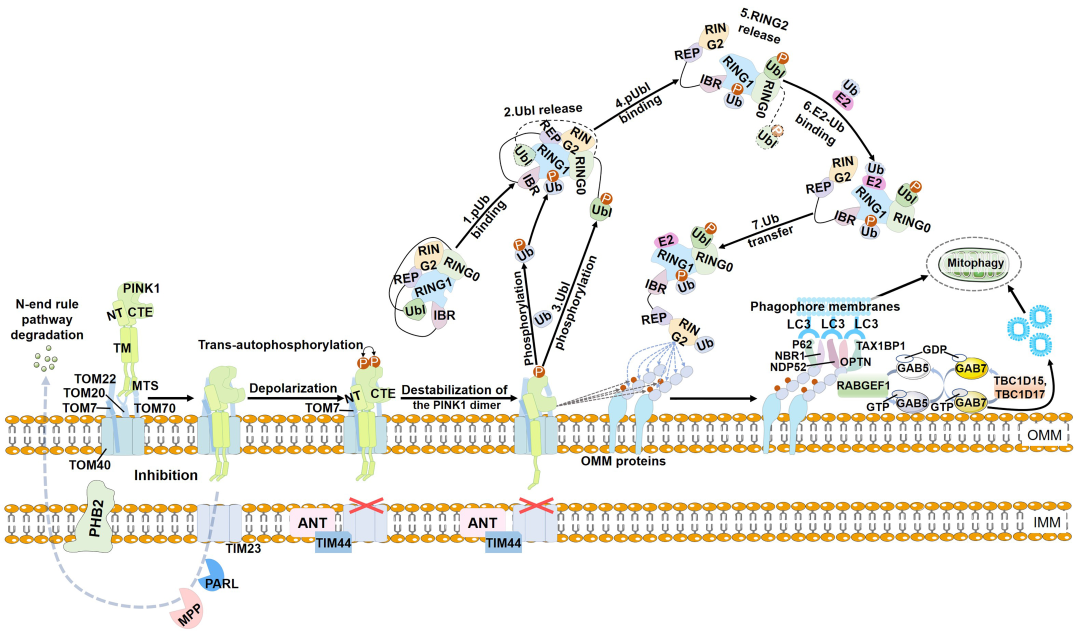
(图1)
随着对线粒体自噬的研究不断发展,多种非依赖于PINK1-Parkin介导的线粒体自噬途径被发现。与Parkin一样,ARIH1,SIAH1,MUL1,HUWE1和GP78同属于E3泛素连接酶,它们可独立于PINK1-Parkin途径泛素化受损线粒体从而启动线粒体自噬。此外,自噬受体心磷脂、PHB2、MCL-1、SAMM50、MUL-1、FUNDC1、NIX、BNIP3、BCL2L13和FKBP8可单独与LC3结合以介导线粒体自噬。铁的损失会导致HIF1α降解受损,从而通过HIF1α-SP1轴增强FTMT的表达。OMM定位的FTMT与NCOA4的相互作用增加了FTMT与LC3的共定位,从而促进线粒体自噬(图2)。
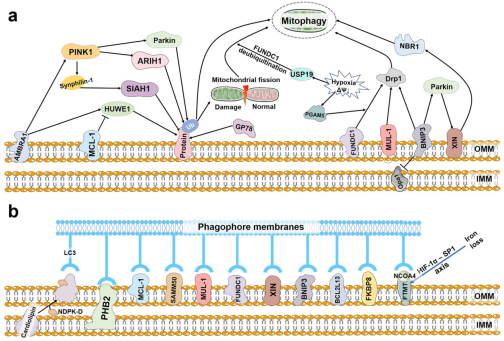
(图2)
线粒体自噬维持线粒体稳态,避免各种疾病的发生
线粒体的主要功能是分子氧化和偶联磷酸化以产生ATP。同时,线粒体通过能量代谢的连锁反应产生ROS。功能正常的线粒体及时清除多余的ROS,使ROS维持在较低水平,有利于细胞增殖。当线粒体受损时,ROS 的清除受到损害,导致ROS水平升高和细胞凋亡。因此,通过线粒体自噬有效去除受损的线粒体而不损害健康的线粒体至关重要。线粒体始终是动态的,通过不断的裂变和融合来改变形状和大小。在裂变和融合过程中,分布在线粒体外膜的MFN1和MFN2与线粒体内膜中的Opa1一起调节线粒体融合,而Drp1主要调节线粒体分裂。受损的线粒体可引起不对称裂变,形成两个具有不同膜电位的子线粒体,一个去极化,另一个完全极化。然后,去极化的线粒体被线粒体自噬清除,以保留正常功能的线粒体。然而,线粒体自噬会减少线粒体的数量,从而减少向身体提供的能量。AMP/ATP和NAD+/NADH比率的增加及时激活线粒体生物发生。线粒体自噬和线粒体生物发生的平衡对于维持线粒体稳态是必要的。不受控制的线粒体自噬会破坏这种线粒体稳态,从而导致线粒体处于失平衡。各器官的能量供应无法得到满足,从而引发神经、心血管、肺、肝、肾、骨骼肌等系统疾病的发生(图3)。
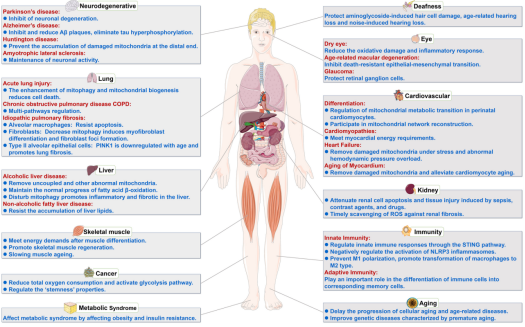
(图3)
线粒体自噬在靶向治疗中的局限性和发展
当今,线粒体自噬的药理调节成为了治疗线粒体相关疾病的有效方法之一。然而,由于整体研究时间较短,线粒体自噬调节剂的研究仍处于初步阶段,大部分数据来自临床前研究。在这些调节剂进入临床试验或研究强效的新型有效调节剂之前,应先满足两个条件。第一,为了达到治疗目标,这些调节剂必须专门针对线粒体来调节线粒体自噬。AUTAC是一种自噬靶向嵌合体,具有降解标签(鸟嘌呤衍生物)和弹头,可提供目标特异性。当 AUTAC 靶向线粒体时,它会通过非 PINK1-Parkin 途径去除受损的线粒体,从而改善线粒体质量。此外,基因编辑是另一种有前景的专门针对线粒体自噬的治疗方法。
其次,为了确保线粒体自噬受到严格和精确的调控,并能够简单实用地评估治疗效果,找到能够可靠、特异性检测线粒体自噬通量的生物标志物至关重要。最近,一种新开发的线粒体自噬探针 mito-SRAI 可以检测固定样品和活体样品中的线粒体自噬通量,并已用于体外治疗性线粒体自噬诱导剂的高通量筛选。Mito-SRAI 是一种 TOLLES-YPet 荧光蛋白,靶向线粒体基质,对溶酶体环境具有抵抗力。无论线粒体自噬活性如何,TOLLES 都保持完整,而 YPet 会被线粒体自噬有效降解,从而可以量化 FRET 测量。由于mito-SRAI具有良好的荧光和生化特性,它的发现将大大加速线粒体自噬调节剂的寻找,甚至可能为线粒体自噬通量的临床检测带来巨大希望。
总的来说,在这些年的研究中,人们已经在细胞水平基础上,对线粒体自噬如何,为何以及在何种特定的条件下被激活等方面取得了显著的进展。线粒体自噬在多种疾病中的重要性已得到充分的证实。然而,线粒体自噬比人们想象的要复杂得多,并且会因代谢状态,应激条件,组织或发育阶段而异。多种途径介导线粒体自噬,表现出平行性、替代性和功能冗余。关于不同线粒体自噬途径之间的相互作用,不同线粒体自噬受体在不同生理和病理条件下的时空调控规律以及线粒体自噬的组分在体内的作用等问题依然存在和需要被解决。人们在线粒体自噬机制研究转化为治疗有效药物方面的研究还存在一片空白。尽管关于线粒体自噬仍有许多悬而未决的问题,但这些问题一旦被解决,将对目前尚无有效治疗方法的疾病带来巨大的希望。
原文链接:
https://www.nature.com/articles/s41392-023-01503-7


