食物中毒引起的呕吐是身体在保护你,那么具体它都做了些什么呢?
时间:2023-01-05 21:03:21 热度:37.1℃ 作者:网络
相信不少人已经经历了今冬第一波新冠疫情的冲击,正走在由“阳”转“阴”的路上。高烧虽然退了,咳嗽声却还此起彼伏,而这正是人体的一种自我保护机制,通过咳嗽和咳痰,将咽喉部、气管及支气管中的分泌物排出体外,清理与病毒的“第一战场”。
同样,恶心呕吐也是身体的一种自我保护机制。当我们吃下可能被寄生虫或病原体污染的食物时,呕吐就是身体排出毒素的重要方式之一,那么,人体是如何“知道”并“指挥”胃肠道进行呕吐的呢?而在癌症化疗的副作用中,恶心呕吐也是最令患者感到反感的现象之一,我们又是否能够找到阻断这一现象的靶点,让患者拥有更好的治疗体验?
近日,中国北京生命科学研究所的团队在老鼠身上对类似的呕吐过程进行了从肠道到大脑的全程追踪,尽管老鼠因为食道过长、肌肉力量过弱而并没有真正的呕吐行为,但在分子和细胞水平上,研究人员依然建立起了肠-脑对毒素的完整防御反应。相关成果以“The gut-to-brain axis for toxin-induced defensive responses”为题发表于Cell。

图1 研究成果(图源:[1])

图2 小鼠出现干呕行为(图源:[1])
过去的研究表明迷走神经在毒素诱导的呕吐中至关重要,而迷走神经传入神经的目标脑区是髓质中的背侧迷走神经复合体(Dorsal vagal complex,DVC)。研究人员对表达Fos基因的神经元进行标记。Fos基因则会在神经元被激活的很短时间内开始表达,可以作为神经元激活的一种标志物。结果表明,SEA处理的小鼠的DVC中大量神经元被标记,这些神经元的化学遗传失活将损害干呕样行为和CFA,表明了肠-脑轴在其中的参与。
进一步量化DVC中几种神经肽编码基因的表达发现,前原速激肽1(preprotachykinin 1,Tac1)在SEA处理3小时后表达Fos,极有可能参与干呕样行为和CFA。后续对Tac1+DVC神经元的失活处理损害了干呕样行为,但未损害CFA。
通过Tac1+DVC神经元光诱发突触后电流可被谷氨酸受体拮抗剂阻断,而GABA A受体拮抗剂对其没有影响,可以发现Tac1+DVC神经元释放的神经递质是谷氨酸而不是GABA。敲除Tac1基因或表达囊泡谷氨酸转运蛋白的Slc17a6基因都会损害干呕样行为和CFA,表明Tac1+DVC神经元释放的谷氨酸和Tac1编码的神经肽确实参与其中。
为了确定支配Tac1+DVC神经元的肠-脑回路,研究人员使用重组狂犬病病毒进行了逆行追踪,结果发现,Tac1+DVC神经元由同侧迷走神经感觉神经元和几个大脑区域单突触支配。迷走神经感觉神经元的肠绒毛粘膜末端接近肠嗜铬(Enterochromaffin,EC)细胞。EC细胞负责5-羟色胺(5-HT)的合成和分泌,那么迷走神经感觉神经元是否对5-HT有反应呢?
研究人员进一步敲除了小鼠EC细胞合成5-HT所必需的基因,结果损害了干呕样行为和CFA。氟西汀(一种常见的抗抑郁药,能阻断神经元对5-HT的再摄取)的单独使用不会引起干呕样行为,但可以促进SEA诱导的干呕样行为,表明5-HT的快速再摄取可能参与了毒素诱导的呕吐的调节。
使用荧光指示剂对Tac1+DVC神经元进行成像,结果发现当小鼠表现出干呕样行为时,荧光瞬时增加,且荧光信号能够与干呕样行为在时间和张嘴的幅度上对齐,表明Tac1+DVC神经元对干呕样行为的幅度和持续时间进行编码。迷走神经的切断或使用HT3R拮抗剂均显著降低荧光信号的振幅,表明这一信号是由迷走神经感觉神经元从肠道传输到Tac1+DVC神经元。
人为使用光遗传学激活Tac1+DVC神经元也能诱发小鼠的干呕样行为,且时间取决于光刺激的频率和激光功率。化学遗传激活Tac1+DVC神经元同样能够诱发干呕样行为和CFA,表明Tac1+DVC神经元的激活足以使小鼠产生反应。
对Tac1+DVC神经元投射的下游进行考察,发现一部分Tac1+DVC神经元投射到腹外侧延髓的腹侧呼吸群(ventral respiratory group,rVRG),另一部分投射到脑桥的外侧臂旁核(lateral parabrachial nucleus,LPB)。过去的研究表明rVRG与呕吐有关,LPB与厌恶味觉记忆有关,后续的实验也验证了投射到这两个不同区域的两群Tac1+DVC神经元确实分别参与干呕和CFA。
测试SEA和化疗药物多柔比星如何唤起本研究中确定的肠-脑回路发现,SEA和多柔比星并不会直接激活肠道EC细胞,而是首先在肠道中引起炎症损伤,肠上皮细胞随后释放警报细胞因子IL33来间接诱导EC细胞释放5-HT。
至此,毒素—肠上皮细胞—IL33—EC细胞—5-HT—迷走神经感觉神经元—Tac1+DVC神经元—rVRG/LPB—干呕/CFA的整条回路被完整揭示。
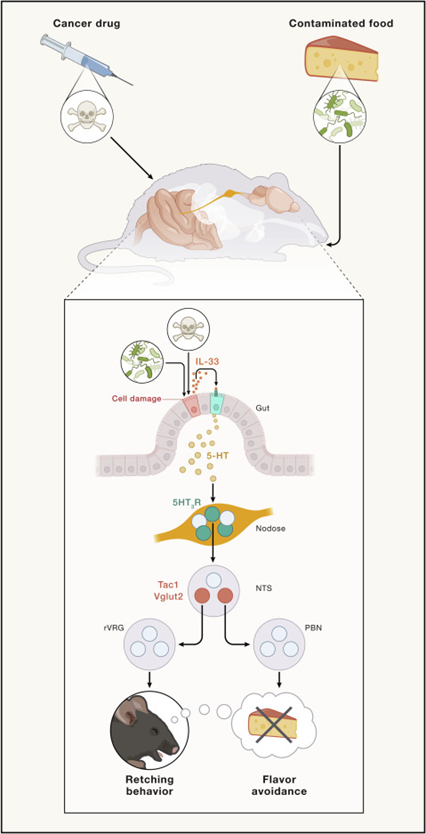
图3 毒素诱导呕吐的肠-脑回路(图源:[2])
这项研究在分子和细胞的层面上确定了参与毒素诱导的防御反应的肠-脑回路,有助于人们更好地理解食物中毒和化疗中的副作用。这项研究为未来抗呕吐药物的研发开辟了新的道路,同时这项研究的通讯作者、北京生命科学研究所曹鹏博士表示:“除了食源性细菌,人类还会遇到很多病原体,我们的身体也配备了类似的机制来排出这些有毒物质,研究大脑如何感知病原体的存在并启动反应清除它们,这是一个令人兴奋的新研究领域。”
参考资料:
[1]Xie Z, Zhang X, Zhao M, et al. The gut-to-brain axis for toxin-induced defensive responses. Cell. 2022 Nov 10;185(23):4298-4316.e21. doi: 10.1016/j.cell.2022.10.001. Epub 2022 Nov 1. PMID: 36323317.
[2]Jane Y. Chen, Richard D. Palmiter, A gut-retching discovery, Cell, Volume 185, Issue 23, 2022, Pages 4249-4251, ISSN 0092-8674, https://doi.org/10.1016/j.cell.2022.10.015.


