EMM:天津医科大学余鹰/闫华发现治疗视网膜新生血管的潜在新途径
时间:2023-01-05 21:02:17 热度:37.1℃ 作者:网络
病理性视网膜血管新生常引起失明。目前针对增殖性视网膜病变的抗血管生成治疗以血管内皮生长因子(VEGF)为靶点,但对许多患者并没有很好的疗效。
2022年12月13日,天津医科大学余鹰及闫华共同通讯在EMBO Molecular Medicine(IF=14)上在线发表题为“PGF2α facilitates pathological retinal angiogenesis by modulating endothelial FOS-driven ELR+ CXC chemokine expression”的研究论文,该研究报道了在2型糖尿病伴增殖性视网膜病变患者中循环前列腺素(PG) F2α代谢物增加,并且来自氧诱导视网膜病变(OIR)小鼠模型的视网膜内皮细胞(ECs)中PGF2α受体(Ptgfr)上调。此外,ECs中PTGFR受体的破坏减弱了小鼠的OIR。
PGF2α通过释放ELR+ CXC趋化因子,如CXCL8和CXCL2,促进人视网膜微血管内皮细胞(HRMECs)的增殖和管状形成。在机制上,PGF2α/PTGFR轴通过Gq/CAMK2G/p38/ELK-1/FOS通路增强了HRMECs中ELR+ CXC趋化因子的表达。PDR患者视网膜ECs中可观察到FOS介导的ELR+ CXC趋化因子表达上调。此外,PTGFR抑制剂以CXCR2依赖的方式减缓了小鼠OIR的发展。因此,抑制PTGFR可能是治疗视网膜新生血管的新途径。

病理性视网膜新生血管以异常增生的血管簇结构为特征,是早产儿视网膜病变和增生性糖尿病视网膜病变的标志,这是发达国家儿童和成人严重视力丧失的主要原因。血管内皮生长因子(VEGF)是一种多效性原血管生成因子,可以促进这些疾病的发展,因此是有价值的治疗靶点。尽管抗VEGF治疗对增生性视网膜病变有益,但抗VEGF药物的短期作用需要频繁干预。此外,相当一部分患者对VEGF靶向药物反应差或无反应。这些临床观察表明,其他信号通路通过增加各种促血管生成因子或促炎症脂质介质的局部生产,参与了视网膜血管的生成。因此,确定增生性视网膜新生血管发病机制中涉及的其他因素是至关重要的。
前列腺素(PGs)是一组炎性脂质介质,在炎症和维持组织稳态中起着至关重要的作用。它们通过环加氧酶(COXs)和下游PG合酶从花生四烯酸中酶促衍生。非甾体抗炎药(NSAIDs)通过抑制COX活性和减少PGs产生来发挥镇痛和退烧作用。COX-2亚型在人糖尿病视网膜病变患者的视网膜血管和星形胶质细胞以及在缺血性增殖性视网膜病变的啮齿动物模型中表达。在实验性啮齿动物模型中,抑制COX-2抑制视网膜血管生成。
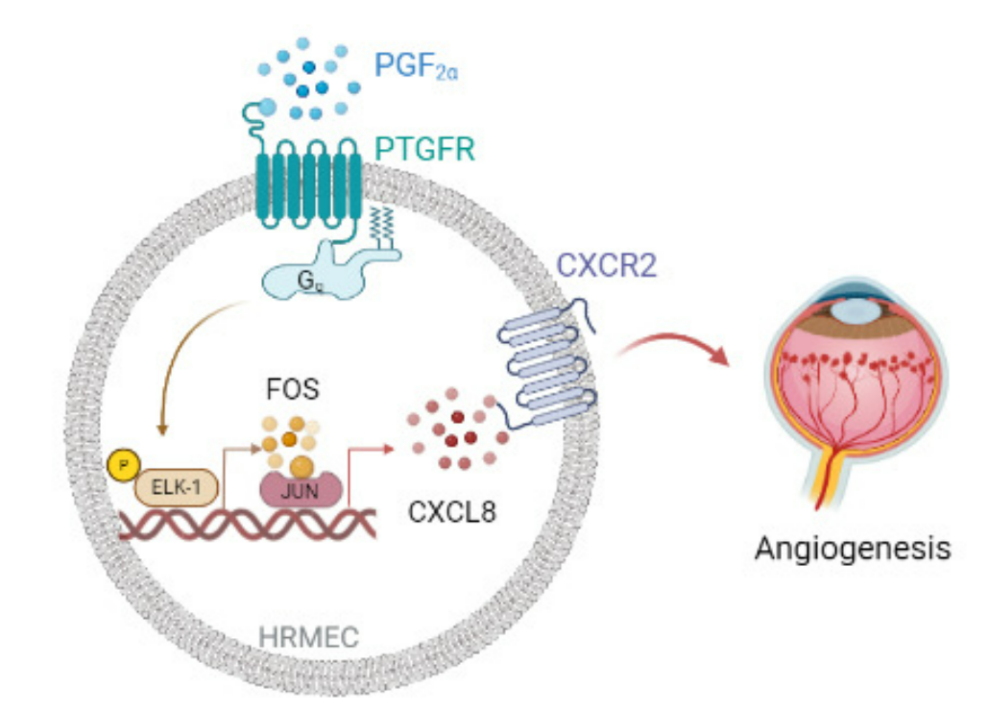
PGF2α/PTGFR轴促进小鼠氧诱导视网膜病变(OIR)(图源自EMBO Molecular Medicine )
与其他注射用非甾体抗炎药相比,外用易于渗透的尼帕芬酸能更有效地缓解大鼠氧诱导的视网膜病变(OIR) 。这些观察表明COX产生的PGs可能参与了增殖性视网膜病变的进展。PGs通过与特定的G蛋白偶联受体结合来发挥其生理作用。PGF2α促进分娩的发生和完成,并通过F -前列腺素受体(PTGFR)调节眼葡萄膜流出来降低眼压。因此,PGF2α类似物被广泛用于青光眼治疗有趣的是,糖尿病患者循环中的PGF2α水平明显高于健康对照组。然而,PGF2α在增殖性糖尿病视网膜病变(PDR)中的确切作用仍有待确定。
在该研究中,研究人员发现PDR患者以及小鼠OIR模型中PGF2α的生成显著增加。PTGFR受体在OIR小鼠血管增殖期视网膜内皮细胞(ECs)中表达。ECs中的PTGFR缺失主要通过抑制ECs增殖来减轻小鼠氧诱导的视网膜病变。机制上,PGF2α/PTGFR轴通过CAMK2G/p38/ELK-1/FOS途径介导的ELR+ CXC趋化因子分泌促进HRMEC增殖。AL8810阻断PTGFR受体减弱OIR小鼠视网膜新生血管。因此,抑制PTGFR受体可能是治疗PDR的一种新方法。
参考信息:
https://doi.org/10.15252/emmm.202216373


