Adv Mater:陈学思/李明强/陶玉设计新型的脂质体,增强肿瘤免疫治疗效果
时间:2023-01-03 15:03:34 热度:37.1℃ 作者:网络
自然杀伤(NK)细胞疗法显示出肿瘤治疗的潜力,但过度表达的肿瘤细胞表面免疫抑制聚糖对其免疫治疗效果产生较大的负面影响。为逆转这种糖介导的免疫抑制,需要下调表面NK抑制性聚糖的表达,同时将NK激活性聚糖同步提高到最佳水平。
2022年12月24日,中国科学院长春应用化学研究所陈学思、中山大学李明强和陶玉共同通讯在Advanced Materials 在线发表题为“Membrane-fusion-mediated multiplex engineering of tumor cell surface glycans for enhanced NK cell therapy”的研究论文,该研究设计了一种核-壳膜融合脂质体(MFL),通过膜融合的方式,同时实现肿瘤细胞表面NK活化多糖的物理修饰和免疫抑制多糖的生物抑制。将其负载到肿瘤微环境触发的可降解温敏水凝胶中,MFLs可便捷注射并可控地释放到肿瘤局部。
通过与肿瘤细胞膜融合,释放的MFLs可同时将载有唾液酸转移酶抑制剂的核心递送到细胞质中,并将NK激活聚糖修饰的外壳锚定在肿瘤表面。细胞中核、壳的空间差异分布确保了细胞内唾液酸转移酶的有效抑制,从而下调免疫抑制性唾液酸,同时在肿瘤表面直接呈递激活NK的Lewis X三糖(LeX)。因此,唾液酸引起的肿瘤表面免疫抑制被重新编程为LeX诱导的NK激活导致对NK细胞介导的识别和裂解的敏感性,从而提高肿瘤治疗效果。该MFL的构建为多重细胞工程和细胞间相互作用的个性化调节提供了一个崭新平台,可用于癌症免疫治疗的增强。

在临床前和临床研究中,自然杀伤(NK)细胞疗法,无论是过继性NK疗法还是NK引发疗法都利用外源性或内源性NK细胞的强免疫力来识别并杀死各种血液和实体肿瘤。通过与各自的肿瘤配体特异性结合后直接调节活化和抑制性NK细胞表面受体之间的信号平衡,NK细胞的抗肿瘤细胞毒性可以不受主要组织相容性复合体和抗原呈递的限制而启动。然而,肿瘤细胞表面NK相关配体分子的改变极大地限制了NK细胞疗法的治疗效果。
膜相关聚糖是肿瘤表面存在的重要NK相关信号分子,调节肿瘤对NK介导的免疫识别和细胞毒性的抗性。在恶性肿瘤转化过程中,癌症细胞表面的NK活化聚糖表达减少,而免疫抑制聚糖表达显著增加,导致对NK识别和活化的免疫抵抗,从而 逃避NK细胞毒性的杀伤,损害其治疗效果。因此,将这些免疫抑制表面聚糖改造为NK激活型前景广阔,可以重新激活NK介导的识别和细胞毒性来抑制肿瘤。
为了将表面聚糖的免疫抑制彻底改造为NK激活,可实施提高表面NK激活聚糖(如壳聚糖、硫酸乙酰肝素、α-半乳糖神经酰胺)水平和抑制NK抑制聚糖(如唾液酸、半乳糖凝集素、乙酰半乳糖胺)表达两种策略,而同一治疗中结合两种策略能够触发更有效的NK激活和治疗效果。基于纳米颗粒的共给药系统通过在同一颗粒中容纳多种聚糖工程药物来提高聚糖编辑效率,显示出这两种策略整合的潜力。然而,因为组合药物在细胞内的不同作用位点对聚糖工程来说收效甚微,难以将两种策略的聚糖工程效率同时最大化。
一些聚糖工程药物(细胞工程药物、酶、抗体等)旨在直接改造肿瘤细胞表面的聚糖,而其他药物(化学药物、基因药物等)则被设计为干扰肿瘤细胞的糖合成过程,以间接改变表面聚糖。传统的共递送纳米颗粒通常被设计为通过内吞途径被肿瘤细胞内化,这使所有组合聚糖工程药物在亚细胞水平的相同位点同时释放,故组合药物的统一亚细胞共定位难以根据两种药物不同的内在机制同时优化其聚糖工程效率。因此,基于纳米颗粒的精细策略,可以在亚细胞水平上将两种或多种聚糖工程组合药物精确地输送到对应的作用位点,实现肿瘤表面聚糖信号的有效多重重塑以增强NK介导的抗肿瘤反应。
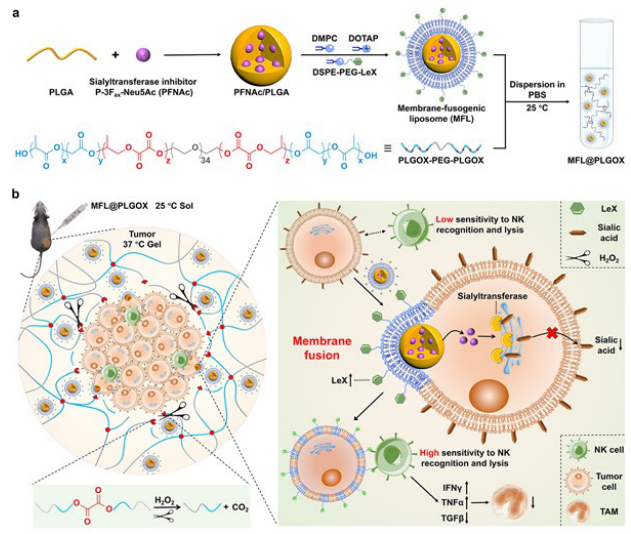
原位注射MFL@PLGOX增强基于NK细胞的癌症治疗示意图(摘自Advanced Materials )
该研究应用含膜融合脂质体(MFL)水凝胶(MFL@PLGOX)展示了一种多重表面聚糖工程策略,该策略可以通过与肿瘤细胞的膜融合,同时修饰NK-激活聚糖并原位下调肿瘤表面的免疫抑制聚糖表达。MFL具有核-壳结构,其中唾液酸转移酶抑制剂(P-3Fax-Neu5Ac,PFNAc)装载在PLGA聚合物核中,NK活化的Lewis X三糖(LeX)缀合在脂质壳上。随后将MFL整合到含草酸盐的热敏聚合水凝胶中,即聚(乳酸-羟基乙酸-草酸盐)-b-聚(乙二醇)-b-聚(乳酸-羟基乙酸-草酸盐)(PLGOX-PEG-PLGOX),以获得MFL@PLGOX作为维持聚糖重塑的释放库,从而优化聚糖工程功效。
MFL@PLGOX可以在室温(25℃)下局部注射到肿瘤中,且因肿瘤生理条件温度(37℃)比PLGOX-PEGPLGOX的溶胶-凝胶转变温度(32℃)更高而快速胶凝。随后因肿瘤环境中过量的H2O2引发PLGOX-PEG-PLGOX骨架中草酸盐键断裂,凝胶逐渐降解原位释放MFLs。释放的MFL注入肿瘤细胞膜,并将含LeX的脂质直接锚定在细胞表面,而载有PFNAc的核心则被递送到细胞质中。由于核、壳在同一细胞的空间差异分布,MFL能够通过PFNAc有效抑制细胞内唾液酸转移酶,从而降低表面唾液酸表达,同时在表面直接呈递NK激活LeXs。因此,MFLs使α2, 3-唾液酸表达减少85.6%,α2, 6-唾液酸水平减少70.0%,同时肿瘤细胞表面的LeX表达增加4.3倍,将富含唾液酸的肿瘤表面重新编程为LeX修饰的表面。
免疫耐受表面聚糖转变为免疫激活型将充分重新激活肿瘤浸润性NK细胞的识别和裂解,从而增强抗肿瘤免疫反应。MFL@PLGOX在B16F10荷瘤小鼠中有效地触发NK依赖性抗肿瘤反应,增强了肿瘤抑制效果。将MFL@PLGOX与过继NK疗法组合时,也观察到治疗效果的显著改善。因此,该研究提出了一种新的肿瘤表面聚糖信号的多重工程策略,用于增强基于NK的免疫治疗,为细胞表面信号的多模式定制和细胞间相互作用的个性化调节提供了一种有效的方法。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202206989


