FDA授权礼来的COVID-19抗体疗法用于12岁以下儿童
时间:2021-12-06 10:01:33 热度:37.1℃ 作者:网络
礼来(Eli Lilly)公司近日表示, FDA 已经扩大了 bamlanivimab 和 etesevimab 联合给药的紧急使用授权(EUA),包括某些从出生到 12 岁以下的高危儿科患者。更广泛的适应症允许将 COVID-19 抗体疗法用作轻度至中度 COVID-19 的治疗以及暴露后预防。
据该公司称,EUA 使 bamlanivimab 和 etesevimab 成为第一种针对 COVID-19 的中和抗体疗法,可在该人群中紧急使用。抗体鸡尾酒(bamlanivimab 和 etesevimab)在 2 月份获得了 EUA,剂量为 bamlanivimab 700mg 联合 etesevimab 1400mg,用于治疗 12 岁及以上的高危患者。
FDA 的最新决定是基于 II/III 期 BLAZE-1 试验中 125 名儿童和婴儿参与者的数据,他们至少有一个严重的 COVID-19 危险因素。结果显示,受试者在接受 bamlanivimab 700mg 和 etesevimab 1400mg 治疗后平均 7 天后症状消失(图)。
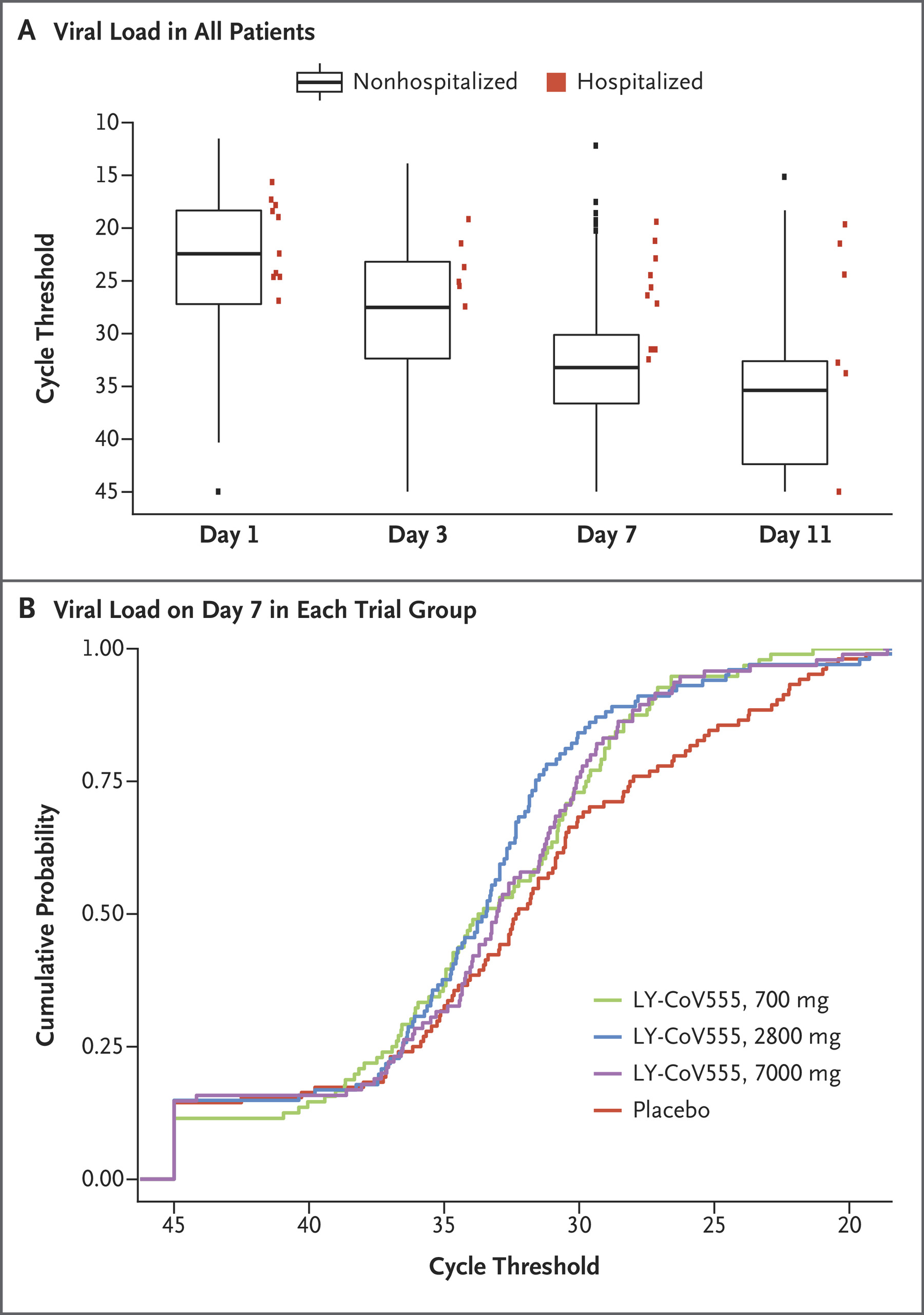
在这项正在进行的涉及最近诊断出轻度或中度 Covid-19 的门诊患者的 II 期试验中,我们随机分配 452 名患者接受单次静脉输注中和抗体的三种剂量(700 毫克、2800 毫克或 7000 毫克) 或安慰剂,并评估定量病毒学终点和临床结果。主要终点是第 11 天病毒载量相对于基线的变化。此处报告了截至 2020 年 9 月 5 日的预先计划的中期分析结果。在中期分析时,观察到的整个人群的对数病毒载量从基线的平均下降为 -3.81,消除了超过 99.97% 的病毒 RNA。 对于接受 2800 毫克剂量COVID-19抗体疗法的患者,与安慰剂相比,病毒载量从基线降低了 3.4 倍。
礼来公司表示,BLAZE-1 中的儿科受试者均未因 COVID-19 死亡或需要住院治疗。然而,FDA 指出,在联合或不联合etesevimab的情况下,使用 bamlanivimab 观察到了严重的不良事件,包括超敏反应、过敏反应和输液相关反应。bamlanivimab 和 etesevimab 一起给药的可能副作用包括恶心、头晕、瘙痒和皮疹。
原始出处:
https://firstwordpharma.com/story/5455045


