Cell:叶克强/李丹/张振涛开发新型PET示踪剂,有望创新帕金森病诊断手段
时间:2023-07-11 15:27:21 热度:37.1℃ 作者:网络
突触核蛋白病的特征是α-突触核蛋白(α-Syn)聚集在大脑中。正电子发射断层扫描(PET)成像的突触核蛋白病需要放射性药物选择性结合α-Syn沉积物。
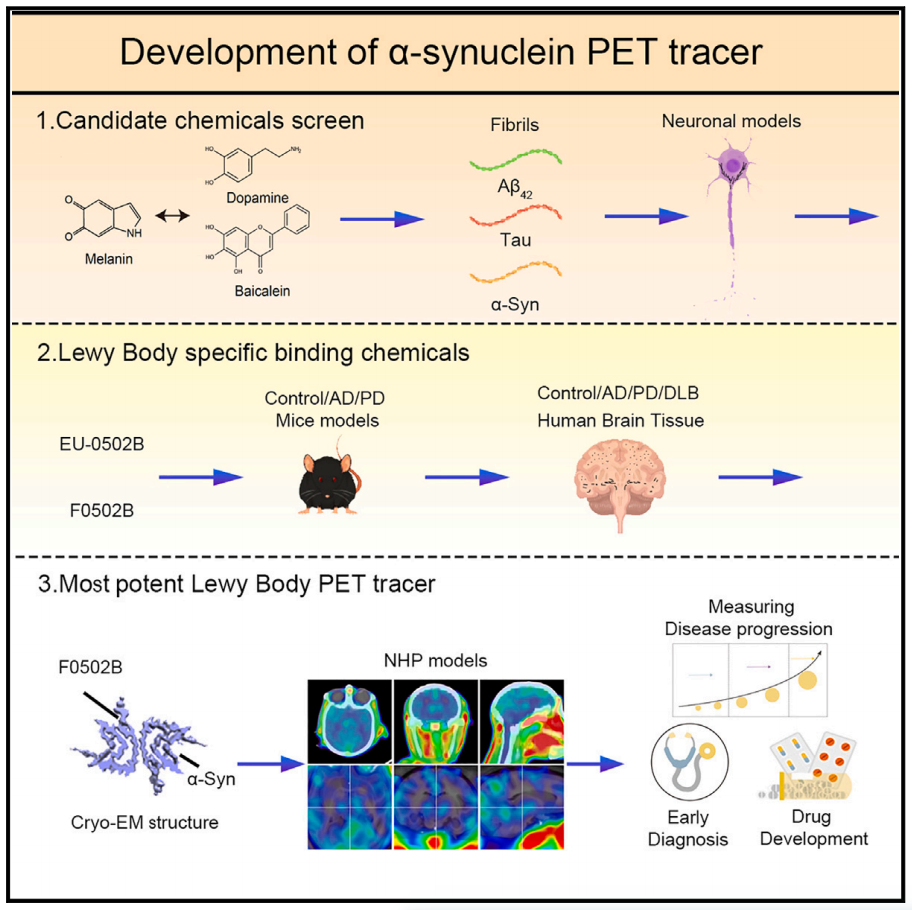
2023年7月7日,中国科学院深圳先进技术研究院叶克强、上海交通大学李丹及武汉大学张振涛共同通讯在Cell 在线发表题为“Development of an α-Synuclein positron emission tomography tracer for imaging synucleinopathies”的研究论文,该研究报道了一种脑渗透和快速冲洗的PET示踪剂[18F]-F0502B,该示踪剂对α-Syn具有高结合亲和力,但对Aβ或Tau原纤维没有亲和力,并且在脑切片中优先结合α-Syn聚集体。
通过对几种小鼠模型和人类受试者的体外原纤维、神经元内聚集体和神经退行性疾病脑切片进行多次反筛选,[18F]-F0502B图像显示了小鼠和非人灵长类PD模型大脑中的α-Syn沉积。进一步通过冷冻电镜测定了α-Syn原纤维-F0502B配合物的原子结构,并通过配体间相互作用发现F0502B在原纤维表面通过强烈的非共价键网络平行对角堆叠。综上,[18F]-F0502B是一种很有前景的先导化合物,用于突触核蛋白病中聚集的α-Syn的成像。
另外,2022年3月2日,中国科学院深圳理工大学生命健康学院叶克强(前埃默里大学终身教授)及约州西奈山伊坎医学院Mone Zaidi在Nature 在线发表题为“FSH blockade improves cognition in mice with Alzheimer’s disease”的研究论文,该研究表明卵泡刺激素(Follicle-Stimulating-Hormone,FSH)直接作用于海马和皮质神经元,以加速淀粉样蛋白-β 和 Tau 的沉积,并损害表现出阿尔茨海默病特征的小鼠的认知(点击阅读)。

神经退行性疾病在大脑中显示聚集的阿尔法-突触核蛋白(α-Syn)沉积被称为突触核蛋白病,包括临床实体,如帕金森病(PD)、PD痴呆(PDD)、路易体痴呆(DLBs)和多系统萎缩(MSA)。与PD、PDD和DLB中的神经元内不溶性α-Syn包涵体相反,MSA中的α-Syn聚集主要以胶质细胞质包涵体的形式出现。α-Syn通常采用本质上无序的构象在患病的情况下,它经历了深刻的构象转变为一个富含β片的结构,聚合成病理淀粉样原纤维。错误折叠的蛋白可能作为模板促进宿主α-Syn的错误折叠。因此,α-Syn可以充当采用自我繁殖构象的朊病毒样蛋白质。
新出现的证据表明,α-Syn病理以朊病毒样的方式在整个神经系统的相互连接的网络中传播。病理性α-Syn种子聚集天然α-Syn,导致形成不溶性包涵体。这些种子既可以在神经元内繁殖,也可以在相互连接的神经元上繁殖,从而导致病理在整个大脑中扩散。值得注意的是,在同一患者中经常观察到不同疾病蛋白聚集体的共同发生。超过50%的神经病理学证实的阿尔茨海默病(AD)病例显示α-Syn聚集,而AD的共病病理,包括致密淀粉样蛋白(Aβ)斑块和神经原纤维缠结(NFTs),通常在PD、PDD和DLB大脑中发现使用Aβ和Tau示踪剂的正电子发射断层扫描(PET)成像表明,路易体(LB)疾病患者表现出一系列AD病理。实际上,α-Syn的一个片段,称为非Aβ成分(NAC),最初是在含有Aβ斑块的样品中发现的越来越多的证据支持Aβ增强α-Syn病理。
机理模式图(图源自Cell )
PD脑组织中α-Syn聚集体的密度低于AD脑组织中Aβ和Tau的密度。因此,为α-Syn开发特异性PET示踪剂更具挑战性。迄今为止,尽管在这一领域取得了进展,但尚未发现有用的α-Syn PET示踪剂。目前诊断PD的PET放射配体针对的是多巴胺能系统(突触前和突触后多巴胺活性)或囊泡单胺转运蛋白2 (VMAT2)。遗憾的是,这种成像策略无法区分PD和非典型帕金森病,后者也会导致黑质纹状体突起变性。此外,用于对症治疗的多巴胺能药物可能会改变纹状体对这些药物的摄取,从而限制了其测量疾病进展的可靠性。
该研究筛选并合成了一系列分子衍生物,并进行了体外α-Syn,Aβ和Tau纤维结合试验。通过有机合成进一步优化顶部结构骨干,然后使用体外原纤维和具有这些聚集体的原代神经元进行反筛选;结合实验用含有LBs、Aβ富集老年斑和以过度磷酸化Tau为主要成分的NFTs的脑切片进行。最后,得到了一种新型苯并噻唑-乙基苯酚衍生物(F0502B)。[18F]氟化F0502B在体外和体内特异性识别α-Syn原纤维。它选择性地标记了非人类灵长类动物大脑中的α-Syn内含物。α-Syn原纤维与F0502B复合物的冷冻电镜(cryo-EM)结构进一步提供了F0502B与α-Syn原纤维结合的原子细节,并总体上表明了小化合物如何以高亲和力和选择性结合淀粉样蛋白原纤维。因此,该研究揭示了一种有前途的先导化合物,用于α-Syn成像并促进突触核蛋白病的诊断,该研究成果填补了传统手段诊断帕金森病的空白,使得帕金森病的早期精确诊断成为可能。这可能为提高对疾病进展的理解提供一种工具,并可能在临床试验中监测治疗效果。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(23)00644-X


