暨南大学AFM:章鱼启发型仿生材料,用于糖尿病伤口的一氧化氮协同光热抗菌治疗!
时间:2024-07-04 23:01:57 热度:37.1℃ 作者:网络
细菌感染,尤其是来自耐药菌株的感染,对治疗糖尿病患者的皮肤损伤构成了重大威胁,目前的治疗方法复杂且往往效果不佳。受章鱼启发,暨南大学马栋/李国巍/郭泽雄开发了一种使用α-环糊精(α-CD)和聚乙二醇(PEG)组装的石墨氧化物端封聚轮烷(GO-PR)的仿生材料,其中α-CD模仿章鱼的灵活触手。进一步地,α-CD通过聚乙撑亚胺(PEI)阳离子化修饰,以模仿章鱼的吸盘,创建了GO-PRP,它能有效捕获并粘附细菌。重要的是,为了模拟章鱼的墨水防御机制,GO-PRP被用作一氧化氮(NO)的载体,形成了GO-PRP/NONOate。利用GO的光热转换特性,近红外光照射触发快速加热和NO释放,提供了高效的抗菌活性和生物膜分散,显著减少了I型糖尿病大鼠皮肤损伤的炎症。在伤口愈合过程中,持续释放的NO促进了血管内皮生长因子的产生和血管再生,增强了胶原蛋白的形成,并缩短了糖尿病皮肤感染的愈合时间。因此,受章鱼启发的GO-PRP/NONOate作为一种新型生物材料,在生物医学领域治疗耐药细菌感染的糖尿病伤口方面展现出潜力。该研究以题为“Octopus-Inspired Adaptive Molecular Motion for Synergistic Photothermal and Nitric Oxide Antibacterial Therapy in Diabetic Wound Repair”的论文发表在《Advanced Functional Materials》上。

该研究开发了一种受章鱼启发的新型仿生材料GO-PRP/NONOate,该材料结合了聚轮烷的动态分子运动特性和一氧化氮(NO)的抗菌特性。通过模拟章鱼释放墨汁的防御机制,利用GO-PRP的光热转换能力,在近红外光照射下迅速释放NO,实现了对细菌的有效捕获、粘附和杀灭,同时促进了糖尿病皮肤损伤中的血管再生和胶原蛋白形成,显著缩短了愈合时间。研究结果表明,GO-PRP/NONOate在治疗耐药细菌感染的糖尿病伤口方面具有显著的应用潜力,为糖尿病伤口治疗提供了一种安全有效的新策略。
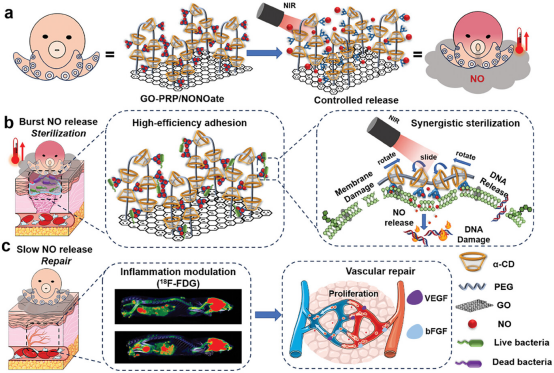
方案1. 受章鱼启发的一氧化氮输送系统的示意图,该系统具有自适应分子运动,具有协同光热抗菌活性和修复糖尿病皮肤损伤
【章鱼拟态材料GO-PRP的合成与表征】
图1通过将α-环糊精(α-CD)和聚乙二醇(PEG)组装成伪聚轮烷(PPR),并用氧化石墨烯(GO)封端形成具有柔性分子运动的聚轮烷(GO-PR)。α-CD能够在PEG链上自由旋转和滑动,模仿章鱼的可伸缩触手。此外,通过使用阳离子聚乙撑亚胺(PEI)对α-CD进行修饰,创造出能有效捕获和粘附细菌的仿生材料GO-PRP。图1通过透射电子显微镜(TEM)、原子力显微镜(AFM)图像和高度剖面图,以及傅里叶变换红外光谱(FTIR)和zeta电位分析,证明了材料的成功合成和表面特性的变化。
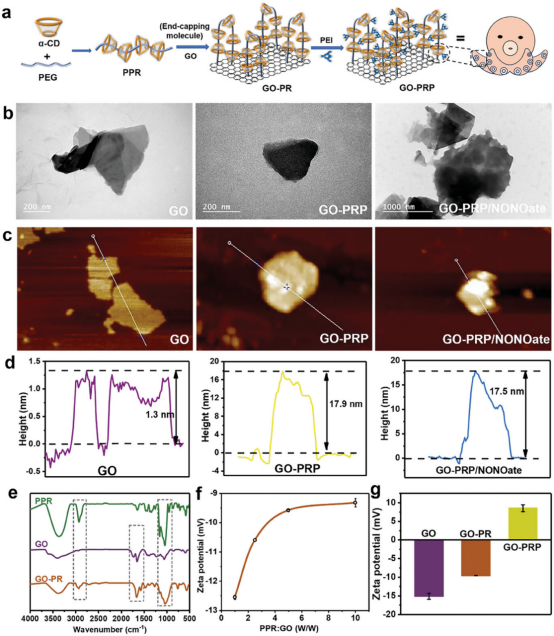
图1. 章鱼启发的仿生材料GO-PRP的制备和表征
【一氧化氮的加载和释放】
图2通过模拟章鱼释放墨汁的行为,研究者利用GO-PRP作为NO的载体,创建了能够在近红外光照射下迅速释放NO的GO-PRP/NONOate。图2中的傅里叶变换红外光谱(FTIR)证实了NONOate基团的引入,紫外-可见(UV-Vis)吸收光谱显示了GO-PRP/NONOate在252 nm处的特征吸收峰,表明NONOate基团的成功结合。通过Griess试剂检测确认了NO的释放。在模拟人体生理条件下,GO-PRP/NONOate展现出快速的NO释放能力,并且在近红外光照射下,NO的释放速率显著增加。此外,GO-PRP/NONOate的光热效应表现出依赖于浓度和激光功率的特性,且具有良好的重复性和稳定性。

图2. 光热性能和GO-PRP/NONOate的无释放
【章鱼结构GO-PRP/NONOate的抗菌功效分析】
图3通过使用共聚焦激光扫描显微镜(CLSM)观察不同材料与MRSA相互作用后细菌的荧光标记情况,结果显示GO-PRP与细菌的粘附能力显著增强,并且随着时间的推移荧光强度增加,表明GO-PRP/NONOate对MRSA有更强的粘附性。此外,通过活/死荧光染色法(Syto-9/PI)评估了不同处理对MRSA细胞膜完整性的影响,发现GO-PRP/NONOate在近红外光照射下对MRSA的杀伤效果显著优于单独的光热效应或NO释放,实现了对MRSA的高效抗菌作用。结果表明,GO-PRP/NONOate通过模拟章鱼的捕食机制,利用其柔性分子运动和阳离子化修饰的α-CD@PEI增强与细菌的粘附,结合光热效应和NO的快速释放,实现了对MRSA的协同抗菌效果。
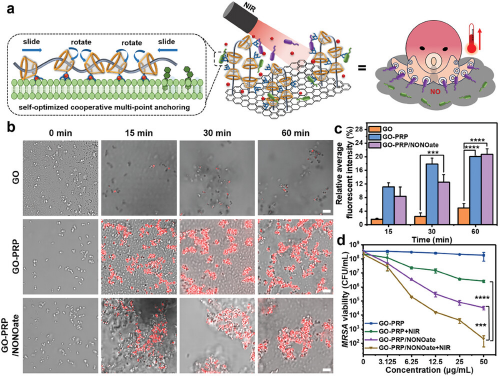
图3. 章鱼结构的GO-PRP/NONOate对MRSA的粘附和抗菌功效
【章鱼模拟GO-PRP/NONOate结构对细菌DNA和膜损伤的评价】
图4通过使用Syto-9/PI双重荧光染色法、TUNEL实验和扫描电子显微镜(SEM)观察,研究发现GO-PRP/NONOate在近红外光照射下,不仅对MRSA细胞膜造成物理损伤,导致细胞膜形态变化和通透性增加,而且还通过释放的NO产生化学损伤,引起氧化应激反应,进而破坏细菌的遗传物质DNA。结果显示,经GO-PRP/NONOate处理的MRSA细胞膜严重变形,DNA损伤程度显著,表现为更强的绿色荧光信号和细胞内容物泄漏。因此,GO-PRP/NONOate通过模拟章鱼释放墨汁的防御机制,结合光热效应和NO的氧化作用,实现了对MRSA细胞膜和DNA的双重损伤,有效促进了细菌的死亡,从而发挥了高效的抗菌效果。
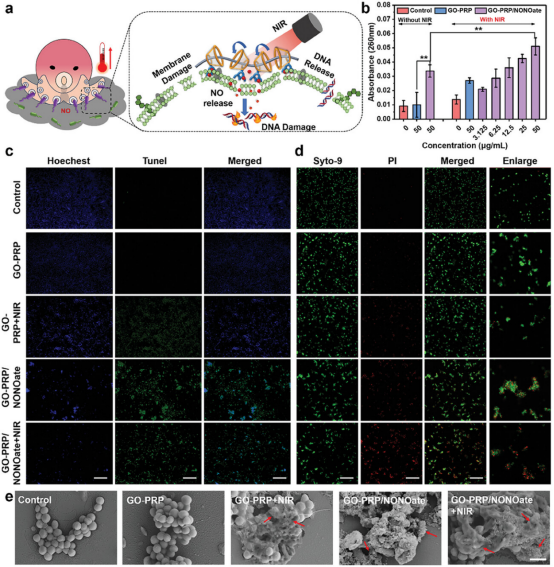
图4.章鱼模拟GO-PRP/NONOate结构的抗菌机制
【GO-PRP/NONOate中一氧化氮和光热联合机制的生物膜分散探索】
图5通过荧光标记和共聚焦显微镜观察了不同材料对生物膜的粘附情况,发现与GO相比,GO-PRP和GO-PRP/NONOate在生物膜中的粘附能力显著增强,表现出更广泛的覆盖和更深的渗透。通过晶体紫(CV)染色法和双荧光染色法评估了生物膜的分散效果,结果显示GO-PRP/NONOate在NO和光热效应的联合作用下,对成熟MRSA生物膜展现出了显著的分散效果,生物膜结构受到严重破坏,分散率达到78%。此外,通过扫描电子显微镜(SEM)观察到GO-PRP/NONOate处理后的生物膜呈现松散碎片状态,表明生物膜结构被有效瓦解。因此,GO-PRP/NONOate通过模拟章鱼的捕食机制,利用其增强的粘附能力和NO及光热效应的协同作用,有效地实现了对MRSA生物膜的分散和瓦解,展现了其在治疗与生物膜相关的感染性疾病方面的潜力。
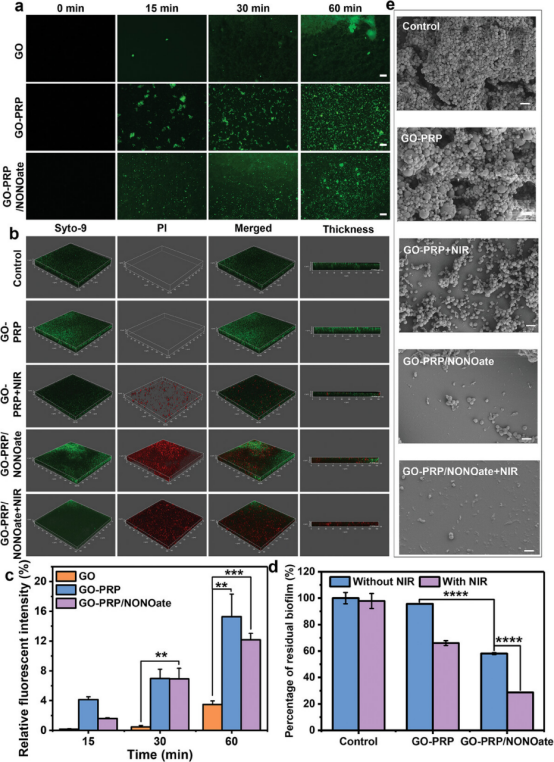
图5. 对MRSA生物膜的粘附作用
【章鱼结构GO-PRP/NONOate血管修复再生能力评价】
图6通过实验观察了GO-PRP/NONOate在近红外光照射下释放的一氧化氮(NO)对血管内皮细胞(HUVECs)和间充质干细胞(MSCs)增殖、迁移的影响,以及对血管生成因子VEGF和bFGF表达水平的上调作用。结果显示,GO-PRP/NONOate显著促进了HUVECs的增殖和迁移,并通过qRT-PCR分析确认了VEGF和bFGF mRNA水平的显著增加。此外,Matrigel血管形成实验表明GO-PRP/NONOate能显著增强HUVECs的管状结构形成能力。在I型糖尿病大鼠模型中,GO-PRP/NONOate处理的伤口区域的血流显著增加,证实了其在体内促进伤口血管化的潜力。因此,GO-PRP/NONOate通过调节NO的释放,能有效促进糖尿病伤口的血管化,加速伤口愈合过程。
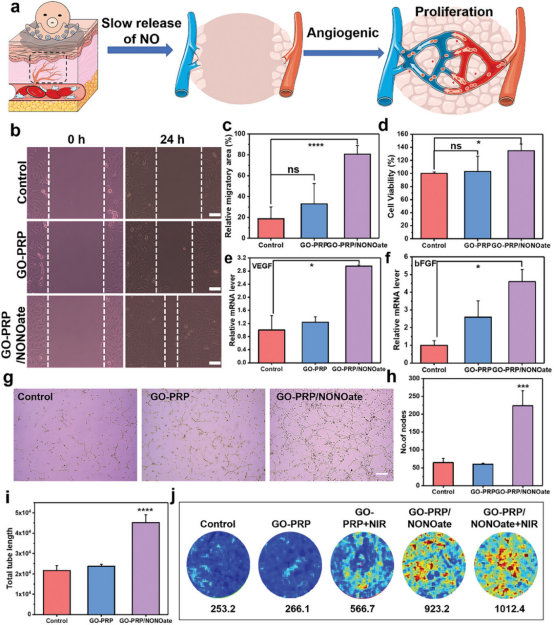
图6. GO-PRP/NONOate的促血管生成修复功能
【章鱼模拟GO-PRP/NONOate结构加速糖尿病皮肤损伤愈合】
图7展示了在I型糖尿病大鼠模型中,应用模仿章鱼结构的GO-PRP/NONOate治疗感染性糖尿病皮肤损伤(DSI)的体内疗效。实验通过连续13天的治疗观察了不同处理组(包括对照组、GO-PRP、GO-PRP+NIR、GO-PRP/NONOate和GO-PRP/NONOate+NIR)大鼠伤口愈合的进程、伤口血管化程度和炎症控制情况。结果显示,与对照组相比,GO-PRP/NONOate和GO-PRP/NONOate+NIR组的伤口愈合速度更快,特别是在NIR照射下,GO-PRP/NONOate组的治疗效果更为显著,伤口面积显著减小,表明了NO和光热效应的协同作用在促进伤口愈合方面的优势。此外,通过组织学染色分析,GO-PRP/NONOate+NIR处理的伤口显示出更完整的新生角质层、有序的结缔组织、新形成的肉芽组织和成纤维细胞,而其他材料处理的伤口仍存在炎症细胞。
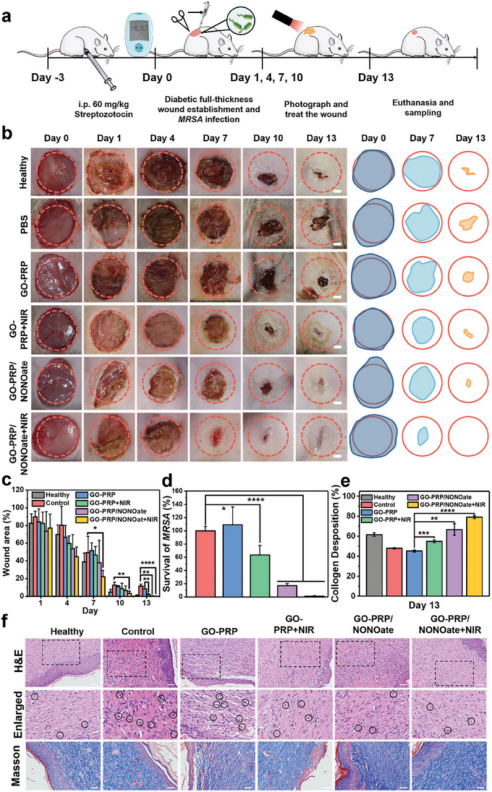
图7. 使用 DSI 大鼠的细菌感染模型中的体内治疗效果
【章鱼结构模拟GO-PRP/NONOate的炎症调节和血运重建促进】
图8通过免疫组化和免疫荧光染色分析了不同材料处理后伤口组织中VEGF、CD163、CD31和α-SMA的表达情况。结果显示,与模型组和GO-PRP组相比,NO和近红外光(NIR)联合治疗显著提高了伤口中VEGF、CD163和CD31的表达,增加了血管密度,表明了其在改善伤口血管化方面的积极作用。特别是在治疗的第7天和第13天,NO+NIR处理组的CD31和α-SMA表达水平高于对照组,指示伤口正在经历炎症调节和修复过程。此外,使用18F-FDG进行的正电子发射断层扫描(PET)成像显示,与对照组相比,NO+NIR处理的大鼠显著减少了FDG的摄取,表明炎症信号减弱。因此,GO-PRP/NONOate通过模拟章鱼的防御机制,结合NO的释放和光热效应,不仅能有效控制感染和减轻炎症,还能促进伤口的血管再生和组织修复,为糖尿病皮肤损伤的治疗提供了一种新的策略。
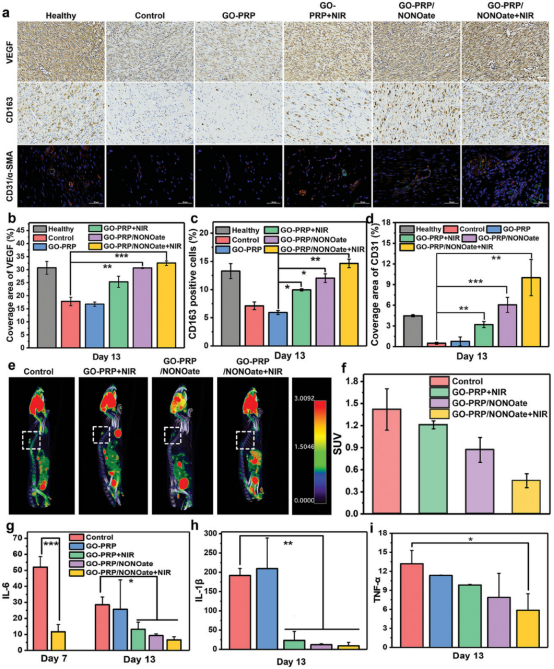
图8. 伤口修复的生物学机制研究
【章鱼结构GO-PRP/NONOate的生物安全评估】
图9通过使用NIH 3T3细胞和HACAT细胞测试了不同浓度下GO-PRP/NONOate在近红外光照射后的细胞活性,结果表明即使在最高浓度下,细胞活性仍保持在85%以上,显示出良好的细胞相容性。此外,通过体外溶血实验评估了GO-PRP/NONOate与红细胞相互作用后的溶血率,所有浓度和时间点下的溶血率均低于5%,证实了其优秀的血液相容性。在小鼠实验中,对心脏、肝脏、脾脏、肺和肾脏等主要器官进行了H&E染色分析,以评估材料对器官的潜在毒性,结果显示与健康组相比,经材料处理的小鼠器官没有观察到明显的损伤或毒性,表明了良好的体内安全性。在治疗过程中,尽管小鼠体重有所下降,但血糖水平保持稳定,整体生理状况良好。
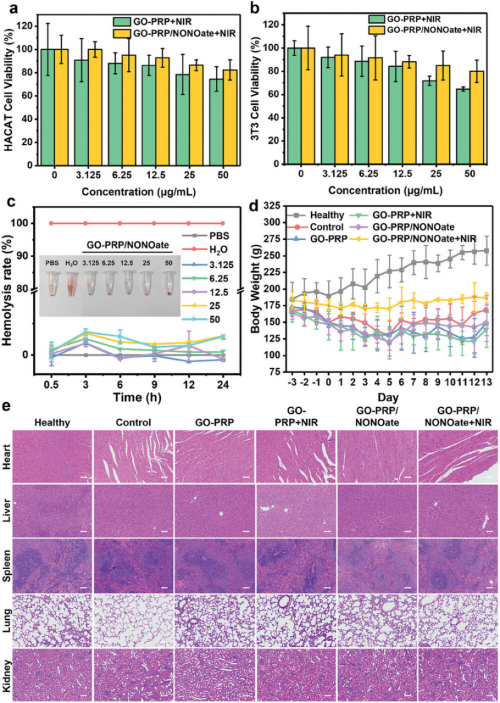
图9. 章鱼启发的仿生材料GO-PRP / NONOate的生物相容性
【小结】
该研究通过模仿章鱼捕食的方式,开发了一种新型的仿生材料GO-PRP/NONOate,该材料利用聚轮烷链的柔性分子运动和阳离子环糊精模仿章鱼的触手和吸盘,实现对细菌的高效捕获和粘附。同时,利用GO-PRP的光热转换特性作为一氧化氮(NO)的载体,通过近红外光触发快速加热和NO的释放,实现了对细菌的有效杀伤和生物膜的分散,显著减少了I型糖尿病大鼠皮肤损伤的炎症反应。在伤口愈合过程中,持续释放的NO促进了血管内皮生长因子的产生和血管再生,增强了胶原蛋白的形成,缩短了糖尿病皮肤感染的愈合时间。因此,这种受章鱼启发的GO-PRP/NONOate作为一种新型生物材料,在治疗糖尿病伤口中的耐药细菌感染方面展现出了潜力,为临床治疗和广泛应用提供了坚实的理论基础。
原文链接:
https://doi.org/10.1002/adfm.202402591


