糖尿病患者痛苦难忍的并发症:糖尿病周围神经痛
时间:2024-07-04 23:01:56 热度:37.1℃ 作者:网络
随着生活水平的提高,糖尿病患者数量逐渐增加。对于糖尿病患者而言,由于血糖长期对外周神经元的“甜蜜宠爱”,神经末梢出现异常,导致神经病变。
随着疾病的进展,这些神经病变逐渐发展为『糖尿病性周围神经病理性疼痛』(diabetic peripheral neuropathic pain,DPNP),一些糖尿病患者甚至连穿衣服都痛不堪言!
DPNP的发病率并不低,据统计,2021年全球约有5.37亿人患有糖尿病,我国糖尿病患病率已上升至12.8%,糖尿病确诊后10年内,患者常有明显的临床神经病变,60%~90%的患者有不同程度的神经病变。
在糖尿病神经病变中,『糖尿病周围神经病变』(diabetic peripheral neuropathy, DPN)是糖尿病最常见的慢性并发症,占50%。其中50%的DPN患者会发生疼痛,即DPNP。
一、分类
DPNP并不是单一的疾病,是一种复杂且多样化的病理状态,包含多种类型的综合症,包括远端对称性多发性神经病、自主神经病变、糖尿病性根神经丛病、单神经病变及治疗相关的神经病变。其中DSPN是最常见的一种类型,占所有糖尿病性神经病变的75%以上。
二、危险因素
PDPN可以发生在1型和2型糖尿病患者中,但2型糖尿病患者的患病率更高,且多项研究表明,男性糖尿病患者更易患PDPN,性别差异可能与激素水平、生活习惯以及代谢因素有关。
年龄是PDPN的重要危险因素。老年糖尿病患者中,PDPN的患病率显著增加。此外,糖尿病病程越长,发生PDPN的风险越高。经济发达地区的糖尿病患者对疾病管理的意识和资源更为丰富,患病率可能较低;而经济欠发达地区由于医疗资源匮乏,糖尿病管理不善,PDPN患病率较高。
高血压、血脂异常、肥胖和吸烟等是PDPN的常见合并症。这些合并症会增加PDPN的患病风险和严重程度。控制这些危险因素对预防和管理PDPN具有重要意义。
三、发病机制
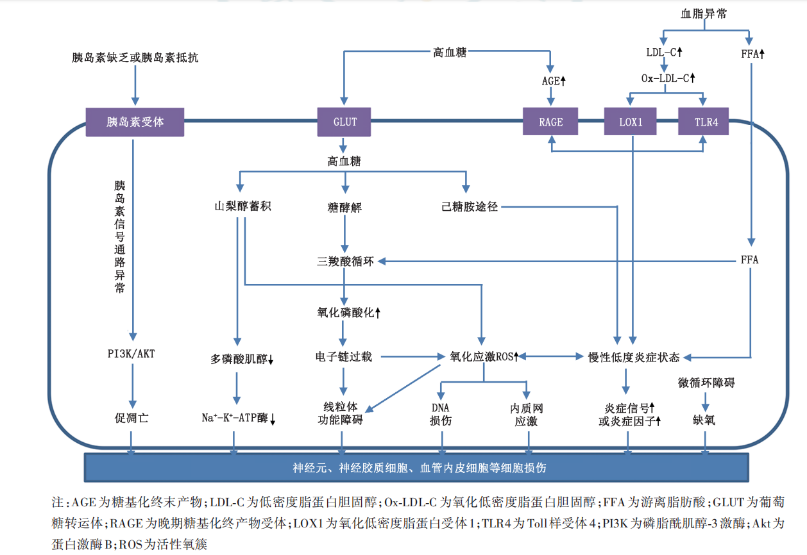
01 高血糖及代谢途径
-
多元醇途径(Polyol Pathway):高血糖状态下,葡萄糖被还原酶转化为山梨醇,积累在神经细胞内,导致渗透压改变和细胞损伤。
-
己糖胺途径(Hexosamine Pathway):高血糖导致葡萄糖进入己糖胺途径,产生的中间产物对蛋白质和脂质的修饰影响细胞功能。
-
晚期糖基化终末产物(AGEs)途径:AGEs通过与其受体(RAGE)结合,激活细胞内信号传导通路,引发氧化应激和炎症反应,导致神经损伤。
02 氧化应激
-
高血糖引起的氧化应激是糖尿病并发症的关键机制之一。氧化应激导致DNA损伤、蛋白质修饰及脂质过氧化,进而损害神经细胞。
03 血管因素
-
微血管病变:高血糖引起的血管内皮细胞损伤和微血管基底膜增厚,导致神经组织缺血和缺氧,从而引发神经损伤。
-
内皮功能障碍:糖尿病患者的血管内皮功能受损,影响血流量,导致神经供血不足。
04 炎症和免疫反应
-
高血糖和脂代谢紊乱可以激活免疫系统,导致慢性炎症反应。炎症介质如细胞因子和趋化因子增加,加剧神经损伤。
05 胰岛素信号通路异常
-
胰岛素抵抗和胰岛素信号通路的异常会影响神经营养因子的表达和作用,抑制神经轴突生长,促进细胞凋亡。
06 神经元超兴奋性
-
在高糖环境下,外周神经伤害感受器的离子通道(如钠通道、钾通道等)表达改变,导致神经元超兴奋性。神经元超兴奋性使得刺激反应过度和异位神经元活动增加,导致疼痛信号传导异常。
07 神经胶质细胞激活
-
高糖环境下,脊髓小胶质细胞的激活会促进脊髓层面神经元超兴奋性,加剧疼痛信号的传导。
四、临床表现
DPN的临床表现多种多样,主要分为感觉症状和运动症状。感觉症状包括感觉减退(如麻木)、感觉异常(如刺痛感、蚁走感)和疼痛(如电击样痛、烧灼痛)。运动症状包括肌肉无力和协调性障碍,严重时可导致行走困难和跌倒。主要包括以下:
01 感觉异常
-
负性症状:包括感觉减退或丧失,如麻木、针刺感、温度觉减退等,所谓的袜套样、手套样感觉。感觉减退或丧失是由于大纤维(Aβ纤维)受损。
-
正性症状:包括异常感觉,如烧灼感、电击样疼痛、过敏性疼痛等,这些症状在夜间更为明显。这种类型的疼痛通常与小纤维(C纤维和Aδ纤维)的损伤有关。
这些纤维负责传递温度和疼痛刺激。高血糖环境下,小纤维的离子通道(如钠通道)表达异常,导致神经元超兴奋性,引发烧灼感、电击样疼痛。

02 运动功能障碍
-
随着病情的发展,患者可能出现运动功能障碍,如肌无力、肌萎缩、步态不稳等。这些症状主要由大纤维(Aα纤维)的损伤引起。这些纤维负责传递运动命令。高血糖导致的神经营养因子表达和作用异常,以及血管病变导致的神经供血不足,都会影响运动纤维的功能,导致肌无力和肌萎缩。
03 自主神经功能障碍
-
心血管系统:自主神经病变可导致心动过速、直立性低血压和晕厥,这主要与自主神经系统(ANS)的损伤有关。高血糖和脂代谢紊乱激活炎症反应,损伤自主神经纤维。
-
胃肠道:如胃轻瘫、便秘和腹泻,这与支配消化系统的自主神经纤维受损有关。
-
泌尿生殖系统:尿潴留、尿失禁和性功能障碍,这些症状与支配泌尿生殖系统的自主神经纤维受损有关。
04 临床变现分布
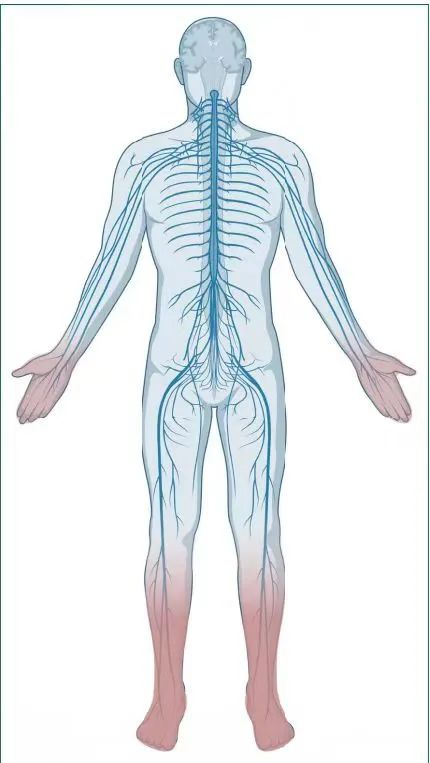
图2:DPNP疼痛图,红色部分为疼痛好发部位,颜色越深,发病率越高。
DPNP症状以对称性肢体远端疼痛为主要特征,下肢重于上肢,远端重于近端(见图2),夜间痛甚。这可能是因为长轴神经纤维的易感性,下肢的神经纤维距离心脏较远,供血路径长,因此更容易受到微血管病变的影响,导致缺血和缺氧,进而引发神经损伤。
且在高糖环境下,神经元的离子通道(如钠通道和钾通道)表达发生改变,导致神经元的超兴奋性。远端小纤维(C纤维和Aδ纤维)对这些变化尤为敏感,超兴奋性导致自发性动作电位的产生,进而引发烧灼感和疼痛。
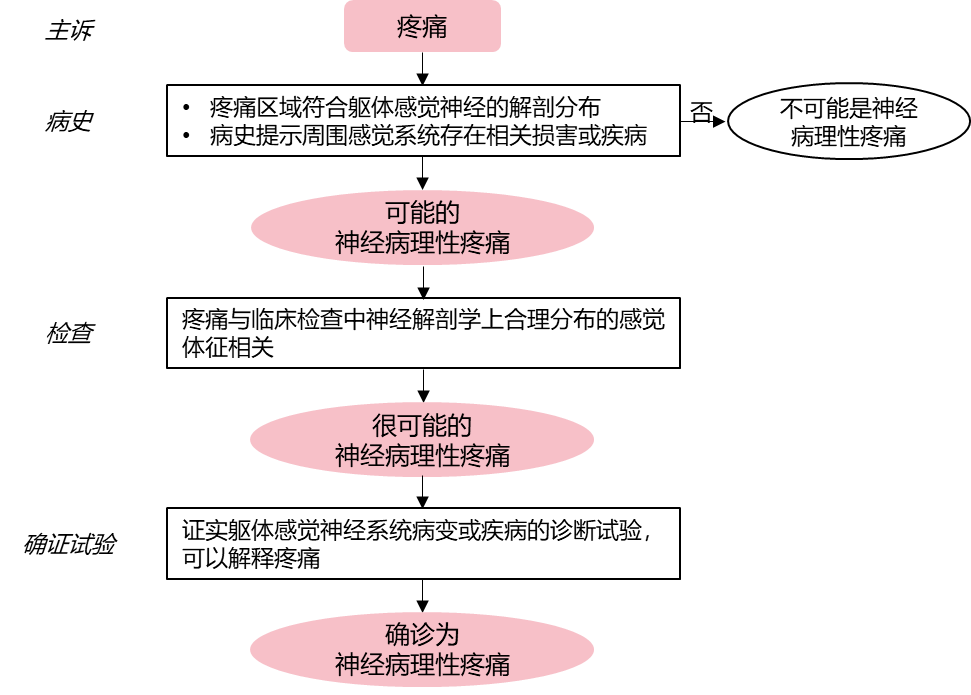
五、诊断
该疾病为排他性诊断,目前尚无“金标准”,临床诊断标准如下:有糖尿病病史且具备PDPN的典型症状和体征,至少一项检查(踝反射、振动觉、压力觉、温度觉、针刺痛觉)异常者可诊断为PDPN。
若无典型症状,但有两项以上神经受损体征异常者也可诊断为PDPN。注意需排除其他病因:如维生素B12缺乏、毒性药物、颈腰椎病变、慢性炎症性脱髓鞘性神经病变、遗传性神经病变等。
01 辅助检查
-
临床检查
a)感觉检查:包括触觉、痛觉、温度觉、震动觉和位置觉的评估。
b)运动功能检查:评估肌力、关节活动度及深部肌腱反射。
c)自主神经功能检查:评估心率变异性、血压变化和出汗功能。
-
电生理检查
a)神经传导速度(NCV):评估大纤维功能。
b)定量感觉测试(QST):评估小纤维功能。
-
组织活检
a)皮肤活检:评估小纤维神经密度。
六、鉴别诊断
DPN的症状与其他类型的周围神经病变类似,因此在诊断时需要进行鉴别。
01 非糖尿病性周围神经病变
-
酒精性神经病变:长期大量饮酒导致的神经病变。患者可能有明显的饮酒史,戒酒后症状有改善趋势。
-
药物性神经病变:某些药物,如化疗药物、抗结核药物等,可能引起周围神经病变。了解患者的药物使用史有助于鉴别。
-
毒性神经病变:接触重金属(如铅、砷、汞)或有机溶剂(如二氯乙烷)可导致神经病变。需详细询问职业暴露史和接触史。
-
红斑肢痛症:红斑肢痛症表现为四肢末端(尤其是足部和手部)的烧灼痛、红肿和温度升高。疼痛常在温暖环境或运动后加重,冷敷和抬高患肢可缓解症状。PDPN主要表现为持续性、对称性的远端肢体疼痛,而红斑肢痛症则为阵发性发作,多在温暖环境或运动后加重。
-
带状疱疹后神经痛(PHN):PHN患者通常有明确的带状疱疹病史,而PDPN患者无此病史。PHN的疼痛局限于带状疱疹皮疹的分布区域,而PDPN的疼痛多为对称性的远端肢体疼痛。
02 维生素缺乏性神经病变
-
维生素B12缺乏:常见于素食者、慢性萎缩性胃炎患者和某些吸收不良综合征患者。维生素B12水平检测和甲基丙二酸(MMA)检测有助于诊断。
-
维生素B1缺乏:多见于营养不良、长期饮酒者。补充维生素B1后症状可改善。
03 遗传性神经病变
-
查尔科-马里-图斯病(Charcot-Marie-Tooth Disease, CMT):一种常见的遗传性周围神经病,通常在青少年或成年早期发病,表现为对称性远端肌肉萎缩和无力。家族史和基因检测有助于诊断。
04 自身免疫性神经病变
-
格林-巴利综合征(Guillain-Barré Syndrome, GBS):急性或亚急性起病,通常在感染或疫苗接种后发病,表现为对称性无力和感觉障碍。脑脊液检查和神经电生理检查有助于诊断。
-
慢性炎性脱髓鞘性多发性神经病(CIDP):慢性进展性疾病,表现为对称性无力和感觉障碍。神经电生理检查和免疫治疗反应有助于鉴别。
05 中枢神经系统病变
-
脊髓病变:如颈椎病、椎管狭窄、脊髓肿瘤等,可能引起下肢无力和感觉异常。MRI检查有助于鉴别。
-
多发性硬化(Multiple Sclerosis, MS):自身免疫性中枢神经系统疾病,表现为多灶性神经功能缺失。MRI和脑脊液检查有助于诊断。
06 其他系统性疾病
-
甲状腺功能减退:可能引起多发性周围神经病变。甲状腺功能检查有助于诊断。
-
肝肾功能不全:肝硬化或慢性肾病患者可能出现周围神经病变。肝肾功能检测和相关影像学检查有助于鉴别。
七、治疗
01 药物治疗
-
止痛药:如阿片类药物、抗抑郁药(如杜洛西汀、阿米替林)、抗惊厥药(如普瑞巴林、加巴喷丁)。
-
抗糖尿病药物:控制血糖,减缓神经损伤进展。
02 非药物治疗
-
物理治疗:包括电刺激、理疗和康复训练。
-
心理治疗:缓解疼痛相关的焦虑和抑郁。
八、结论
痛性糖尿病性周围神经病变是一种常见且复杂的糖尿病并发症。早期识别和治疗对于改善患者生活质量至关重要。综合应用药物和非药物疗法,并加强血糖控制和生活方式干预,是目前最有效的治疗策略。
参考文献
1.Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: clinical manifestations and current treatments. Lancet Neurol 2012;11:521–34.
2.Pop-Busui R, Boulton AJ, Feldman EL, et al. Diabetic neuropathy: A position statement by the American Diabetes Association. Diabetes Care 2017;40:136–54.
3.Jensen TS, Karlsson P, Gylfadottir SS, et al. Painful and non-painful diabetic neuropathy, diagnostic challenges and implications for future management. Brain J Neurol 2021;144:1632–45.
4.Scholz J, Finnerup NB, Attal N, et al. The IASP classification of chronic pain for ICD-11: chronic neuropathic pain. Pain 2019;160(1):53–9.


