ICU中β-内酰胺抗生素剂量优化:目标、治疗药物监测(TDM)、毒性
时间:2023-07-04 13:05:08 热度:37.1℃ 作者:网络
摘要
β-内酰胺是一类治疗感染的重要抗生素,并广泛用于危重患者。因为脓毒症会导致严重的并发症,所以在重症监护病房(ICU)中正确使用这些药物非常重要。
尽管关于最佳β-内酰胺的暴露目标仍有争议,但可以通过从临床前和临床研究中得出的β-内酰胺活性基本原则选择最佳暴露目标。
在ICU中达到暴露目标,需要克服药代动力学(PK)和药效学(PD)带来的巨大挑战。
对于β-内酰胺药物,使用治疗药物监测(TDM)来确认是否达到所需的目标具有很大的潜力,但需要更多的数据来确定是否可因此改善感染相关的临床结局。
此外,在超过治疗剂量的抗生素暴露与药物不良反应之间存在相关性时,β-内酰胺的TDM可能是有用的。理想的β-内酰胺TDM应努力做到有效采样并及时报告高危患者的检测结果。
关于β-内酰胺PK/PD目标与患者最佳临床结局的共识目前尚不清楚,应该是未来研究的重点。
1,介绍
1.1 β-内酰胺的杀菌特性
β-内酰胺类抗生素包括青霉素类、头孢菌素类和碳青霉烯类。这些抗生素对多种革兰氏阳性、革兰氏阴性和厌氧菌都有效。对于β -内酰胺类抗生素,细菌杀灭与药物浓度超过病原菌在感染部位的最低抑制浓度(MIC)的时间长度有关。
当药物浓度比MIC高2至5倍时疗效达到最大,这一理论在70多年前的临床前研究数据中首次被描述。
1947年,Harry Eagle博士指出,一旦青霉素浓度达到化脓性链球菌的最低抑菌浓度的10倍以上,治疗效果就会趋于稳定,他写道:“感染中心较高水平的青霉素存在药物,较低水平的青霉素几乎没有治疗效果”。
同样,在使用金黄色葡萄球菌菌株的实验中,将药物浓度增加到MIC的10倍以上也没有发现额外的益处。
这些早期实验中,在暴露于青霉素和头孢菌素的革兰氏阳性菌中发现了抗生素后效应,但在革兰氏阴性菌中没有发现。耐药细菌的再生和β -内酰胺类抗生素的亚治疗暴露有关;
对于暴露于头孢吡肟、头孢他啶和美罗培南的克雷伯菌,当谷浓度高于最低剂量1 ~ 4倍时可预防耐药。
许多确定β-内酰胺类药效学(PD)目标的临床前研究(在临床用于人体前,对动物进行的模拟体内实验)都是在中性粒细胞减少的大腿感染的小鼠模型中进行的。
使用中性粒细胞减少模型是因为去除动物的免疫系统可以准确地找出细菌效能与抗生素暴露的关联。然而,这可能导致PD的目标高于免疫功能正常的宿主所需。
动物模型可以定义抑菌、1-log10、2-log10或3-log10单位细菌杀灭的PK/PD指数。针对特定病原体、感染部位或感染过程中的时间节点(如:序贯口服药物的节点)的适当靶点尚未确定。
1.2.目前关于危重患者β -内酰胺类药物PK/PD目标的争论。
公认的β -内酰胺类抗生素PK/PD指数是指血浆游离药物浓度高于MIC的时间百分比(% T > MIC)(即“时间依赖”)。然而,在重症患者中实现临床治愈和微生物根除的最佳β -内酰胺PK/PD目标仍未确定,包括不同输注时间。
一些研究指出,在整个治疗周期内,β -内酰胺类抗生素游离血药浓度维持在MIC 4至6倍 (100%T> 4–6 × MIC) 以上能够确保临床治疗有效以及抑制β-内酰胺耐药。
其他临床前数据表明,只有在一定比例的给药间隔内血药浓度高于MIC才能获得最大的杀菌效果。
根据这一理论,对于间歇性给药,我们主张整个给药间隔的β-内酰胺x血药浓度高于MIC的暴露目标(100%T > MIC),以确保达到40%至70% T > 4 × MIC。
然而,100%的T> MIC是否能确保40%至70%的T> 4 × MIC受到质疑。一项利用现有患者数据模拟首次剂量暴露的研究表明,当剂量达到100%T> MIC目标时,只有少数危重患者(分别使用哌拉西林、头孢他啶和头孢吡肟)能达到40-70%的T> 4 × MIC。
建议在整个给药间隔内采用高于MIC 4倍的游离血浆浓度(100%T > 4 × MIC)作为间歇输注的替代暴露目标,而在连续输注时,稳态浓度至少为高于MIC 4倍(ƒCss≥4 × MIC),以确保最大限度地杀死细菌,防止细菌再生,并确保阳性临床结果。
现实情况是,达到这些浓度(如:治疗假单胞菌感染时头孢吡肟的游离谷浓度超过32mg /L)是有问题的,且有发生药物毒性的风险。
每种药物制定单一的PK/PD目标可能是不现实的,事实上,针对特定的患者、病原体、感染和给药因素,可能需要制定一系列的目标。
1.3. 危重患者面临的挑战
1.3.1 危重患者药代动力学(PK)的改变
危重患者生理指标的改变可使药物PK变得复杂。内皮损伤、大量液体复苏、血管升压药物的使用、血浆白蛋白浓度降低(如低蛋白血症)以及肾功能改变导致的药物清除率的变化都会对β -内酰胺等亲水性抗生素产生影响。
危重患者亚治疗性药物暴露的一个主要危险因素与肾清除率增加有关(通常定义为肌酐清除率(CrCl)超过130 mL/min/1.73 m2)。
这些PK的改变的结果是药物浓度在患者人群之间、患者体内的显著差异,在这些人群中实现充分的药物暴露是至关重要的。
1.3.3. β -内酰胺剂量优化的必要性
脓毒症和脓毒症休克的死亡率仍然很高。对2009年至2019年在北美、欧洲和澳大利亚发表的文章进行的系统回顾显示,脓毒症休克患者的30天死亡率为34.7%,脓毒症死亡率为24.4%。
鉴于脓毒症和脓毒性休克相关的不良临床结果,以及危重患者PK的高度变异性,应考虑个体化给药方法并进行治疗性药物监测(TDM)。
2. β -内酰胺TDM在ICU有效性的证据综述
ICU的观察性研究发现,许多患者需要调整剂量以达到T> MIC或T > 4 × MIC,但未能达到预定的PK/PD目标并不总是和不良临床结果相关。
尽管这些研究结果存在差异,但临床观察性研究为TDM的实施提供了有用的信息。最有可能从TDM中受益的患者群体是那些肾脏清除率增加或肾脏损害或APACHE II评分评分在9至22分之间的患者。
使用实际MIC可能比临床断点MIC更可取,因为实际MIC可能远低于断点MIC或流行病学临界值(ECOFFs)。另一种方法是使用MIC值加上两次稀释,以避免机构之间的程序差异、生物差异和测试不准确性。
与其他抗生素相比,某些β -内酰胺类抗生素更需要做TDM。比如与美罗培南相比,亚胺培南、哌拉西林、头孢他啶和头孢吡肟的目标达成率较低。
正如在Merino试验的事后分析中所见,菌株的哌拉西林-他唑巴坦MIC比美罗培南更接近断点,所以使用哌拉西林更需要做TDM。
有许多随机对照试验(RCT)试图评价ICU内β -内酰胺药物行TDM的价值。De Waele等人于2011 - 2012年在比利时进行了一项前瞻性、部分盲法随机对照试验。
患者被随机分配到常规治疗组或干预组,干预组每日采用TDM调整药物剂量。哌拉西林和美罗培南延长输注超过3小时。
在治疗开始后的第一个72小时,PK/PD目标为100% T > 4 × MIC或100% T > MIC。有41名患者入组,与对照组相比,干预组在第3天达到PK/PD目标的患者明显更多,但临床失败、细菌持续存在、SOFA评分变化或住院28天死亡率等预后指标组间无统计学差异。
随后,Fournier等人发表了2013年至2016年进行的随机对照试验结果,其中包括38名来自烧伤ICU的患者。患者被随机分配到标准治疗组、干预组,在干预组中进行实时TDM 确保达到100% T > MIC的目标(来自实际生物体或根据欧洲抗微生物药敏试验委员会[EUCAST]数据库使用MIC90)。
干预组在目标范围内的谷浓度显著更高,虽然没有感染相关结果获益,但实时TDM使PK/PD的达标率增加了一倍以上。但两组的临床有效率都很高(干预组为92%,对照组为97%),所鉴定病原体的MIC也较低(哌拉西林平均MIC为2mg /L,美罗培南平均MIC为0.125 mg/L)。
最近,TARGET试验于2017年至2019年在严重脓毒症和脓毒性休克患者中进行。在入组并给予输注负荷剂量哌拉西林-他唑巴坦后,患者开始接受持续输注,并随机分为TDM(干预)组或非TDM(对照)组。
目标是100% T > 4 × MIC(如果经验性的治疗,MIC是根据铜绿假单胞菌的EUCAST流行病学临界值[ECOFF]假设的)。主要结局采用每日SOFA评分进行评估。
试验共纳入249例患者(对照组124例,TDM组125例)。结果显示,TDM改善了PK/PD的目达标率(尽管仍然很低,分别为37%和15%),但在SOFA评分、死亡率、临床或微生物治愈率方面没有明显的收益。
尽管达标率有所改善,但哌拉西林中位浓度并没有差异。死亡率与哌拉西林浓度有关,哌拉西林浓度超过96 mg/L的患者死亡率最高,28天死亡率比哌拉西林浓度在32 - 64 mg/L之间的患者高4倍以上(优势比4.21,95% CI 1.4-12.5;p = 0.01)。
这有可能反映了患者存在严重脓毒症和肾脏损害的情况。DOLPHIN试验于2018年至2021年在荷兰的8个医疗机构进行,涉及388名服用β -内酰胺类抗生素或环丙沙星的患者。
使用TDM和给药软件,将患者随机分为标准给药组和干预给药组。β -内酰胺类抗生素的药效学目标为100% T > MIC,药物谷浓度上限大于MIC的10倍(100% T > 10 × MIC)。
通过使用EUCAST ECOFF断点确定可能病原体的MIC值。作为DOLPHIN试验主要结果的ICU住院时间在两组间是相似的。
不幸的是,在DOLPHIN试验中,标准剂量组和TDM组之间的目标达成率没有统计学差异,因此很难衡量不同药物暴露与试验结果差异之间的相关性。
到目前为止,没有一项随机对照试验显示与TDM相关的患者预后差异,然而,达标率未能提高、使用替代MIC代替实际MIC、纳入标准宽泛、患者人数少以及TDM的延迟是未来随机对照试验需要解决的问题。
3、过度暴露和β-内酰胺相关毒性的证据
虽然β-内酰胺在很大程度上被认为是一类治疗指数很高的抗生素,但仍有一些与其暴露相关的药物副反应,包括血细胞减少、神经毒性、肝毒性和肾毒性。
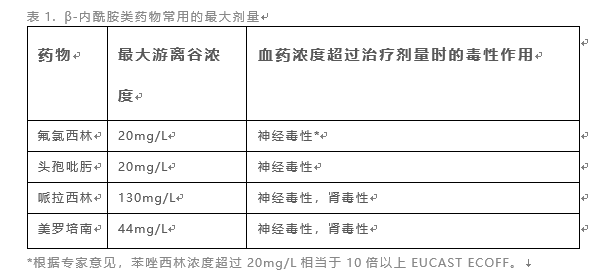
有证据表明,一些常用的β-内酰胺抗生素存在毒性阈值(表1)。一些特殊反应与药物暴露无关,因此,在这方面TDM是无效的。当药物剂量可能超出治疗浓度(如:肾功能损害时)且可能产生毒性时,明确药物暴露-毒性关系有助于指导TDM开展。
支持药物暴露-毒性关系的证据仅限于回顾性队列研究,并受到一些影响因素的混淆,包括药物本身与不良反应的因果关系。
3.1 血细胞减少
青霉素G的剂量和治疗持续时间与神经毒性相关,尤其是免疫或细胞直接毒性,尽管尚未明确相关机制。持续2周以上的大剂量用药(>12g/天)以及中性粒细胞基础水平低与中性粒细胞减少这一不良反应相关。
青霉素G还可能诱发溶血性贫血,尽管在8MU(4.8g)/d的标准剂量治疗中有所报道,但通常认为这与超大剂量用药(>20MU[12g]/d)相关。尽管药物浓度的毒性阈值尚未确定,但剂量与中性粒细胞减少的相关性提示可能存在药物暴露-毒性关系。
治疗持续时间也是青霉素类药物导致中性粒细胞减少的危险因素。对于这一现象的一种解释是β-内酰胺的降解产物导致了血细胞减少,这些降解产物随用药时间延长而不断积累。
目前,TDM对预测β-内酰胺抗生素相关的中性粒细胞减少无效,建议对长时间(>14天)、大剂量用药以及中性粒细胞基础水平低的患者监测全血细胞计数。
3.2 神经毒性
青霉素的神经毒性可能与其对γ-氨基丁酸(GABA)受体的抑制作用相关。能够预测神经毒性的指标是脑组织间质液的药物浓度,而非脑脊液药物浓度。
一项ICU中氯唑西林和苯唑西林剂量的回顾性研究发现,有18%的患者在用药后出现了神经毒性(谵忘和持续性昏迷),这部分患者的药物谷浓度为97-302mg/L,显著高于20-50mg/L的有效治疗谷浓度。
ICU与普通病房患者的混合队列研究表明,氟氯西林谷浓度125.1mg/L会使神经毒性风险增加50%。
一项前瞻性队列研究(危重患者占48%)发现,氟氯西林浓度高于10倍MIC与神经毒性相关,其平均浓度增加1mg/L的比值比(OR)为1.12(p=0.02)。
Beumier等在一项涉及199名ICU患者的回顾性研究中发现,哌拉西林中位浓度超过64mg/L时神经毒性风险增加。
另一项涉及53名接受持续注射哌拉西林/他唑巴坦治疗(12g/24h)的ICU患者的回顾性研究表明,与未发生神经毒性的患者相比,发生神经毒性的患者具有更高的肾功能损害比例,哌拉西林的稳态浓度也更高(156.9mg/L vs. 91.3mg/L,p=0.0016)。
受试者工作特征曲线(ROC)分析得出,稳态浓度>157.2mg/L可以作为神经毒性的预测标准。
Imani等发现,发生神经毒性的患者哌拉西林谷浓度更高(150mg/L vs. 75mg/L,p<0.01)。逻辑回归分析证实,当哌拉西林总血药浓度超过361.4mg/L时,发生神经毒性的风险高达50%。以往的研究结果表明,危重患者应用头孢吡肟可能与神经毒性有潜在相关性。
由于神经毒性的定义、研究针对的人群以及统计学方法的差异,导致目前仍无法准确得出头孢吡肟产生神经毒性的浓度阈值。总的来说,当头孢吡肟浓度超过20-30mg/L时会增加毒性风险。
在持续输注时,稳态浓度超过35mg/L或60mg/L与神经毒性相关。在持续输注头孢唑啉治疗骨髓炎时,总血药浓度低于100mg/L不会产生毒性,仅有 一名患者在血药浓度达到127mg/L时出现意识模糊。肾功能损害患者接受大剂量头孢唑啉治疗时可能诱发惊厥。
Barretto等表示,尽管尚未明确头孢唑啉药物浓度与神经毒性的相关性,但其化学结构显示在R1位存在一个与戊氮唑(有明确的神经毒性)相同的四唑基团。因此,尽管头孢唑啉尚无明确的TDM策略,但对应用头孢唑啉治疗的患者仍应监测神经毒性。
有报道表明,美罗培南中位谷浓度超过16mg/L时神经毒性发生率增加。同样,Imani等检验了美罗培南暴露的神经毒性作用,研究发现出现神经毒性者均有较高的中位谷浓度,当美罗培南谷浓度超过64.2mg/L时,产生神经毒性的几率大约为50%。
肝硬化患者的哌拉西林和美罗培南血药浓度显著升高,神经系统预后更差。
3.3 肝毒性
阿莫西林/克拉维酸常导致药物相关肝损伤。这种不良反应可能与HLA-DRB1*15等位基因相关的遗传易感性有关,并可能受到HLA-DRB1*07等位基因家族的保护。氟氯西林也存在肝毒性,通常认为这与HLA-B*57:01等位基因相关的特殊免疫不良反应有关。
瑞典药物不良反应咨询委员会的报道表明,当氟氯西林剂量高于1.5g/天时会产生肝毒性。与之相反,有很多研究表明β-内酰胺的血药浓度与肝毒性无关。目前,β-内酰胺浓度与肝毒性的相关性尚不明确,针对此开展TDM也无法确定患者是否能够获益。
3.4 肾毒性
青霉素类抗生素很少引起肾毒性,一般来说这类药物的肾毒性与剂量无关,而是与过敏导致的急性间质性肾炎有关。关于肾毒性机制的另一种说法是药物在近曲小管中的蓄积产生直接毒性作用。
非ICU患者氯唑西林血药浓度的肾毒性阈值为50mg/L,而氟氯西林血药浓度与肾毒性无关。Imani等报道,与未发生肾毒性的患者相比,发生肾毒性患者的哌拉西林和美罗培南谷浓度均更高(哌拉西林130mg/L vs. 65mg/L,p<0.01;美罗培南25mg/L vs. 10mg/L,p<0.01)。
逻辑回归分析发现,当哌拉西林总血药浓度超过452.7mg/L、美罗培南谷浓度超过44.45mg/L时,肾毒性风险约为50%。当然,肾功能受损患者β-内酰胺抗生素的血药浓度一定会更高,这也并不一定是致病的。
另外,哌拉西林/他唑巴坦可以抑制OAT1和OAT3从而使肌酐水平升高,但并不代表真正的肾损伤,这也从一定程度上弱化了哌拉西林/他唑巴坦血药浓度与肾毒性的相关性。
3.5 其他不良反应
β-内酰胺抗生素还会导致过敏、血小板减少和艰难梭菌性肠炎,但并无明确的量效关系。尽管开展β-内酰胺TDM的主要目的是确保药物浓度达标,从而获得更好的疗效,但人们已经越来越多地意识到监测药物暴露相关的毒性反应也是TDM的重要作用。
对于合并器官功能不全的患者,以及具有明确毒性的β-内酰胺抗生素(如:头孢吡肟的神经毒性),应考虑定期进行临床评估及开展TDM以降低药物毒性。表1. β-内酰胺类药物常用的最大剂量
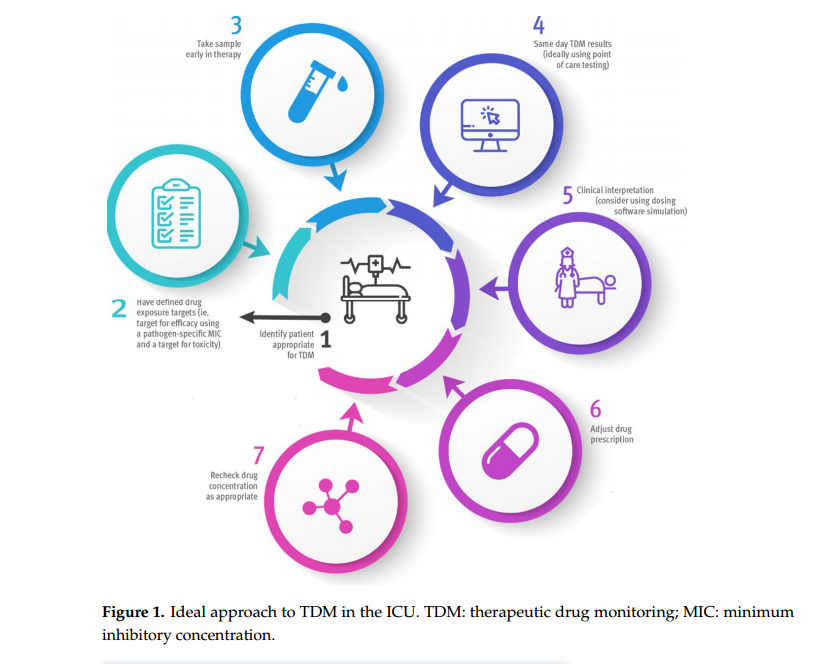
4、ICU中理想的治疗药物监测(TDM)
ICU中理想的TMD包括资源管理的平衡、适宜患者的选择、采样和报告的及时性、专家意见的依从以及抗生素剂量的调整(图1)。建议对每项因素进行持续的质量评价,以确保在现有条件下保持最优的TDM。
70%的ICU住院患者会接受至少一种抗生素治疗,因此,患者的选择是至关重要的。并不是所有的ICU患者在整个住院期间都是危重的或者都存在生理指标的紊乱,因此,在条件允许时,TDM应该针对那些更可能获益的患者。
获取实时微生物学检测结果和MIC值是指导TDM的最佳方法,然而,在开始治疗的48小时内往往无法明确致病微生物,而且一些实验室也不会常规报告MIC值。此外,对MIC值的解释还要考虑微生物实验室检验准确性的限制。
一旦明确了病人和病原体,就要尽快进行可靠的实验室检测,最好在当天能得到结果并进行解读,必要时及时调整药物剂量。虽然有几种高效液相色谱和液相色谱-质谱分析方法可用,但在ICU中进行这样的检测是受限的。
有一种无需色谱分析的即时检测方法,可以在床旁快速获取结果并及时做出临床干预。对ICU患者应该检测血中游离β-内酰胺抗生素浓度,尤其是那些蛋白结合率较高的抗生素,如:氟氯西林、头孢曲松、头孢唑啉。
应及时对TDM结果做出临床干预。尽管不同临床医生的治疗方案差异较大,但临床医生主导的药物剂量调整可以提高PK/PD达标患者的比例。应用剂量调整软件可以提高TDM的效用。
贝叶斯预测软件在药物剂量调整中显示出良好的效果,在改善疗效的同时可以降低毒性,但实际使用受其本身花费和临床医生接受软件使用培训情况所限。
受培训后的临床医生使用经过验证的软件解读TDM结果,并在软件指导下确定药物的推荐剂量是ICU中理想的TDM策略。与所有临床行为一样,TDM也要考虑花费和收益之间的平衡。
这其中的花费不仅限于数据分析,还包括样本采集、储存、运输,以及咨询专家解读TDM结果和使用剂量调整软件建模精确调整剂量的费用。
5、未来的研究领域
β-内酰胺抗生素在ICU患者中应用广泛,因此,优化调整剂量尤为重要。目前,尚无有关β-内酰胺抗生素暴露与临床结局的稳健分析,应优先完成这类研究,以便更精准、更有针对性地确定脓毒症患者β-内酰胺抗生素的PK/PD目标。
临床治愈、微生物清除以及抗生素耐药等临床结果应与患者发病率、病死率一同被纳入到未来的研究中,同时还应进行"成本-效益"分析。在全球范围内,ICU中β-内酰胺抗生素的TDM变得越来越重要。迫切需要进行有关简化流程的一些研究来优化TDM结果的报告时间。
更重要的是,剂量优化的策略(如:通过剂量诺模图和/或软件建模精准调节剂量)需要更进一步的研究,以确保各层面病人和系统的获益都能量化。
在无法开展TDM的ICU中,利用基于剂量调整软件包的先验预测算法模型来精确调整药物剂量或许是行之有效的。然而,用于评估这种方法临床获益的数据是有限的。
6、结论
在真正理解ICU中开展β-内酰胺药物TDM的意义之前,我们还需要得到更多的数据。目前,TDM的作用主要体现在两个方面,一是维持足够的血药浓度以确保疗效(但不同机构的血药浓度目标是有差异的,最优血药浓度标准尚不明确),二是检测毒性反应以确保不超过毒性阈值。
若对监测结果能够及时做出反应,在β-内酰胺治疗早期进行TDM可使危重患者得到最大获益。指南表明,TDM需要识别最可能获益的患者以及报告临床疗效指标和毒性指标。
任何一个TDM结果都需要进行临床干预,在设计新的给药方案时,提高精准度以及应用剂量调整软件是有价值的。基于临床结局的改善,进一步研究确定β-内酰胺的PK/PD目标是必要的,以确保对基于TMD的干预措施做出有意义的评估。
原文地址:
https://doi.org/10.3390/antibiotics12050870

