Cell Reports:复旦大学发现细胞代谢调节胰腺癌新机制
时间:2023-07-03 23:14:17 热度:37.1℃ 作者:网络
导读:作为死亡率最高的癌症之一,胰腺癌经历了KRAS驱动的代谢重编程。新出现的证据表明,Kac是研究最充分的蛋白质PTM之一,与PDAC的生长和转移直接相关。蛋白质赖氨酸巴豆酰化最近已被确定为细胞过程中重要的翻译后修饰,特别是通过组蛋白的修饰。
近日,复旦大学董琼珠、钦伦秀团队在《Cell Reports》上发表题为“Modulation of cellular metabolism by protein crotonylation regulates pancreatic cancer progression”的研究论文,研究表明,巴豆酰化代表了胰腺癌进展中的代谢调节机制。

https://www.sciencedirect.com/science/article/pii/S2211124723006770
研究背景
蛋白质翻译后修饰(PTM)是调节染色质动力学和基因表达的广泛表观遗传机制。最近,高灵敏度质谱(MS)能够鉴定一系列PTM类型,如乙酰化,甲基化,琥珀酰化等。赖氨酸乙酰化(Kac)是迄今为止最丰富和最广泛研究的PTM,具有进化保守性。越来越多的研究广泛表征了蛋白质乙酰化在细胞调节中的关键作用,特别是通过组蛋白和非组蛋白的修饰。具体来说,乙酰化已被证明是大多数中间代谢酶的主要调节因子,其可直接影响酶的活性或稳定性。
除Kac外,一些新型PTM已被确定为使用基于MS的蛋白质组学方法的PTM的重要形式。与乙酰化相比,赖氨酸巴豆酰化(Kcr)是一种新的蛋白质PTM,由赵氏小组在人类细胞系组蛋白和单倍体雄性胚芽中发现。可逆Kcr被证明代表进化保守的组蛋白PTM。随后的研究表明,新型PTM与Kac共享转移酶和脱酰酶与乙酰化类似,组蛋白巴豆酰化水平可由巴豆酰辅酶A的细胞内水平诱导。除组蛋白外,最近的一项研究报告还发现巴豆酰化也发生在非组蛋白中。然而,动态巴豆酰化是否参与包括胰腺癌在内的肿瘤中多种细胞功能和信号通路的调节尚不清楚。
研究进展
为了研究Kcr如何全局调节肿瘤进展,我们确定了两种人胰腺细胞系的整体巴豆酰化状态。用胰蛋白酶消化蛋白质,用抗巴豆酰化赖氨酸的抗体纯化巴豆酰化肽,然后进行高分辨率液相色谱-串联MS(LC-MS/MS)分析。从两个生物学独立实验中,我们从1,533种蛋白质中鉴定出4,187个巴豆酰化位点,在蛋白质,肽和位点水平上的错误发现率(FDR)不到1%。最近的一份报告确定了来自肺腺癌细胞系H12996和740(72%)的1,024种巴豆酰化蛋白质也存在于我们的数据集中。Li等人最近报道了从HeLa细胞中鉴定出686种巴豆酰化蛋白7,但其中只有189种存在于我们的数据集中。与这两项研究的结果相比,我们发现730种蛋白质在PDAC中未被鉴定出来。对这三个巴豆组数据集的比较表明,我们的蛋白质组学分析达到了高度的覆盖率。
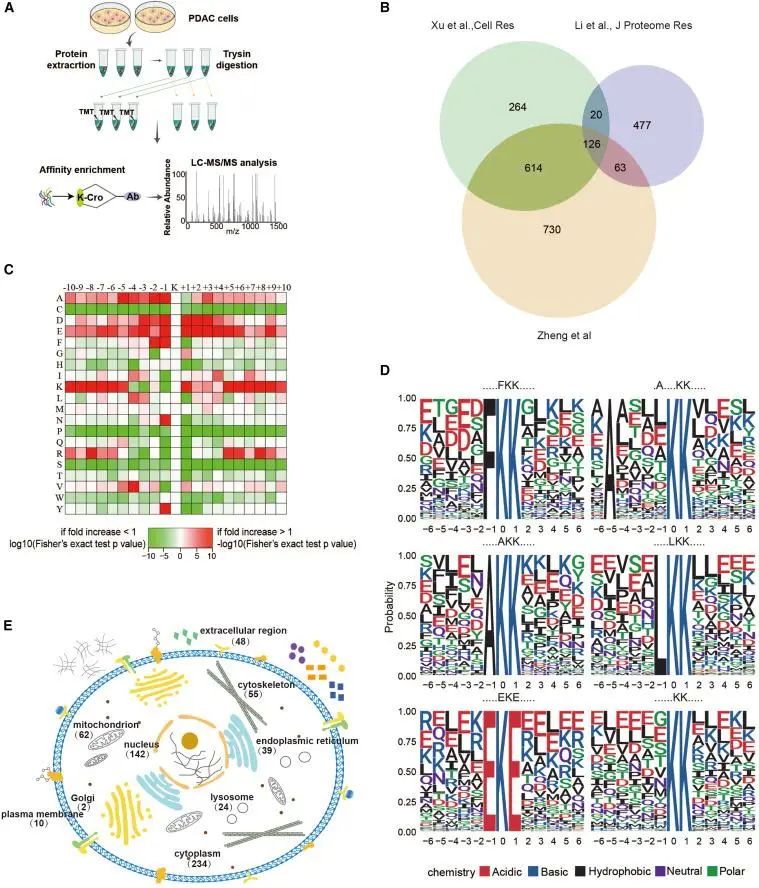
PDAC中蛋白质巴豆酰化的鉴定
为了评估与巴豆酰化位点相邻区域的序列的保守性,我们评估了这些位点的侧翼序列。该分析表明,蛋白质巴豆酰化赖氨酸在其-1和+1位置对谷氨酸(E)和天冬氨酸(D)具有更强的序列偏好,并显示出一系列巴豆酰化基序。与最近研究的乙酰化位点相比,巴豆酰化特殊位点周围的赖氨酸显示出巴豆酰化基序模式。为了进一步鉴定巴豆酰化蛋白的功能,这些蛋白质根据其亚细胞位置进行分类。30%的鉴定出的巴豆酰化蛋白位于细胞质中,22%位于细胞外区域,20%位于细胞核中,11%位于线粒体中。
研究亮点
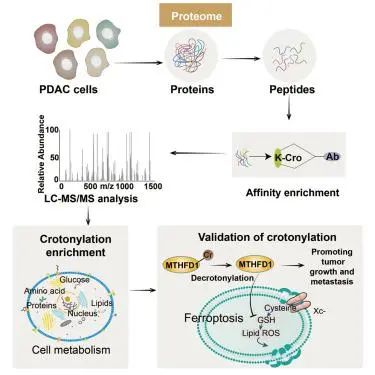
在本研究中,我们揭示了巴豆酰化在调节PDAC发展中的重要性。巴豆酰化是一个动态可逆的调节过程。越来越多的研究表明,乙酰转移酶和去乙酰转移酶也具有巴豆酰转移酶或去巴豆酰化酶活性。我们确定了代谢酶(如IDH1和FASN)的巴豆酰化水平是由CBP / p300,HDAC1和HDAC3介导的。我们进一步证实CBP/p300、HDAC1和HDAC3介导了MTHFD1在K354和K553处的低巴豆酰化,这对PDAC肿瘤进展很重要。
因此,我们的发现将代谢酶巴豆酰化与肿瘤恶性肿瘤直接联系起来,并证明Kcr可能在调节细胞代谢和癌症恶性进展中发挥重要作用。有趣的是,Lys1和Lys354的去氯酰化激活MTHFD553通过增加对铁死亡的抵抗力来促进胰腺癌的发展。我们的研究表明,巴豆酰化代表了胰腺癌进展中的代谢调节机制。
参考资料:
https://www.sciencedirect.com/science/article/pii/S2211124723006770.


