AM:吉林大学纪柏研究表明射频消融术联合纳米表观药物增强肝细胞癌免疫调节及抗原恢复效果
时间:2024-11-21 17:00:37 热度:37.1℃ 作者:网络
射频消融术(RFA)是肝细胞癌(HCC)的关键疗法,其治疗过程涉及免疫逃避和通过表观遗传修饰下调抗原的机制,往往存在复发和转移风险。
2024年11月16日,吉林大学纪柏唯一通讯在 Advanced Materials 在线发表题为“Enhancing Radiofrequency Ablation for Hepatocellular Carcinoma: Nano-Epidrug Effects on Immune Modulation and Antigenicity Restoration”的研究论文。该研究介绍了一种名为MFMP的“纳米表观药物”。MFMP由空心介孔二氧化锰(MnO2)纳米颗粒、作为MAT2A抑制剂的FIDAS-5、巨噬细胞膜和抗PD-L1(aPD-L1)组成,靶向HCC细胞。
通过选择性地结合这些细胞,MFMP首先通过PD-L1抑制逆转免疫抑制。胞吞后,MFMP在肿瘤微环境中分解,释放FIDAS-5和Mn2+。FIDAS-5阻止cGAS甲基化,而Mn2+有助于STING通路恢复。此外,FIDAS-5减少了m6A RNA修饰,抑制EGFR表达。这些变化增强了HCC抗原性,促进细胞毒性T细胞识别和细胞毒性杀伤。MFMP通过cGAS DNA去甲基化、EGFR mRNA去甲基化和TBK1蛋白磷酸化与RFA协同作用,介导HCC免疫原性细胞死亡,从而抑制复发和转移并增强免疫记忆。因此,MFMP是一种具备临床转化潜力的辅助疗法。

肝细胞癌(HCC)是第六大最常见的癌症,全球癌症相关死亡率排名第三。射频消融术(RFA)是一种微创热疗,微创且副作用小,是HCC的一线治疗方法。然而,较大的或血管相邻的肿瘤在RFA期间容易出现亚致死性热应激,导致肿瘤复发和转移。不完全RFA(iRFA)对HCC患者的生存构成重大威胁,限制了其临床应用范围。因此,将免疫检查点抑制剂(ICI)与RFA结合具备更好的抗癌效果。然而,热消融产生的微弱免疫反应阻碍了ICIs对免疫反应的增强,可能使治疗无效。因此,迫切需要预防肿瘤复发的新方法。表观遗传修饰是RFA后驱动免疫逃避和降低抗原的关键机制。热处理会诱导双链DNA损伤,该损伤由环状GMP-AMP合酶(cGAS)识别,进一步激活干扰素基因刺激因子(STING)信号通路。然而,HCC中的高DNMT1表达会导致cGAS甲基化,从而抑制cGAS活性并阻碍免疫反应。亚致死热应激会触发RNA甲基化过程中YTHDF1表达升高,从而增强EGFR mRNAN6-甲基腺苷(m6A)与HCC进展相关的表观遗传修饰。
必需氨基酸影响细胞代谢和生长,蛋氨酸饮食限制成为一种有效的癌症治疗方法。蛋氨酸通过蛋氨酸腺苷转移酶2A(MAT2A)转化为甲基供体S-腺苷甲硫氨酸(SAM)。SAM是一种关键的甲基供体,在整个基因组的各种甲基化反应中不可或缺,如DNA、RNA和蛋白质修饰。文献报道SAM限制是HCC治疗的潜在靶点。然而,长期缺乏蛋氨酸通常会引发肝脂肪变性,加速肝病的发展。FIDAS-5作为一种MAT2A抑制剂,可诱导细胞周期停滞和DNA损伤,在多发性骨髓瘤中具有抗癌特性。值得注意的是,尚未有研究报道FIDAS-5对HCC的治疗效果。锰离子(Mn2+)是金属免疫疗法的代表,可以放大STING激活效应。因此,值得探索FIDAS-5是否能够与Mn2+协同作为HCC的STING激动剂。
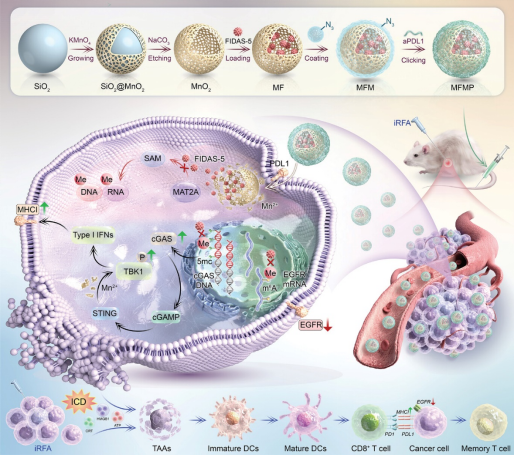
图1 MFMP的顺序合成及抗肿瘤免疫示意图(摘自Advanced Materials)
当前,现有抗肿瘤药物受到肿瘤细胞靶向性差、单药疗效不佳、毒性大、半衰期短、免疫原性和耐药性的限制。纳米颗粒载体可以通过靶向递送和增强的药代动力学来突破上述限制。细胞膜包被的纳米颗粒(CNP)是一类新兴的纳米载体,将合成纳米颗粒核心的多功能特性与细胞膜的生物特性相结合。特别是巨噬细胞膜(MMs),表现出免疫逃避、炎症靶向、癌症靶向和抗原呈递等特征,在肿瘤学的各个治疗领域具备应用潜力。该研究开发了一系列CNP,与其包封细胞膜的生物学特性一致,并使用各种工程学方法对其进行进一步修饰。如作者开发了各种基于DNA或RNA甲基化调控的多纳米平台,这些平台可以特异性靶向癌细胞,抑制各种癌基因,并通过不同的工程修饰增强免疫治疗效果。然而,该团队之前的研究侧重于通过个体DNA增强癌症免疫疗法或RNA甲基化。为弥合这一差距,该研究致力于开发同时靶向DNA和RNA甲基化的纳米颗粒,用于抗肿瘤免疫治疗。
受蛋氨酸循环的启发,该研究设计了一种“纳米表观药物”(MFMP),能够同时实现DNA和RNA的去甲基化。将MAT2A抑制剂FIDAS-5加载到空心介孔二氧化锰(MnO2)中,随后用叠氮化物标记的MMs涂覆,并通过点击化学顺序连接抗PD-L1(aPD-L1)。MMs的免疫相容性和aPD-L1靶向能力使MFMP能够特异性地与癌细胞结合。内化后,MFMP响应肿瘤微环境降解,释放Mn2+和FIDAS-5。随后,FIDAS-5通过靶向MAT2A、终止DNA甲基化和恢复cGAS活性来抑制SAM合成,与Mn2+诱导的TANK结合激酶1(TBK1)磷酸化协同作用,显著增强IFN-I分泌,最终放大免疫反应。同时,FIDAS-5抑制RNA甲基化,减少m6A mRNA修饰并抑制EGFR表达,有效抑制肿瘤生长和转移。因此,该纳米平台通过cGAS DNA去甲基化、EGFR mRNA去甲基化和TBK1蛋白磷酸化增强治疗结果,进一步增强HCC抗原性,从而增强肿瘤细胞识别和细胞毒性T细胞介导的杀伤能力。此外,MFMP会引发有效的免疫记忆反应,预防远端转移。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202414365


