【论著】| 探索阳性淋巴结比率在ypⅢ期结直肠癌患者中的预后价值及预测模型的建立
时间:2024-11-01 14:00:19 热度:37.1℃ 作者:网络
[摘要] 背景与目的:当前,对于中低位局部晚期直肠癌和T4bM0的潜在可切除结肠癌患者,指南均推荐新辅助治疗策略,以提高治疗的缓解率和增加转化性切除的可能性。其中对于ypⅢ期的结直肠癌(colorectal cancer,CRC)患者,均使用国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer, AJCC)TNM分期系统评估术后病理学特征。然而,新辅助治疗会导致术区淋巴结退缩,检出淋巴结数不足12枚的患者无法按照常规的TNM分期进行划分,因此TNM分期常无法预测接受过新辅助治疗的ypⅢ期患者的预后。本研究旨在评估阳性淋巴结比率(positive lymph node ratio,LNR)在接受新辅助治疗的ypⅢ期CRC患者中的预后价值。方法:回顾性分析2008—2018年在复旦大学附属肿瘤医院接受新辅助治疗且行根治性手术的ypⅢ期CRC患者。收集患者手术时的年龄、性别、原发肿瘤位置、肿瘤分化等级、病理学分期以及随访期间患者是否复发或死亡等临床病理学特征。纳入标准:接受新辅助治疗和手术且术后病理学检查证实为Ⅲ期的CRC患者。排除标准:① 术前影像学检查或术中探查发现已有远处脏器转移;② 有既往恶性肿瘤病史;③ 多原发性CRC。本研究通过复旦大学附属肿瘤医院医学伦理委员会批准(伦理编号:050432-4-2108*)。使用R软件的survminer包(surv_cutpoint算法)计算LNR相对于无病生存期(disease-free survival,DFS)的最佳临界值并依此将患者分为低LNR组和高LNR组,比较两组的临床病理学特征和DFS。采用COX比例风险回归模型筛选不良病理学特征并使用survival包和rms包绘制DFS列线图预测模型。结果:共纳入489例患者,男性289例,女性200例,中位年龄为56岁(23~80岁),中位随访时间为1 062 d。随访期间,164例(33.5%)患者死亡。整个队列中,204例(41.7%)患者检出淋巴结数不足12枚。LNR的最佳临界值为0.29,317例患者划为低LNR组(LNR≤0.29),172例患者划为高LNR组(LNR>0.29)。高LNR组相比低LNR组DFS更短[风险比(hazard ratio,HR)=2.103,95% CI:1.582~2.796,P<0.000 1]。多变量COX回归分析显示,LNR是DFS的独立预后危险因素(HR=1.825,95% CI:1.391~2.394,P<0.001)。根据纳入LNR的多分类DFS列线图预测模型可以有效地评估接受新辅助治疗的Ⅲ期CRC患者的DFS。结论:LNR是ypⅢ期CRC患者的独立预后因素,与其他不良临床病理学特征联合使用具有良好的DFS预测效力。因此,将LNR作为TNM分期的补充可以提高CRC的预后评估准确率。
[关键词] 结直肠癌;新辅助治疗;阳性淋巴结比率;预后;预测模型
[Abstract] Background and purpose: Currently, for patients with mid-to-low locally advanced rectal cancer and potentially resectable T4bM0 colon cancer, guidelines recommend neoadjuvant therapy strategies to enhance the response rate and increase the likelihood of conversion surgery. Among these patients, ypⅢ stage colorectal cancer (CRC) is assessed using the Union for International Cancer Control (UICC)/American Joint Committee on Cancer (AJCC) TNM staging system for postoperative pathological features. However, neoadjuvant therapy can lead to lymph node regression in the surgical area, resulting in an insufficient number of detected lymph nodes (less than 12), preventing classification according to conventional TNM staging. Thus, TNM staging often fails to predict the prognosis of ypⅢ patients who have undergone neoadjuvant therapy. This study aimed to evaluate the prognostic value of the positive lymph node ratio (LNR) in ypⅢ stage CRC patients treated with neoadjuvant therapy. Methods: Retrospective data was collected from ypⅢ stage CRC patients who received neoadjuvant therapy and underwent radical surgery at Fudan University Shanghai Cancer Center between 2008 and 2018. Collect clinical pathological characteristics such as age, gender, primary tumor location, tumor differentiation grade, pathological staging, and whether the patient has relapsed or died during follow-up at the time of surgery. Inclusion criteria: CRC patients who have received neoadjuvant therapy and surgery and have been confirmed to be stage Ⅲ by postoperative pathological examination. Exclusion criteria: ① Preoperative imaging examination or intraoperative exploration reveals distant organ metastasis; ② History of malignant tumors in the past; ③ Multiple primary CRC. This study was approved by the medical ethics committee of Fudan University Shanghai Cancer Center (ethics number: 050432-4-2108*). The R software survminer package (surv_cutpoint algorithm) was used to calculate the optimal cutoff value for LNR relative to disease-free survival (DFS), and patients were divided into low and high LNR groups accordingly. Clinical pathological characteristics and DFS were compared between the two groups. COX proportional hazards regression models were employed to identify adverse pathological features, and survival plots along with prediction models for DFS were generated using the survival and rms packages. Results: A total of 489 patients were included, comprising 289 males and 200 females, with a median age of 56 years (23-80 years) and a median follow-up time of 1 062 d. During the follow-up period, 164 patients (33.5%) died. In the entire cohort, 204 (41.7%) patients had fewer than 12 lymph nodes detected. The optimal cutoff value for LNR was 0.29, classifying 317 patients into the low LNR group (LNR≤0.29) and 172 patients into the high LNR group (LNR>0.29). The high LNR group exhibited shorter DFS compared to the low LNR group [hazard ratio (HR)=2.103, 95% CI: 1.582-2.796, P<0.000 1]. Multivariate COX regression indicated that LNR was an independent prognostic factor for DFS (HR=1.825, 95% CI: 1.391-2.394, P<0.001). The inclusion of LNR in a multicategory DFS nomogram prediction model effectively assessed DFS in stage Ⅲ CRC patients who had undergone neoadjuvant therapy. Conclusion: LNR is an independent prognostic factor for ypⅢ stage CRC patients, showing good predictive power for DFS when combined with other adverse pathological features. Therefore, incorporating LNR as a supplement to TNM staging can improve the accuracy of CRC prognosis assessment.
[Key words] Colorectal cancer; Neoadjuvant therapy; Positive lymph node ratio; Prognosis; Predictive model
结直肠癌(colorectal cancer,CRC)是一种常见的恶性肿瘤,其高发病率和死亡率给全球人类健康和医疗资源带来了巨大负担[1-3]。新辅助治疗旨在降低CRC分期,从而提高手术根治率和保肛率。然而,对于接受新辅助治疗的Ⅲ 期CRC患者,目前的TNM分期系统在预后评估方面存在局限性,尤其是当检出淋巴结数量少于12枚时[4]。近年来,阳性淋巴结比率(positive lymph node ratio,LNR)作为一个重要的预后指标,受到了广泛关注。相较于传统的淋巴结阳性/阴性判断,LNR能更全面地反映肿瘤的生物学行为和患者的预后情况。在食管癌[5-6]、乳腺癌[7]、胰腺癌[8]及胃癌[9-10]等多种恶性肿瘤中,LNR已被证实是一个有效的预后预测因子。因此,本研究聚焦于LNR与Ⅲ期CRC患者预后的相关性,并构建了一个包含LNR的多因素预后预测模型。该模型旨在更精确地评估患者的复发风险,从而为临床决策提供更为精准的治疗指导。通过深入研究LNR在CRC预后评估中的作用,期望能够为患者提供更为个体化的治疗方案。
1 资料和方法
1.1 研究对象
本研究回顾性分析2008—2018年在复旦大学附属肿瘤医院接受新辅助治疗且行根治性手术的CRC患者。收集患者手术时的年龄、性别、原发肿瘤位置、肿瘤分化等级、病理学分期以及随访期间患者是否复发或死亡等临床病理学特征。纳入标准:接受新辅助治疗和手术且术后病理学检查证实为Ⅲ期的CRC患者。排除标准:① 术前影像学检查或术中探查发现已有远处脏器转移; ② 有既往恶性肿瘤病史;③ 多原发性CRC。本研究通过复旦大学附属肿瘤医院医学伦理委员会批准(伦理编号:050432-4-2108*)。
1.2 新辅助治疗方案
局部晚期的直肠癌患者常规接受50 Gy/25次剂量的盆腔放疗,同期采用卡培他滨增敏,在放疗结束后2周进行1个或多个周期的XELOX/FOLFOX方案巩固化疗。巩固化疗的详细周期取决于手术间隔。对于初始不可切除的结肠癌,依据患者具体情况使用氟尿嘧啶类药物单药化疗或联合奥沙利铂或伊立替康化疗,甚至三药联合化疗。所有患者均接受根治性手术。术后根据患者情况进行辅助治疗。
1.3 术后淋巴结检测和最佳临界值的计算
术后病理学检查结果的评估由2名资深病理科主治医师共同完成,参照第7版国际抗癌联盟(Union for International Cancer Control,UICC) /美国癌症联合会(American Joint Committee on Cancer,AJCC)制定的TNM分期系统,根据癌组织的浸润深度、淋巴结转移情况及是否存在远处转移进行病理学分期。在评估过程中,详细记录患者的阳性和阴性淋巴结数,并据此计算LNR。使用R软件(version 3.0)的survminer包的surv_cutpoint函数和cutoff包的log-rank函数寻找生存预后分析中的最佳临界值,以提高生存曲线的显著性和准确性。
1.4 随访
本研究综合运用了门诊随访、电话随访及中国疾病预防控制中心的数据随访3种方法,以准确获取患者的生存时间数据。为了确保数据的时效性,我们将末次随访日期定义为这3种手段中最后记录的接触日期。截止日期为2021年2月7日。研究主要终点为无病生存期(disease-free survival,DFS)。
1.5 统计学处理
所有统计分析均采用SPSS 26.0软件进行。使用GraphPad Prism 9.2软件进行图形绘制。使用R软件(version 3.0)的survminer包和cutoff包计算LNR相对于生存的最佳临界值,使用survival包和rms包绘制列线图。两组间连续变量通过t检验比较差异,分类变量则采用χ2检验。采用Kaplan-Meier方法评估低LNR组和高LNR组的DFS并使用log-rank检验判定两组之间的差异。对单因素分析中差异显著的变量进行多因素COX回归分析,以确定独立的预后因素。P<0.05为差异有统计学意义。
2 结 果
2.1 LNR的最佳临界值
本研究共纳入489例患者,男性289例(59.1%),女性200例(40.9%),中位年龄为56岁(23~80岁)。患者筛选流程图见图1。随访时间为0~4 066 d,中位随访时间为1 062 d。随访期间,164例(33.5%)患者死亡。整个队列中,204例(41.7%)患者检出淋巴结数不足12枚。使用surv_cutpoint算法计算LNR相对于DFS的最佳临界值,结果显示,0.29是区分DFS的最佳临界值(图2A)。根据LNR将患者分为低LNR组(LNR≤0.29,n=317)和高LNR组(LNR>0.29,n=172)(图2B)。
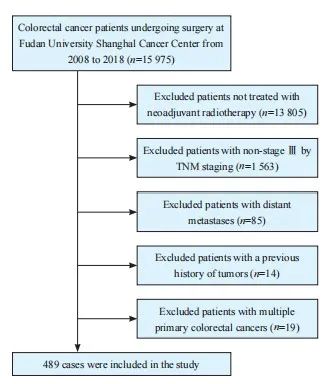
图1 患者筛选流程图
Fig. 1 Flowchart of patient screening
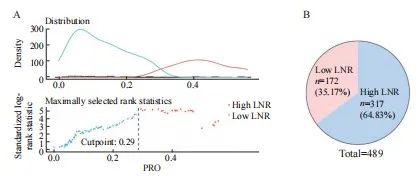
图2 LNR分组的最佳临界值
Fig. 2 The optimal threshold value for LNR grouping
A: The optimal cutoff value of LNR calculated by R software; B: The proportion of patients in different LNR groups.
2.2 患者的临床病理学特征
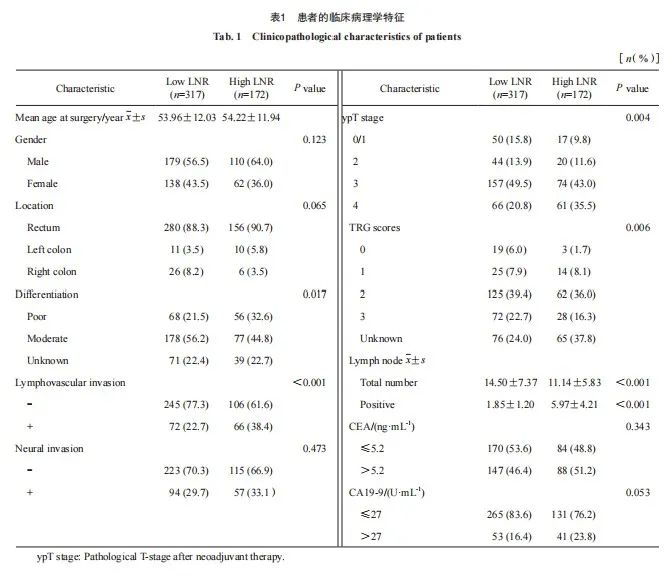
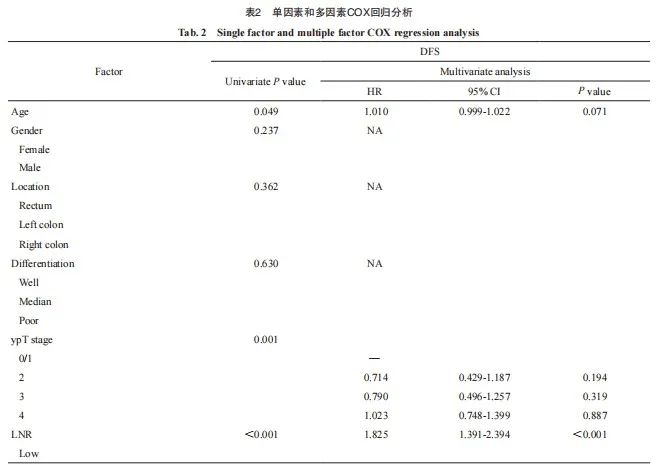
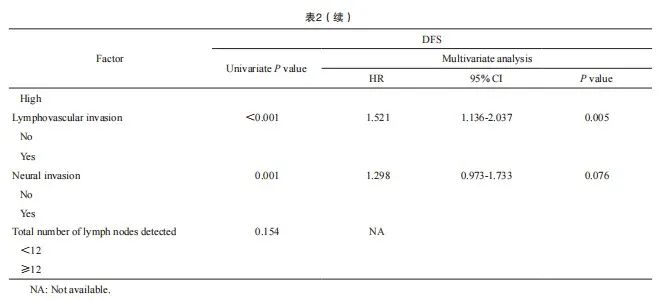
本研究比较了两组患者的临床病理学特征(表1)。两组在分化、淋巴管血管侵犯、T分期、肿瘤退缩分级(tumor regression grade,TRG)和检出淋巴结(总数及阳性数目)之间差异有统计学意义,高LNR组的中低分化、淋巴管血管侵犯的患者比例高,而肿瘤退缩效果好的(低T分期)患者比例低(P均<0.05),其他方面较为一致。两组患者在年龄、性别、肿瘤位置、神经侵犯和肿瘤标志物[癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)]方面差异无统计学意义(P>0.05)。
2.3 LNR对两组患者DFS的影响
使用Kaplan-Meier方法比较了两组患者的DFS。结果显示,高LNR组相比低LNR组DFS更短[风险比(hazard ratio,HR)=2.047,95% CI:1.542~2.718,P <0.000 1,图3],说明高LNR组预后更差。
纳入单因素分析中差异有统计学意义的年龄、ypT分期、肿瘤分化、脉管侵犯和神经侵犯等变量,进行多因素COX回归分析。结果显示,LNR是否超过0.29是DFS的独立预后危险因素(HR=1.825,95% CI:1.391~2.394,P <0.001,表2)。
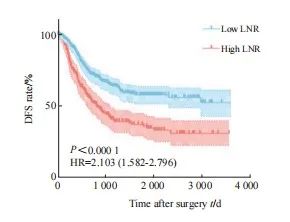
图3 基于LNR划分的ypⅢ期CRC患者的DFS分析
Fig. 3 DFS analysis of stage ypⅢ CRC patients based on LNR classification
2.4 纳入LNR的多因素预后预测模型
整合LNR、年龄、神经和淋巴管血管侵犯等变量,我们构建了一个多因素COX回归列线图预测模型(图4)。该模型能够基于分层因素进行简便直观的评分,并根据总评分来预测患者的DFS。这种直观的评分系统能够帮助临床医师快速准确地评估患者的肿瘤复发和死亡风险,从而提高临床决策的效率和准确率。
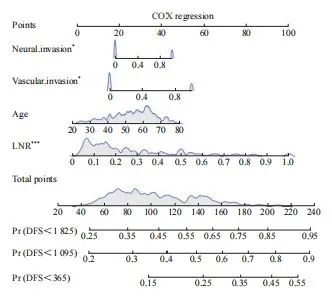
图4 引入LNR预测接受新辅助治疗的Ⅲ期CRC患者的DFS列线图模型
Fig. 4 Incorporating LNR into a DFS nomogram model for predicting Ⅲ stage CRC patients receiving neoadjuvant therapy
*: P<0.05; ***: P<0.001; Pr: Proportion.
3 讨 论
在CRC的治疗中,准确的分期对于选择适当的术后治疗、随访策略和预后判断至关重要。先前的研究[11]已经指出,新辅助治疗会影响淋巴结的检出率和Ⅲ期比例,提示传统TNM分期系统在经过新辅助治疗的CRC患者中可能不够精确。由于新辅助治疗可能导致转移淋巴结的退缩,且这种现象与原发肿瘤相对独立[12],因此,采用传统TNM分期系统时,不同淋巴结消退状态的患者亚组可能会出现不同的预后预测结果,从而难以为这类患者制订精准治疗方案。
本研究探讨了经新辅助治疗的ypⅢ期CRC患者中LNR与临床病理学特征之间的相关性,以及LNR的预后价值。结果表明,LNR和脉管侵犯是这些患者的独立预后因素。特别是与年龄、分化程度和神经侵犯相比,LNR作为一个连续变量,提供了关于DFS的更为可靠的预测信息。本研究与其他一些研究的结果[13-14]一致,表明基于LNR的分期比传统的N分期提供了更加精确的生存预后信息。尽管有些研究[15-16]显示,LNR的表现与传统的N分期相似甚至不如N分期,但其他研究[16-17]则显示,将LNR整合到TNM分期系统中的混合分期系统,比单独使用TNM分期系统具有更好的表现。例如,Wang等[18]研究表明,按照传统TNM分期,ⅢB期T3N1M0亚型患者比其他ⅢB期患者生存时间更长,与ⅢA期患者相似。但纳入LNR分析后,T4aN1M0亚型中LNR>30%的患者比LNR≤30%的患者生存更差,实际上类似于ⅢC期。值得注意的是,目前尚无公认的LNR最佳临界值。不同研究提出的临界值差异较大,这反映了在不同患者群体和治疗背景下,LNR的预后价值可能存在差异。然而,较高的LNR普遍被认为是CRC患者生存的独立预测因素,这支持了将LNR纳入未来分期系统的建议。Ceelen等[13]通过系统综述16项研究,涉及33 984例Ⅲ期CRC患者,发现LNR临界值介于6%至75%,并推荐将0.10作为未来研究的LNR临界值,这一建议与其他研究设定的临界值一样,通常缺乏统计学支持。尽管文献采用的LNR临界值各不相同,但Zhang等[19]通过对33项研究的meta分析得出结论,较高的LNR是CRC患者生存的独立预测因素,建议将LNR纳入未来的分期系统。为此,我们建立了一个纳入LNR的多因素COX回归列线图,有助于帮助医师更精确地评估患者的复发和死亡风险,能够为临床医师制定个性化的治疗方案提供参考,以期能提高患者的生存率和生活质量。
先前的研究表明,阴性淋巴结数量、对数比等指标也具有预测肿瘤患者预后的价值,但仍受限于所检淋巴结总数[20-22]。关于新辅助治疗后淋巴结清扫总数对预后的影响,目前的研究结果并不一致。有些研究[23-25]表明,清扫少于12个淋巴结可能不会影响生存率,而Narayanan等[26]研究则发现,在新辅助治疗后未完全缓解的患者中,检出至少12个淋巴结可以改善总生存期(overall survival,OS)。Lin等[27]研究也表明,清扫少于12个与至少12个淋巴结的患者的DFS和OS无显著差异。本研究也发现,在ypⅢ期患者中,清扫少于12个与至少12个淋巴结并不会影响DFS,此外,高LNR组较低LNR组检出淋巴结数更低,平均检出数小于12枚,而以0.29作为LNR的临界值显示此类患者DFS更差。这一发现表明,LNR分期法不依赖于淋巴结总数,可以作为pN分期的有效补充。因此,对于接受新辅助治疗的CRC患者,建议清扫≥12个淋巴结可能不合适。当淋巴结数目较少时,LNR可以作为这些患者的预后因素。
尽管LNR在预测预后方面具有潜在优势,但其计算依赖于病理学检查,可能带有一定的主观性,且无法充分反映肿瘤的分子生物学特征。因此,随着分子生物学技术的发展,未来可能会找到更准确全面的预后指标。同时,人工智能和大数据的应用也将推动预后评估系统的智能化发展,提高评估的准确率和效率。
本研究仍存在一定局限性,本研究是一项单中心回顾性研究,可能存在选择性偏倚。尽管LNR最佳临界值是基于单中心的大样本数据,方法可靠且具有临床实用性,但更精确的LNR分期仍需多中心大样本前瞻性研究进一步探索。此外,未明确入组患者的新辅助治疗和辅助治疗方案,并且10年时间跨度内的治疗方法发展可能对预后产生影响。
尽管如此,本研究显示,在ypⅢ期CRC患者中,LNR是独立预后因素,与年龄、神经和淋巴管血管侵犯结合可有效地预测患者的DFS,突破了传统分期的限制,对于将来指南修订及分期方法的改良具有一定的参考价值。未来的工作将重点确认LNR在预测长期生存和其他临床结果方面的价值,并探索与其他生物标志物联合使用的可能性,以优化患者管理策略。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
伍雯:研究设计,数据收集和统计分析,数据可视化绘图,文章撰写;
张若昕:数据收集和统计分析,程序编码和数据可视化;
翁俊勇:数据收集,数据分析;
马延磊:手术操作,研究实施监督和质量控制,行政支持;
蔡国响:研究实施,手术操作,文章审阅 修改;
李心翔:手术操作,行政支持;
杨永志:手术操作,研究实施监督和质量控制,经费支持,文章审阅修改。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] XI Y, XU P F. Global colorectal cancer burden in 2020 and projections to 2040[J]. Transl Oncol, 2021, 14(10): 101174.
[3] SIEGEL R L, GIAQUINTO A N, JEMAL A. Cancer statistics, 2024[J]. CA, 2024, 74(1): 12-49.
[4] PRANDI M, LIONETTO R, BINI A, et al. Prognostic evaluation of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial[J]. Ann Surg, 2002, 235(4): 458-463.
[5] ZHANG Y J, CAO Y Q, ZHANG J H, et al. Lymph node ratio improves prediction of overall survival in esophageal cancer patients receiving neoadjuvant chemoradiotherapy: a national cancer database analysis[J]. Ann Surg, 2023, 277(6): e1239-e1246.
[6] KANO K, YAMADA T, KOMORI K, et al. The prognostic value of lymph node ratio in locally advanced esophageal cancer patients who received neoadjuvant chemotherapy[J]. Ann Surg Oncol, 2021, 28(13): 8464-8472.
[7] DE LA CRUZ-KU G A, CHAMBERGO-MICHILOT D, VALCARCEL B, et al. Lymph node ratio as best prognostic factor in triple-negative breast cancer patients with residual disease after neoadjuvant chemotherapy[J]. Breast J, 2020, 26(9): 1659-1666.
[8] BARRAK D, VILLANO A M, MOSLIM M A, et al. Total neoadjuvant treatment for pancreatic ductal adenocarcinoma is associated with limited lymph node yield but improved ratio[J]. J Surg Res, 2022, 280: 543-550.
[9] JIANG Q, ZENG X Y, ZHANG C G, et al. Lymph node ratio is a prospective prognostic indicator for locally advanced gastric cancer patients after neoadjuvant chemotherapy[J]. World J Surg Oncol, 2022, 20(1): 261.
[10] CHEN J X, SUN J W, WANG Y, et al. Lymph node ratio-based the ypTNrM staging system for gastric cancer after neoadjuvant therapy: a large population-based study[J]. Surg Today, 2022, 52(5): 783-794.
[11] LYKKE J, ROIKJAER O, JESS P, et al. Tumour stage and preoperative chemoradiotherapy influence the lymph node yield in stages Ⅰ-Ⅲ rectal cancer: results from a prospective nationwide cohort study[J]. Colorectal Dis, 2014, 16(4): O144-O149.
[12] OZTURK S K, MARTINEZ C G, MENS D, et al. Lymph node regression after neoadjuvant chemoradiotherapy in rectal cancer[J]. Histopathology, 2024, 84(6): 935-946.
[13] CEELEN W, VAN NIEUWENHOVE Y, PATTYN P. Prognostic value of the lymph node ratio in stage Ⅲ colorectal cancer: a systematic review[J]. Ann Surg Oncol, 2010, 17(11): 2847-2855.
[14] ZHANG J Z, LV L, YE Y J, et al. Comparison of metastatic lymph node ratio staging system with the 7th AJCC system for colorectal cancer[J]. J Cancer Res Clin Oncol, 2013, 139(11): 1947-1953.
[15] JAKOB M O, GULLER U, OCHSNER A, et al. Lymph node ratio is inferior to pN-stage in predicting outcome in colon cancer patients with high numbers of analyzed lymph nodes[J]. BMC Surg, 2018, 18(1): 81.
[16] MOCCIA F, TOLONE S, ALLARIA A, et al. Lymph node ratio versus TNM system as prognostic factor in colorectal cancer staging. a single center experience[J]. Open Med, 2019, 14: 523-531.
[17] SUGIMOTO K, SAKAMOTO K, TOMIKI Y, et al. Proposal of new classification for stage Ⅲ colon cancer based on the lymph node ratio: analysis of 4 172 patients from multi-institutional database in Japan[J]. Ann Surg Oncol, 2015, 22(2): 528-534.
[18] WANG L P, WANG H Y, CAO R, et al. Proposal of a new classification for stage Ⅲ colorectal cancer based on the number and ratio of metastatic lymph nodes[J]. World J Surg, 2013, 37(5): 1094-1102.
[19] ZHANG M R, XIE T H, CHI J L, et al. Prognostic role of the lymph node ratio in node positive colorectal cancer: a meta analysis[J]. Oncotarget, 2016, 7(45): 72898-72907.
[20] VATHER R, SAMMOUR T, KAHOKEHR A, et al. Lymph node evaluation and long-term survival in stage Ⅱ and stage Ⅲ colon cancer: a national study[J]. Ann Surg Oncol, 2009, 16(3): 585-593.
[21] TELIAN S H, BILCHIK A J. Significance of the lymph node ratio in stage Ⅲ colon cancer[J]. Ann Surg Oncol, 2008, 15(6): 1557-1558.
[22] CHIN C C, WANG J Y, YEH C Y, et al. Metastatic lymph node ratio is a more precise predictor of prognosis than number of lymph node metastases in stage Ⅲ colon cancer[J]. Int J Colorectal Dis, 2009, 24(11): 1297-1302.
[23] HA Y H, JEONG S Y, LIM S B, et al. Influence of preoperative chemoradiotherapy on the number of lymph nodes retrieved in rectal cancer[J]. Ann Surg, 2010, 252(2): 336-340.
[24] DOLL D, GERTLER R, MAAK M, et al. Reduced lymph node yield in rectal carcinoma specimen after neoadjuvant radiochemotherapy has no prognostic relevance[J]. World J Surg, 2009, 33(2): 340-347.
[25] KLOS C L, SHELLITO P C, RATTNER D W, et al. The effect of neoadjuvant chemoradiation therapy on the prognostic value of lymph nodes after rectal cancer surgery[J]. Am J Surg, 2010, 200(4): 440-445.
[26] NARAYANAN S, ATTWOOD K, GABRIEL E, et al. Pathologic complete response despite nodal yield has best survival in locally advanced rectal cancer[J]. J Surg Res, 2020, 251: 220-227.
[27] LIN Z B, LI X B, SONG J Y, et al. The effect of lymph node harvest on prognosis in locally advanced middle-low rectal cancer after neoadjuvant chemoradiotherapy[J]. Front Oncol, 2022, 12: 816485.


