震撼!中国药科大学揭秘:四逆散巧治溃疡性结肠炎,神奇逆转胆固醇代谢,守护肠道与肝脏健康!
时间:2024-10-10 15:00:57 热度:37.1℃ 作者:网络
溃疡性结肠炎(UC)是一种全球范围内高发的慢性、非特异性炎症性肠病,其发病机制尚未被完全阐明,但普遍认为与过度免疫反应相关,属于自身免疫性疾病范畴。在UC的发病机制中,黏膜免疫稳态的紊乱被视为关键因素,而先天免疫细胞与适应性免疫细胞则在此过程中扮演了至关重要的角色。
然而,当前的治疗手段并非尽善尽美,存在疗效不稳定、治疗费用高昂、患者耐受性差以及安全风险明确等挑战。因此,我们迫切需要探索并寻求更为有效的治疗策略或补救办法,以改善UC患者的治疗效果和预后。
四逆散(SNS),根源可追溯至《伤寒论》。历经数千年的广泛临床实践,四逆散已被证实在治疗炎症性肠病方面展现出显著的疗效。尽管如此,关于其确切的生物活性成分以及潜在的作用机制,目前尚缺乏深入的理解与研究。
近日,一篇名为“Si-Ni-San alleviates intestinal and liver damage in ulcerative colitis mice by regulating cholesterol metabolism”的文章探讨了SNS减轻UC小鼠的相关作用机制。

图1 论文首页
SNS改善DSS诱导的小鼠结肠炎症状
该研究采用健康的C57BL/6J小鼠,并连续9天以3%DSS进行处理。实验期间,小鼠每日接受两次SNS(剂量分别为1.5、3、6g/kg)和5-氨基水杨酸(5-ASA,剂量为100mg/kg)的口服给药,共计9天(图2A)。对比分析后发现SNS在剂量为3.6g/kg时,能够显著且以剂量依赖的方式降低由体重减轻、腹泻和出血所构成的DAI评分,这一效果相较于DSS组更为明显(图2B-D)。
为了进一步验证SNS对肠黏膜屏障的保护作用,研究进行了组织病理学分析。结果显示,SNS有效减轻了结肠炎小鼠的黏膜溃疡、炎性细胞浸润、隐窝损伤以及表面上皮破坏等病理表现(图2E)。此外,与DSS组相比,SNS在剂量为6g/kg时,能显著抑制结肠炎小鼠结肠中IL-1β、TNF-α和IL-6等促炎介质的产生(图2F-H)。同时,SNS(6g/kg)还促进了occludin的表达(图2I),并减少了结肠氧化应激。
结果表明,SNS在剂量为3和6g/kg时,对DSS诱导的结肠炎所展现出的缓解效果,优于100mg/kg剂量的5-ASA。这一发现为SNS在肠道炎症治疗中的潜在应用提供了有力的实验证据。
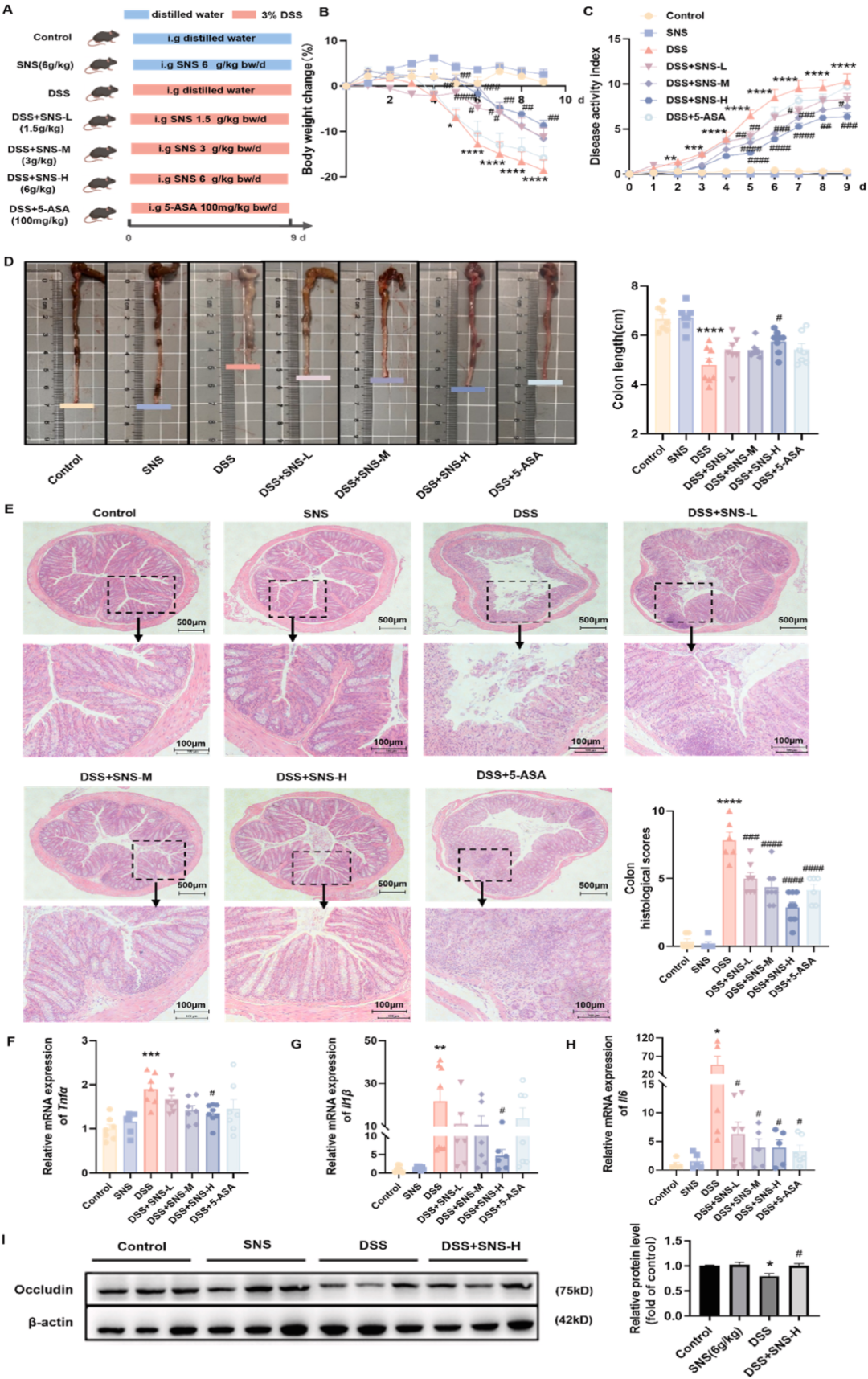
图2 SNS缓解了DSS诱导的结肠炎
SNS减轻UC小鼠肝损伤和脾脏肿大
此外,研究深入分析了关键脏器指标,以全面评估脏器受损状况。结果显示,SNS以剂量依赖性的方式有效抑制了结肠炎小鼠的肝脾肿大(图3A、B),而其余脏器指标在组间对比中并未呈现出显著差异。研究还通过监测小鼠的体重变化、结肠长度及关键脏器指标,对SNS的体内安全性进行了全面评估。结果显示,SNS处理并未引起上述指标的显著变化,从而证实了SNS在小鼠体内应用的安全性。
值得注意的是,DSS组小鼠除表现出ALT与AST活性异常升高外,还伴有肝脏的病理学改变。然而,SNS的干预显著降低了这两项指标的水平(图3C-E),进而减少了DSS诱导的轻度至中度肝损伤的发生率(图3F)。同时,肝脏的病理参数与结肠及疾病活动指数中的炎性细胞因子之间存在显著的相关性(图3G),这提示SNS对UC的改善作用可能与其对伴随性肝损伤的调节密切相关。
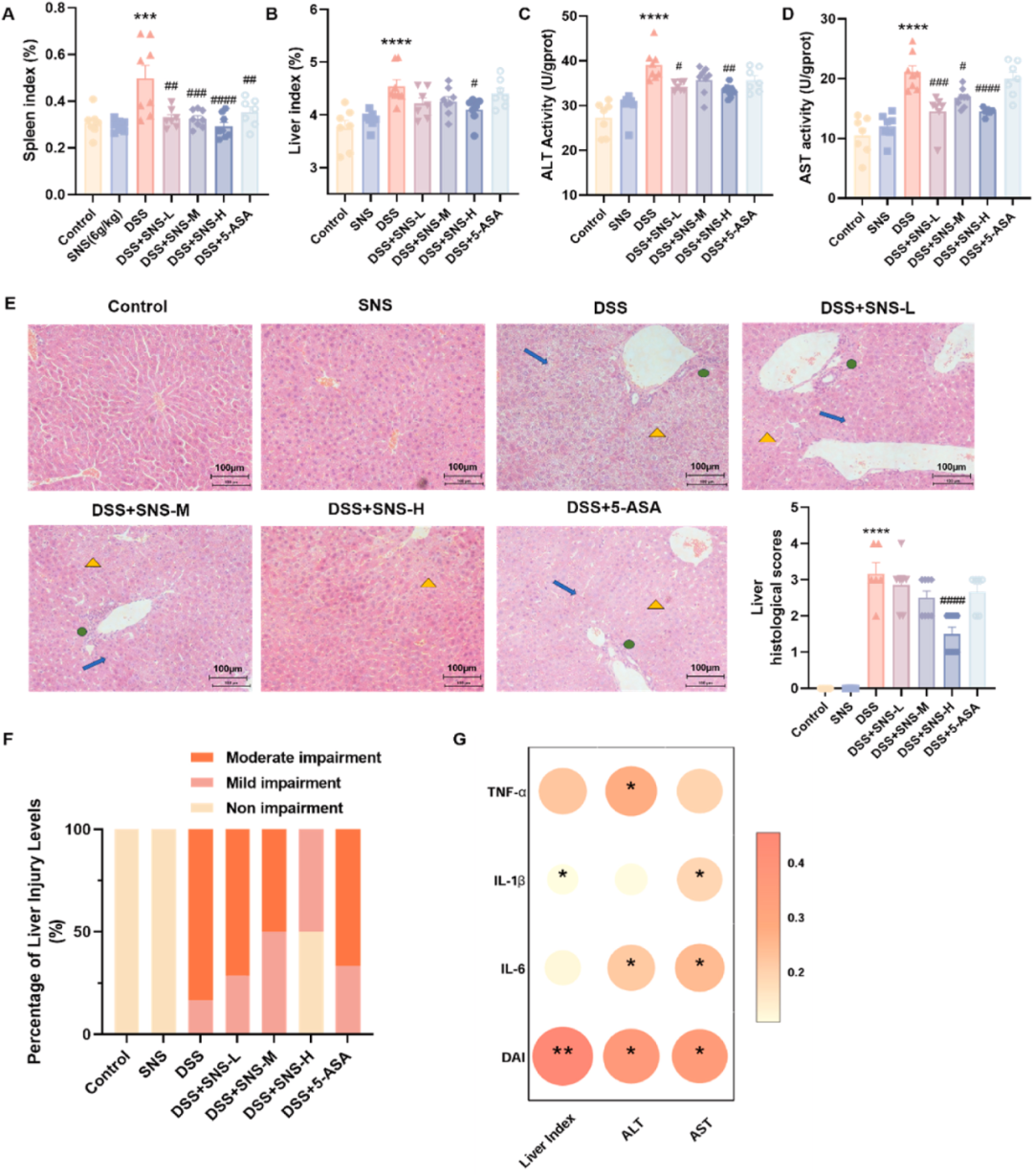
图3 SNS减轻了UC小鼠的肝损伤和脾脏肿大
SNS抑制结肠炎小鼠结肠和脾脏Th17分化,改善Th17/Treg失衡
Th17细胞是源自于CD4+T细胞的一个特定细胞亚群,其分化过程伴随着Treg细胞比例的相应减少。相较于DSS组,SNS在结肠炎小鼠模型中显著提升了脾脏及结肠固有层内Treg细胞的比例,并相应地减少了Th17细胞的比例(图4A)。其核心机制在于RORγt与Foxp3这两种关键转录因子的作用,它们分别是Th17与Treg细胞分化的主要调控因子。SNS对Th17/Treg平衡的调节效应,可通过这两种转录因子的蛋白表达水平得到体现(图4B)。此外,通过针对结肠组织进行的IL-17A与Foxp3染色的免疫组织化学分析,也证实了上述观察结果(图4C)。进一步地,DSS组小鼠体内Th17细胞的标志性细胞因子,如IL-17A与IL-22,均呈现上调趋势,而与之相对的Treg特异性细胞因子则出现下调(图4D)。综上所述,SNS在阻断Th17细胞分化的同时,有效促进了结肠炎小鼠体内Treg细胞的分化过程。
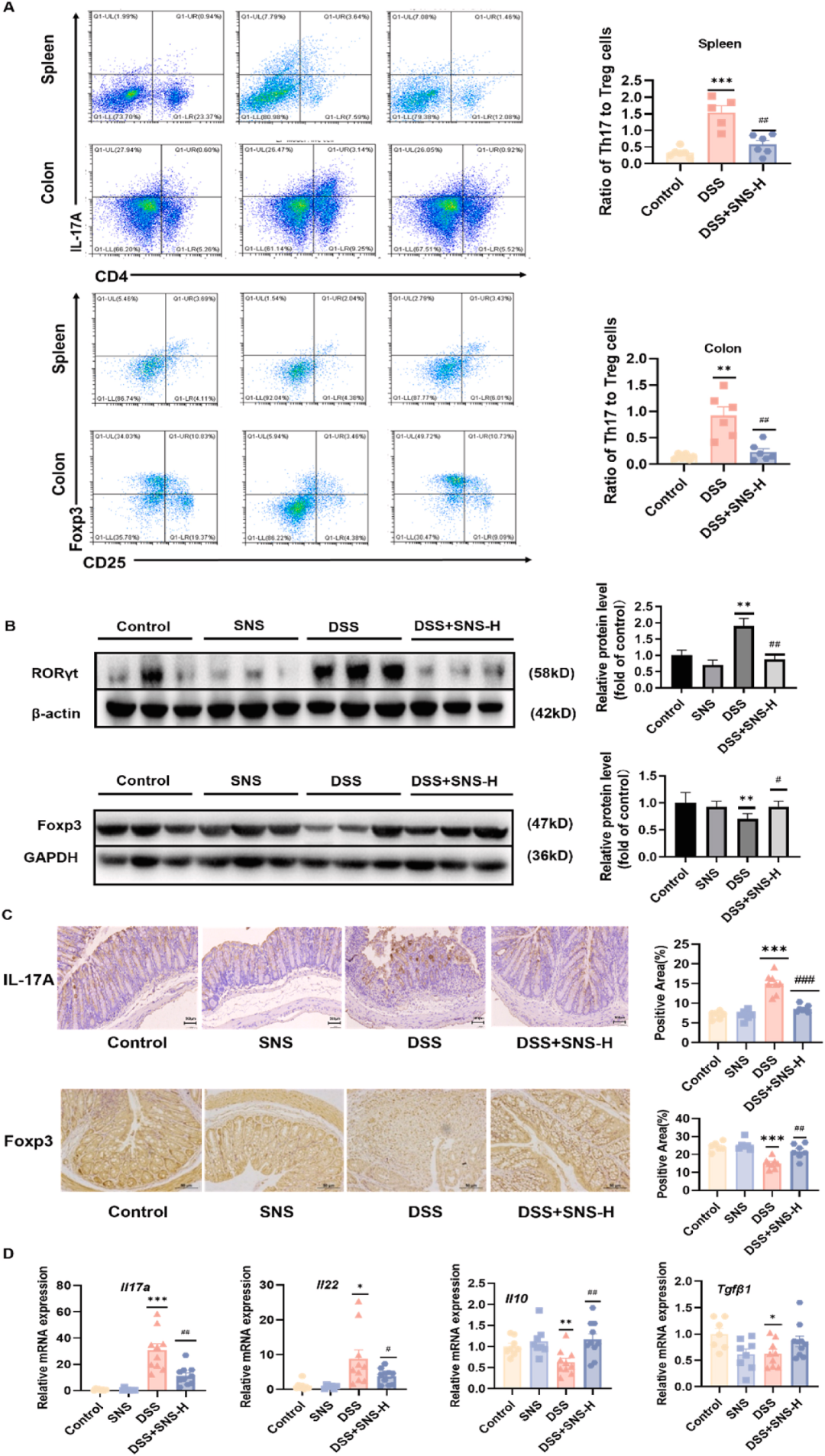
图4 SNS改善了UC小鼠结肠和脾脏Th17/Treg失衡
SNS通过调节氧化固醇LXRs信号传导缓解UC
氧化固醇是LXRs的内源性激动剂,在调节幼稚CD4+T细胞向Th17/Treg谱系分化过程中发挥关键作用。基于此,研究通过采用LC-MS/MS技术,精确测定了结肠内作为LXRs内源性配体的氧化固醇含量。尽管LXRs的拮抗剂4β-OHC的含量在各实验组间保持稳定,但DSS组小鼠结肠中作为LXRs激活剂的27-OHC和25-OHC的含量却显著下降(图5A)。
与此同时,研究进一步观察到结肠组织中负责氧化固醇合成的关键酶CYP27A1和CH25H的mRNA及蛋白质表达水平均有所下降(图5B,C)。相反,DSS组小鼠结肠中CYP7B1的mRNA和蛋白质表达水平均有所上升(图5D),该酶在代谢过程中能够促使27-OHC和25-OHC转化为7α,27-diOHC和7α,25-diOHC,进而导致了27-OHC和25-OHC水平的进一步降低。
结果表明,在结肠炎小鼠模型中,氧化固醇LXRs信号传导途径受到明显损害。而SNS给药则可能通过调节氧化固醇-LXRs信号传导,对恢复Th17/Treg平衡产生积极影响。
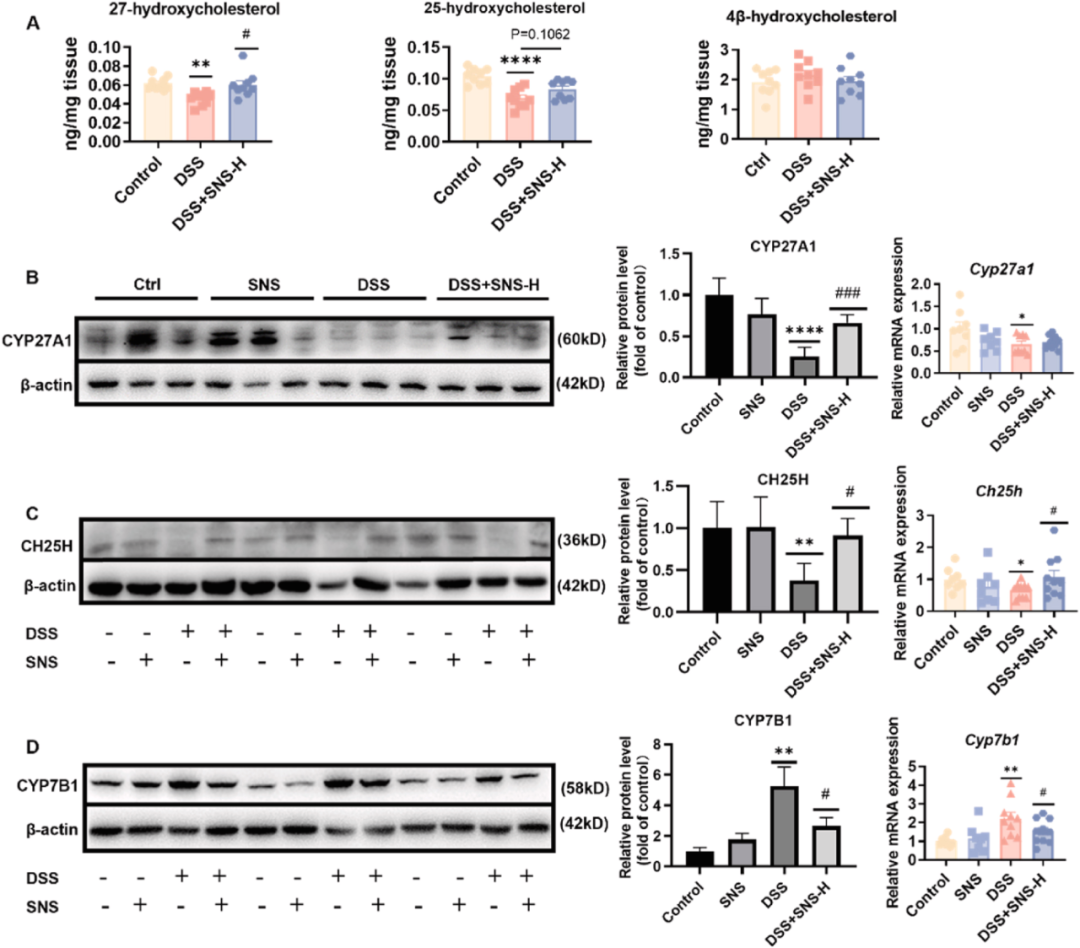
图5 SNS恢复了结肠中LXR的内源性配体水平
SNS通过逆转UC小鼠BA合成向酸性途径的转化来保护肝脏
该研究表明SNS对结肠炎小鼠的肝损伤具有显著的缓解作用。为深入探讨其抗肝损伤机制,研究对相关生化指标及代谢途径进行了系统分析。DSS诱导的模型组显示,肝脏内T-CHO及TBA水平异常上升(图6A、B),提示甾醇代谢稳态的紊乱。胆固醇在肝脏内经由中性和酸性两种途径转化为胆汁酸(BA),而BA代谢的异常已被报道与肝损伤及包括IBD在内的多种消化系统疾病密切相关。
进一步分析发现,DSS组小鼠肝脏的BA谱发生了显著变化,而SNS处理则有效恢复了这一异常状态。具体而言,α-鼠胆酸(α-MCA)、β-鼠胆酸(β-MCA)、牛磺鼠胆酸(T-MCA)、熊去氧胆酸(UDCA)及猪去氧胆酸(HDCA)等BA含量显著增加,同时非12-羟基BA在总BA中的占比也呈现上升趋势(图6C、D),这表明在结肠炎小鼠的肝脏中,BA的合成路径可能由中性途径向酸性途径发生了转变。
为验证BA水平变化的分子机制,研究进一步检测了BA代谢途径中关键酶在mRNA及蛋白质水平上的表达情况。结果显示,DSS组小鼠肝脏内中性合成途径的关键酶CYP7A1和CYP8B1的表达水平显著降低(图6E),而启动酸性合成途径的StarD1则显著上调(图6F),这进一步证实了结肠炎小鼠肝脏中酸性代谢途径的激活状态。
值得注意的是,非12-羟基BA的增加可能与UC的进展密切相关,因为α-MCA、β-MCA及HDCA等BA与结肠炎性细胞因子及疾病活动指数呈正相关关系(图6G)。综上所述,研究表明SNS能够通过调节BA合成途径中的关键酶,逆转UC小鼠肝脏中BA合成向酸性途径的转变,从而有效改善肝损伤及结肠炎症状。
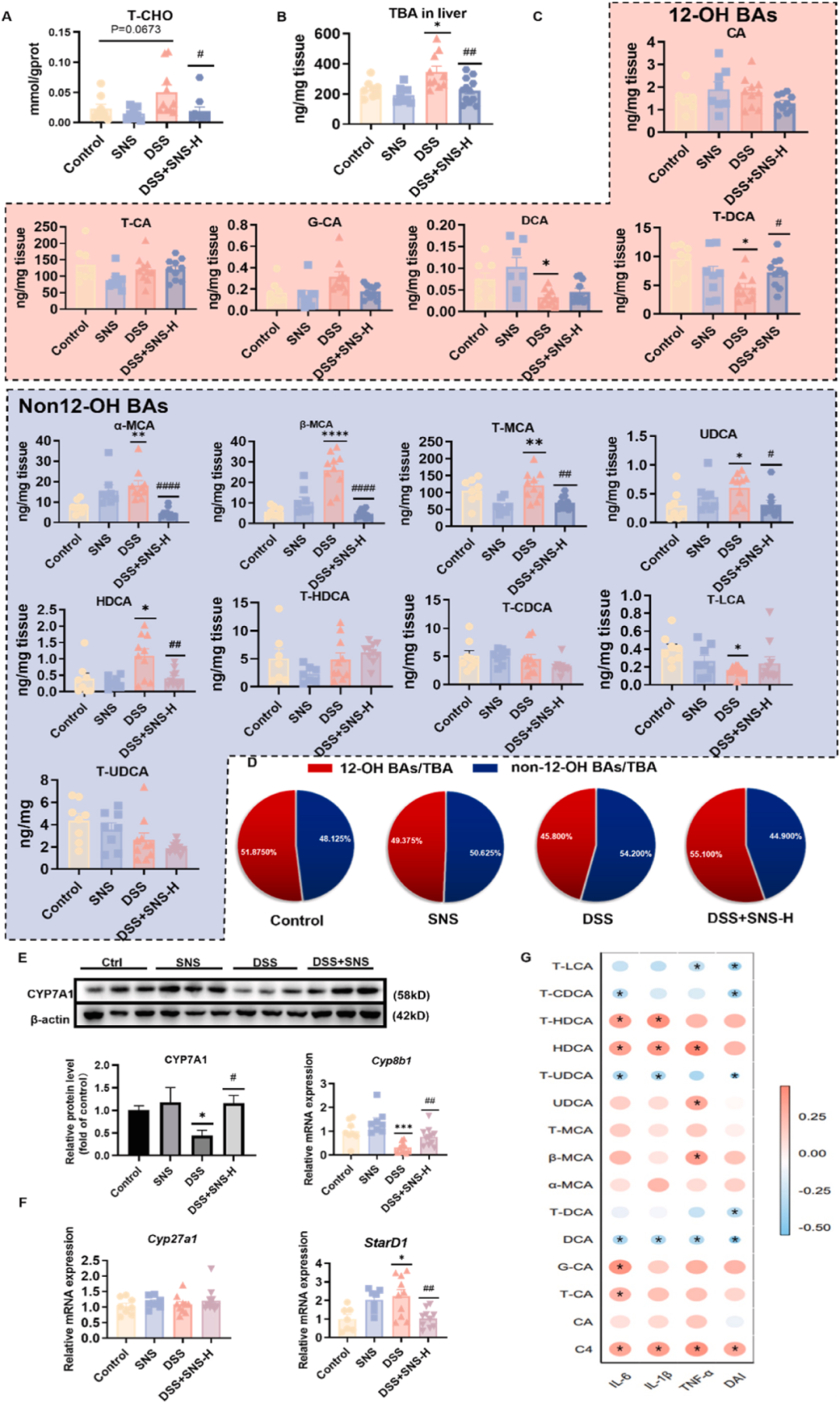
图6 SNS逆转了UC小鼠BA合成向酸性途径的转变
结论
总之,SNS通过调控结肠“氧化固醇LXRs”信号通路,有效维持Th17与Treg之间的平衡状态,从而在UC的病理过程中发挥显著的保护效应。
参考文献:
Wang A, Yang X, Lin J, Wang Y, Yang J, Zhang Y, Tian Y, Dong H, Zhang Z, Song R. Si-Ni-San alleviates intestinal and liver damage in ulcerative colitis mice by regulating cholesterol metabolism. J Ethnopharmacol. 2025 Jan 10;336:118715. doi: 10.1016/j.jep.2024.118715


