超强变异株如何在新冠感染者体内“孕育”?《自然》长文揭示长期不痊愈与变异产生的危险关系
时间:2023-01-06 21:01:59 热度:37.1℃ 作者:网络
对于新冠病毒来说,一些长期感染而不痊愈的宿主可能是超强变异株的绝佳“孕育场所”。追踪新冠病毒在持续感染病例中的演化,能帮助我们发现 Omicron 和其他全球流行株的起源。
本文转载自公众号“Nature Portfolio”
原文作者:Ewen Callaway
原文发表于 2022 年 6 月 15 日
病毒学家 Sissy Sonnleitner 追踪着奥地利东提洛尔地区几乎每一位 COVID-19 患者。因此,当她发现当地一名女子连续几个月检测呈阳性时,Sonnleitner 下定决心一定要搞清楚怎么回事。
这名 60 多岁的女子在 2020 年末感染了新冠病毒(SARS-CoV-2),在那之前,她一直在吃免疫抑制剂治疗淋巴瘤。她的新冠感染一共持续了 7 个多月,症状相对较轻,包括疲劳和咳嗽。

一次7个月长的新冠病毒感染在刺突蛋白上积累的突变。插图:Nik Spencer/Nature来源:参考文献1
Sonnleitner 就职于奥地利 Außervillgraten 的一个微生物学实验室,她的同事收集了该女性的 20 多个病毒样本,并通过基因测序发现这些病毒出现了约 22 个突变(见“追踪刺突蛋白的演化”)。其中约一半的突变能在几个月后传遍全球的 Omicron 中再次看到——Omicron 是携带大量突变的新冠病毒变异株[1]。“当 Omicron 被发现时,我们都很惊讶,” Sonnleitner 说,“因为我们已经在我们的变异株中看到过这些突变了。”
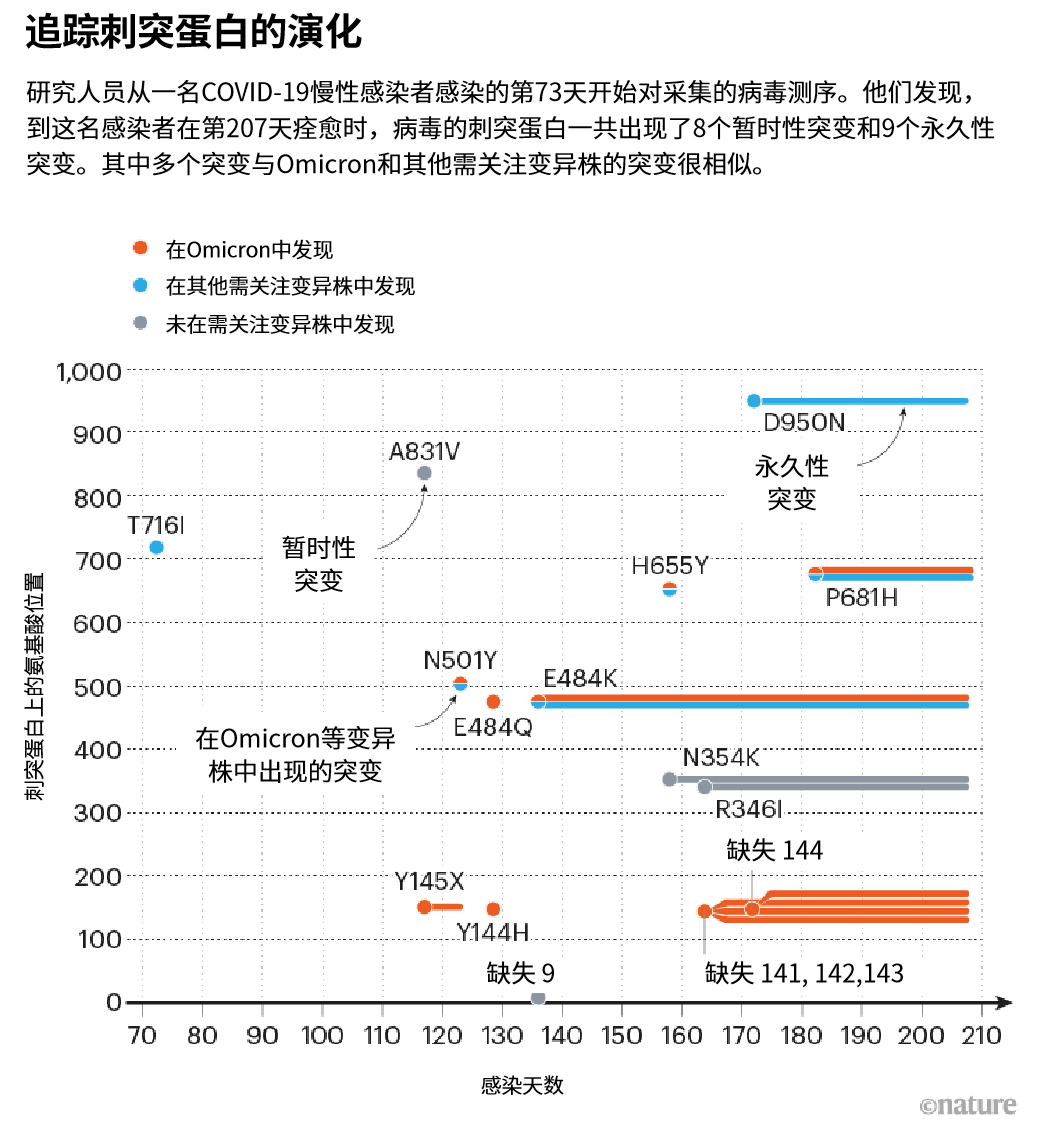
来源:参考文献1
Omicron 并非源于这名女性感染者——她貌似从未将感染传给过其他人。虽然还未发现与个体病例的确定性关联,但对于Omicron 等掀起全球疫情的变异株来说,像她这样的慢性感染者很可能是一个主要起源。英国剑桥大学病毒学家 Ravindra Gupta 说:“我想任何人都不会怀疑,这就是新变异株的一个来源。”
研究人员想知道新冠病毒是如何通过演化变得更容易人际传播,更容易免疫逃逸,或是变得更严重或更不严重。这些特性中的一些或是全部或许是在一次慢性感染期间出现的。南非非洲健康研究所的病毒学家 Alex Sigal 说:“我们还不太清楚哪些演化会出现在一个人体内,哪些不会。”
利用这些信息来预判下一个致命毒株的出现甚至追溯 Omicron 等变异株的起源,这种可能性微乎其微。不过,病毒学家还是希望通过提高对病毒演化的理解,预测未来变异株的可能性质,并找到治疗慢性感染的最佳方法。Sigal 说:“这个问题很重要,因为谁都不想再看到另一个很难对付的变异株。”
致命竞争
2019 年末至今,科研人员已经对从人体内采集的逾 1100 万个新冠病毒样本的基因组完成了测序,并在这些测序结果的基础上绘制出了一颗“枝繁叶茂”的演化树,记录了新冠病毒横扫地球过程中的一步步变化——新冠病毒在人际传播的过程中平均每个月只增加几个稳定的突变。
加拿大不列颠哥伦比亚大学的演化生物学家 Sarah Otto 说:“但这只是整个演化故事的一部分。”每个人的感染自成一个宇宙,当感染从一个细胞传到另一个细胞时,新的突变就会产生。大部分这些突变对病毒没有影响,许多突变还对病毒不利。但有部分突变会让病毒比宿主体内的其他突变版本更有优势,使其传播力增强,或是对免疫屏障有一定的抵抗力。传染性和免疫逃逸这两个特性是新冠病毒自 2019 年出现以来的主要演化方向。
新冠病毒的急性感染期通常为一到两周,之后就会被免疫系统清除。在急性感染期,携带有利突变的病毒只有很短的时间去“干掉”缺少有利突变的病毒。因此,有优势的病毒被传给另一个人的机会其实并不大。研究显示,形成新的传染只需要少数几个病毒颗粒——甚至可能只要一个病毒颗粒[2]。美国弗雷德·哈钦森癌症研究中心的演化生物学家 Jesse Bloom 说:“当别人经过你身边并吸入你喷出的气溶胶颗粒时,哪些病毒混在其中基本要看运气。所以,感染者体内出现的大部分有利突变最后就这么消失了,整个演化过程只能从头再来一遍。”
这种“传播瓶颈”也是为何在全球传播的新冠病毒平均每个月只会出现两个左右的突变。但在几个月不见好的慢性感染中,携带优势突变的病毒就有更多时间打败竞争者。
与急性感染相比,慢性感染也给了病毒更多时间扩大它的多样性。通过重组这个能打乱新冠病毒颗粒基因组的过程,在体内某个部位有利的突变,比如上呼吸道,就能跑到有其他优势特性的病毒中,爱丁堡大学演化生物学家 Andrew Rambaut 说,“如果最后得到了一个适应力更强的病毒,它几乎能‘原地出道’。”
Otto 说,在全球范围内,慢性感染使这个病毒不仅能以一种方式向一个方向演化,而是在几个月内有机会向数千乃至上万种方向演化。
瞄准刺突蛋白
没有哪两种慢性感染是完全相同的。但研究人员已经开始在几十个病例中找到慢性感染的共同特征了。Otto 说,一个最显著的特征是病毒刺突蛋白上大量出现的氨基酸变化——刺突蛋白能帮助病毒感染细胞,也是人体免疫应答的一个主要靶标。
许多这类突变都位于抗体靶向的刺突蛋白区域,比如受体结合结构域(RBD)和 N 端结构域,病毒会利用这些结构域识别和感染宿主细胞。南非开普敦大学的演化病毒学家 Darren Martin 认为,这在情理之中。如果一个人的免疫系统无法完全清除感染,活下来的病毒很可能携带免疫逃逸突变,能帮它们抵御免疫系统的攻击。一项尚未经过同行评议的研究[3]发现,慢性感染中最常见的突变是位于刺突蛋白 RBD 的 E848 突变。这个位点的突变能让一些阻断感染的强效抗体无法与病毒结合。
一些突变本身并没有很大本事。去年,Gupta 和他的团队报道了一位免疫系统受损的 70 多岁男性经历的一次 102 天的感染,这名男性最终死于这次感染[4]。在医生给他使用了康复期血浆(COVID-19康复患者捐献的血液中含有抗体的部分)后,Gupta的团队发现这名男性的气道中仍活跃着携带一对刺突蛋白突变的病毒。
受感染的嗅觉上皮细胞内的新冠病毒颗粒(绿色)。来源:NIAID/NIH/SPL
其中一个突变名为 D796H,能让病毒抵御抗体攻击,但这种效应需要病毒付出代价。研究团队让一个无法复制的“假病毒”携带 D796H 突变,并检测它在实验室中感染细胞的能力,他们发现如果这个突变单独出现,会大大降低假病毒的传染性。但如果假病毒还携带此人体内发现的另一个突变——位点 69 和 70 的两个氨基酸缺失——病毒的传染性几乎能完全恢复[4]。这两个在慢性感染中有更多时间出现的互补突变,能让病毒完成演化飞跃,Gupta 说,“那些需要在不同宿主间快速切换的病毒很难完成这个飞跃。”
某些情况下,只有事后回看才能发现一些突变的意义。2020 年末,美国布列根和妇女医院的医生-研究员 Jonathan Li 和他的同事发表了首个新冠病毒慢性感染病例的详细报告:一个患有罕见自身免疫疾病的 45 岁男子最终不治而亡的病例[5]。新冠病毒获得了与抗体抗性相关的突变,包括 E484K,以及另一个刺突蛋白突变 N501Y,实验室研究显示这些突变能增强病毒与宿主细胞受体的结合能力,有望增强其传染性[6]。
当研究人员在后来被命名为需关注变异株(VOC)Alpha、Beta和 Gamma 的三个快速壮大的谱系中都发现了 N501Y 突变时,该突变的重要性变得不言而喻。Omicron 也有这个突变,还有几个也在这名男性感染者体内发现的其他突变。Li 说:“这名男子就像是一个先兆。”
寻找变异株起源
英国 2020 年末发现的 Alpha 是首个疑似源自某次慢性感染的新冠变异株。但 Rambaut 说,但这并非唯一可能的起源。Alpha 也许来自某个新冠病毒基因组监测能力较弱的地区——可能并不在英国。另一种解释是 Alpha 或许是在一个动物宿主体内演化而来(Alpha 的 N501Y 突变能让新冠病毒感染小鼠、大鼠和雪貂)。
一次偶然发现还是将慢性感染归为 Alpha 最有可能的起源。Rambaut 和爱丁堡大学生物学家 Verity Hill 在 3 月的一篇预印本论文中报道了英国测序数据中发现的 Alpha 一个中间版本[7]。这个序列是 2020 年 7 月从英格兰东南部的一名个体采集的,两个月后 Alpha 在该地区首次被检测到。
这个病毒已经有了 N501Y 突变和其他几个 Alpha 的标志性突变,但它还不具备全套突变。Hill 说:“它正在积累这些突变。它的传播能力可能还不怎么样。”她说,只有在这个 Alpha 中间版本获得更多突变后,它才可以一鸣惊人。
Omicron 中也能看到各种突变组合。多个亚型有相同突变的 Omicron 携带了很多此前从未发现过的、与免疫逃逸和传染性相关的基因突变。但 Martin 注意到的是,在大部分国家引发 Omicron 感染的 BA.1 亚型有 13 个研究人员之前很少单独看到的刺突蛋白突变,这种一次性全部出现单个病毒中的情况就更难得了。
Martin 和他的同事提出假说[8],在这个独一无二的突变组合中,一些突变能帮助抵消与加快 Omicron 传播速度的突变相关的演化代价。Martin 说:“这种取舍需要很长时间才能完成,而在我看来,这个过程只能发生在慢性感染中。”他解释道,这可以发生在人类或动物中。
Omicron 的另一个特征——致病性下降——也可能源于慢性感染。实验室研究发现,Omicron 之所以变得相对温和,可能是它更喜欢感染上呼吸道细胞而不是肺部细胞的结果[9]。Omicron 或许是从一个能熟练感染上呼吸道和下呼吸道的毒株演化而来的。Gupta 猜测 Omicron 的转变可能离不开协同演化——当一个病毒在一个人体内存在数月时,就会发生这种协同演化。但我们仍不清楚驱动这种转变的演化动力。
寻寻觅觅
慢性感染可能是对 Omicron 和 Alpha 这类变异株起源的最好解释。但大部分变异株的一个典型特征——极快的人际传播能力——是如何在一个人的体内完成演化的问题并不清晰。“这绝对是个谜,”Bloom 说,“如果某个东西没有受到选择,它基本就慢慢消失了。而慢性感染中根本没有对传播力的选择。”
一个可能解释是帮助新冠病毒感染气道、肺等器官的分子机制,对于新冠病毒向外传播也很重要。Martin 说:“病毒在人体内传播所需的动力学与病毒向外传播的动力学是相同的。”
但仅仅保留了传播能力的病毒与 Omicron 和 Alpha 这种能在全球暴发的病毒又是两回事。Rambaut 说,传播力增强或是能感染已经免疫的人群,这或许是让一个 VOC 变得危险的关键。“不是所有慢性感染都会产生 VOC。这个概率大概为百万分之一。”
将长期感染者隔离起来的做法,也许并无法切断需关注变异株的新来源。图片来源:Unsplash
也就是说,监测行动可能没法在变异株一出现时就立即发现它。在 5 月发布的一篇预印本论文中,研究人员在一名免疫功能低下患者的慢性感染中,发现了一个获得了其他刺突蛋白突变的 Omicron 株,并且有迹象表明它已经在医院里和当地社区发生传播[10]。不过,这类传播似乎很少进一步扩大。2 月发布的一项针对 27 名慢性感染者的研究发现,没有证据表明他们中的任何人已经将病毒传给了其他人[11]。领导该研究的特拉维夫大学演化病毒学家 Adi Stern 说,如果慢性感染产生 VOC 的情况少之有少,我们就很难在不降低全球感染率的同时防止 VOC 的出现。
话虽如此,目前还是亟需理解引发慢性感染的病毒因素。Sigal 说:“我们不能只研究病例报告,而是要搞清楚这个病毒在这段时间里发生了哪些变化。”
Sigal 和他的团队正在通过追踪艾滋病晚期患者,寻找与新冠病毒慢性感染有关的因素,这些患者中有的人免疫系统严重受损。艾滋病病毒(HIV)会感染名为 CD4+ T 的免疫细胞,该细胞也能帮助产生针对新冠病毒这类病毒的抗体。在一篇尚未发表的论文中,Sigal 和他的同事发现,CD4+ T 细胞水平低与新冠病毒慢性感染风险有关,而且许多病例都为轻症,很少出现甚至没有呼吸道症状。
Otto 说,全球的 HIV 携带者将近有 4000 万,加上世界上大部分人可能已经感染过新冠病毒,一些长时间不痊愈的感染者确实有“孕育”新变异株的可能。“根据奥卡姆剃刀原理,我们知道这就是一个来源。”
免疫系统低下人群并不是变异株的唯一潜在来源。研究人员已经报道过发生在免疫系统健康人群中的持续数周的新冠感染。Martin 说,从自然选择的角度看,与一周的急性感染期相比,即使是相对较短的三周感染,也能让新冠病毒的演化机会呈指数级增长。
Hill 说,相比免疫应答受损的人,免疫系统相对健康的人可能会给病毒更多选择压力。但是,如何找出容易出现这类感染的人,以及他们会有哪些症状,仍有待研究。Hill 说:“我猜想这些人比我们想象的要多得多。”
去年,巴西 Oswaldo Cruz 研究所的病毒学家 Gonzalo Bello 和同事鉴定出多个在巴西亚马逊州传播的新冠病毒株[12]。这些毒株携带了 Gamma 变异株的部分但非全部突变——Gamma 变异株 2021 年曾在该地掀起了第二轮严重疫情。但这些 Gamma 样的变异株也有属于它们自己的独特突变:Bello 说,这些证据表明 Gamma 可能不是来自某一次慢性感染,而是来自涉及相对健康人群、感染时间中等的传播链。
Bello 表示,这类传播链可能是 Omicron 谱系如此多样化的由来。他说:“也许 VOC 起源的一些步骤就发生在这些个体中。”如果出现在健康人群中的慢性感染是 VOC 的一个可能来源,提高全球疫苗接种率或能预防新的 VOC,Hill 说,“放任大规模感染等于是在播种下一个 VOC。”
慢性感染期间服用的抗病毒药物和其他药物也可能左右着病毒的演化。科学家留意的一个特性是对新冠药物的耐药性,这些药物包括 Paxlovid(奈玛特韦-利托那韦)和 molnupiravir。(慢性感染患者对抗病毒药物瑞德西韦的耐药性已有记录[13]。)这些药物能影响高度保守的病毒蛋白——因而耐药壁垒很高——但能在慢性感染中实现演化飞跃的病毒有充足时间找到应对办法,Gupta 说。
纽约哥伦比亚大学病毒学家 David Ho 领导的一支团队在尚未发表的实验室研究中发现,新冠病毒有无数种对 Paxlovid 耐药的策略。一些策略需要病毒获得补偿性突变,弥补对 Paxlovid 耐药的代价,让它们至少能在实验室存活下去。这种突变不太可能是我们听说有人在使用 Paxlovid 后仍反复出现新冠症状的原因,(本人经历过这种复发的)Ho 说。但如果这种通常服用五天的药物为了治疗慢性感染而延长用药时间,那么耐药性出现的几率就很大了。
目前还需尽快找到治疗慢性感染的有效方法——尤其是针对免疫系统受损的人群,这些人有时候无法对疫苗产生很强的应答。大部分获批的单克隆抗体药物对 Omicron 及其亚型不够有效,研究人员已经在预印本论文中表明,将这些药物用于治疗慢性感染时,有时候会出现耐药性[14]。
照理说,康复期血浆能比单克隆抗体药物创造一个更高的演化壁垒,美国约翰斯·霍普金斯大学布隆博格公共卫生学院微生物学家 Arturo Casadevall 说。含有大量不同抗体的血浆被证明能有效治疗 COVID-19,一些医生正在让免疫系统低下患者使用这种血浆[15]。
针对 HIV 的抗逆转录病毒药物也能帮助 HIV 携带者清除体内的新冠病毒慢性感染,但对这种药物的依从性是个挑战,Sigal 说。
去年 10 月,英国的临床医生报道了一个病例,一名患者的慢性感染在接种新冠疫苗后突然消失了[16]。对于 Sonnleitner 和同事研究的那名奥地利女性来说,长达 7 个月的感染也在接种疫苗后结束了。但我们几乎不可能知道是否是疫苗帮助她痊愈的。
不过,这种情况在慢性感染患者中非常罕见,这类患者中有许多人都没能活下去。Stern 说:“他们的结局令人心痛。”随着世界上许多地区开始走出新冠疫情,一些健康人士更是对 Omicron 的“轻症”感染毫不在乎,Stern 对此表示,我们必须采取更多行动来保护那些最容易出现新冠慢性感染的人。“这种感染对他们来说是危险的,对我们整个社会来说也是严重的。”
参考文献:
1. Sonnleitner, S. T. et al. Nature Commun.13, 2560 (2022).
2. Martin, M. A. & Koelle, K. Sci. Transl. Med. 13, eabh1803 (2021).
3. Wilkinson, S. A. J. et al. Preprint at medRxiv https://doi.org/10.1101/2022.03.02.22271697 (2022).
4. Kemp, S. A. et al. Nature 592, 277–282 (2021).
5. Choi, B. et al. N. Engl. J. Med. 383, 2291–2293 (2020).
6. Tian, F. et al. eLife 10, e69091 (2021).
7. Hill, V. et al. Preprint at bioRxiv https://doi.org/10.1101/2022.03.08.481609 (2022).
8. Martin, D. P. et al. Mol. Biol. Evol.39, msac061 (2022).
9. Meng, B. et al. Nature 603, 706–714 (2022).
10. Gonzalez-Reiche, A. S. Preprint at medRxiv https://doi.org/10.1101/2022.05.25.22275533 (2022).
11. Harari, S. et al. Preprint at medRxiv https://doi.org/10.1101/2022.02.17.22270829 (2022).
12.Graf, T. et al. Virus Evol. 7, veab091 (2021).
13. Gandhi, S. et al. Nature Commun. 13, 1547 (2022).
14. Huygens, S. et al. Preprint at medRxiv https://doi.org/10.1101/2022.04.06.22273503 (2022).
15. Rodionov, R. N. et al. Lancet Microbe2, E138 (2021).
16. Bradley, R. E. et al. J. Clin. Immunol. 42, 32–35 (2022).
原文以How months-long COVID infections could seed dangerous new variants为标题发表在2022年6月15日《自然》的自然特写版块上
版权声明:
本文由施普林格·自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转发至朋友圈,如需转载,请邮件[email protected]。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


