Nature:最大规模结直肠癌多组学研究结果公布
时间:2024-09-23 06:00:52 热度:37.1℃ 作者:网络
结直肠癌发病率居所有癌症第三位,约20%的患者在确诊时已经发生转移,死亡率高居各类癌症第二位。该研究对瑞典知名癌症样本数据库U-CAN队列中的1063例结直肠癌样本进行全基因组和转录组测序分析,发现了一系列与癌症不同阶段相关的驱动基因,并识别了关键预后因子。
准确的疾病分类能够帮助医生对病人的病情、治疗手段以及预后(即预估治疗结果)进行快速和有效的判断。疾病分类的基础是致病机制,而在以前,分类往往是通过症状、病灶形态等表面现象进行的。现在,随着组学技术的发展,科学家能够深入基因,追本溯源,对疾病进行更为精准的分类,为诊疗作出贡献。
近日,一项研究通过全球最大规模的结直肠癌多组学数据分析,发现了多个与该疾病相关的关键基因,并在此基础上重构了结直肠癌类型学。该研究于2024年8月7日发表在《自然》(Nature)杂志上,作者是来自瑞典乌普萨拉大学、华大生命科学研究院以及华大基因智慧医学研究院的Tobias Sjöblom、林从、李甫强等多名研究者组成的团队。
本研究使用的UCAN队列,是Uppsala University联合Umeå University、Stockholm university、Kungliga Tekniska Högskolan (KTH) 等研究团队于2010年启动建设的,截至2023年底,已经采集了27,476名癌症患者的样本、影像及临床数据,该队列对患者每年定期随访,近20%的患者随访超过10年,75%以上的患者随访超过5年。其中结直肠癌患者占比很高,为大规模研究提供了很好的基础。
首先,研究者从 1,126 例 CRC 病例中的 1,063 例中获得了高质量的全基因组序列(平均覆盖率为 53 倍),以及肿瘤转录组序列(平均 3000 万个配对读数;补充表 1)。在 1,063 例 CRC 中,943 例为原发性肿瘤手术标本,120 例为原发性肿瘤活检标本。522 例的对照样本取自外周血,541 例的对照样本取自邻近组织。在所有患者中,126 例(12%)在手术获取肿瘤标本之前已接受过预处理,其中 92 例样本为手术前接受过放化疗或放疗的直肠癌。
总共鉴定出 96 个突变驱动基因,其中 1,056 个 (99%) 肿瘤至少有一个基因发生体细胞突变 (图 1a)。根据总突变计数,242 个 (23%) 肿瘤为高突变 (HM),每兆碱基突变数 >23.16 (图 1b 和补充表 4)。与非高突变 (nHM) 病例相比,HM 病例年龄较大 (中位年龄 76 岁对 71 岁),女性患者更多,并且右侧、粘液性、高级别 (低分化或未分化) 和 II 期肿瘤更多见14 (补充表 5)。223 名 (21%) 患者符合 MSI 标准 (MSIsensor 评分 ≥ 3.5;方法),其中仅 2 名是 nHM。该基于人群的队列代表了瑞典的 CRC 患者(补充表 6),与 MSI 患病率较低的年轻、健康患者队列形成对比15。总共有 15 个 HM 肿瘤是具有 POLE 或其他 DNA 损伤修复基因突变的 MSS(图 1c),6 个是具有高非编码肿瘤突变负担 (TMB) 但没有修复基因突变的 MSS。HM MSS 肿瘤中的修复基因突变并非都是驱动因素;因此,它可能无法完全解释它们的高 TMB。对三组(HM、nHM 和整个肿瘤队列)的分析确定了 96 个独特的驱动基因,以及 13 个额外的亚型特异性驱动基因(补充表 3)。在 HM 肿瘤中,超过 20% 病例发生突变的基因属于 TGFβ–BMP、WNT、RTK–RAS、核糖体蛋白、表观遗传调控、PI3K、SCF 复合物、p53 和免疫系统途径,最常见的复发突变是 ACVR2A(p.K437Rfs*5;78%)、BRAF(p.V600E;65%)和 RNF43(p.G659Vfs*41;57%)。相应地,WNT、p53、RTK-RAS、PI3K、SCF 复合物和 TGFβ 通路在超过 10% 的 nHM 肿瘤中发生基因突变(图 1a 和补充表 3)。nHM 肿瘤中最常见的热点突变是 KRAS p.G12D(15%)和 p.G12V(11%)。
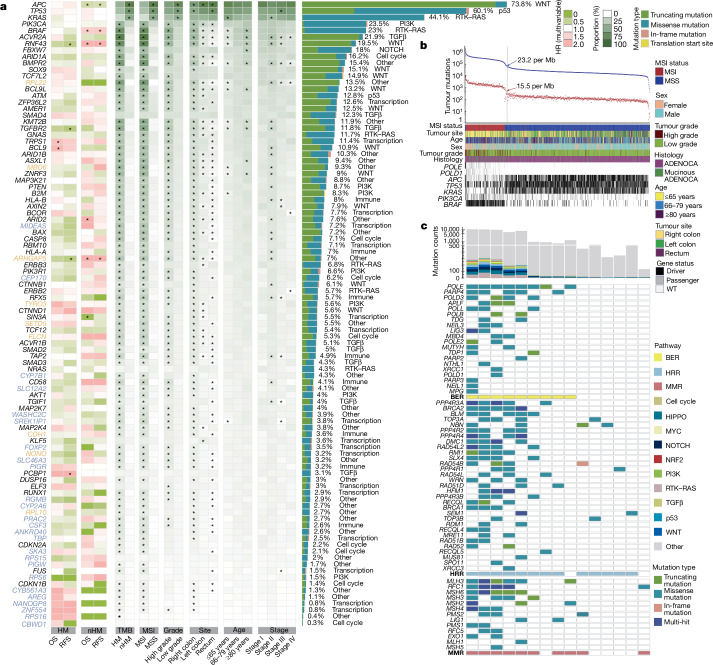
图1 Somatic mutation analysis of 1,063 CRC genomes identifies 96 driver genes.
在 96 个驱动基因中,有 24 个基因之前未被指定为任何癌症的驱动基因16,17,它们与 BMP(RGMB)和 EGFR(AREG)信号传导、细胞周期(CEP170 和 SKA3)、免疫系统(PIGR 和 CSF3)、离子转运(SLC12A2 和 CYB561A3)、代谢(PIGW、CYP2A6 和 CYP7B1)、mRNA 剪接(SREK1IP1)、蛋白质转运(WASHC2C 和 SLC46A3)、转录调控(FOXP2、NANOGP8、TBP 和 ZNF554)、核糖体蛋白(RPS15、RPS16 和 RPS6)和其他途径(CBWD1、PRAC2 和 ANKRD40)有关。 CRC3–5,8,10,11,18–21 中以前未观察到的 9 个驱动因素与免疫系统 (CDH1)、组蛋白修饰 (SETD5)、转录调节剂 (MIDEAS 和 NONO)、PI3K 信号传导 (TYRO3)、细胞反应 (FLCN)、核糖体蛋白 (RPL10 和 RPL22) 和 UCH 蛋白酶 (MBD6) 相关。
进一步从96个驱动基因中,鉴定出RTK–WNT 通路共突变的两种不同模式(1) KRAS、APC 和 AMER1,以及 (2) BRAF 和 RNF43。

图:Mutually exclusive and co-occurring gene mutations in the 96 colorectal cancer driver genes displayed by hypermutation status.
最终,基于肿瘤基因表达差异,研究者们将结直肠癌预后分为了包含5个预后亚型的类型系统CRPS(CRC Prognostic Subtypes,结直肠癌预后分型)。与经典的结直肠癌分型CMS(Consensus Molecular Subtypes,共识分子分型)相比,该分类能够更加准确地预测预后。
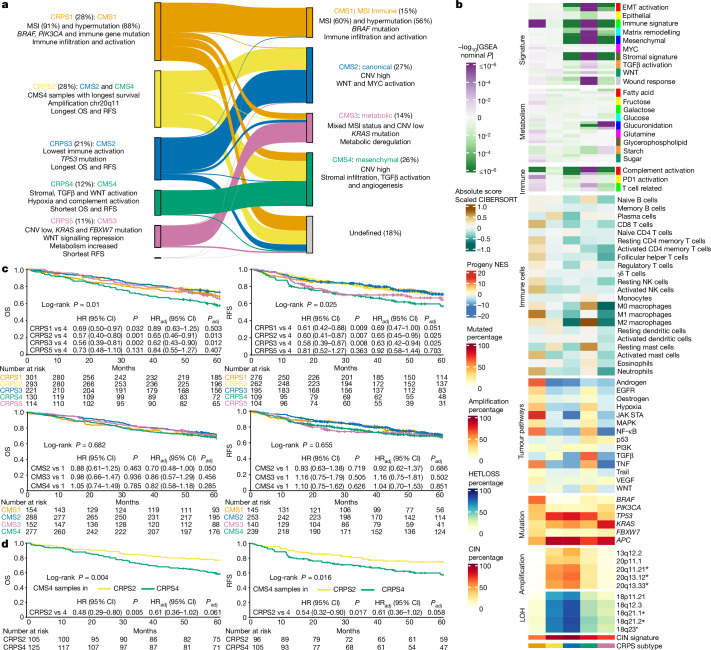
图:
Refined prognostic subtypes derived from 1,063 CRC transcriptomes.从肿瘤转录组数据的无监督分类中获得的五种不同 CRPS 的特征。a、对同一数据集的 CRPS 与 CMS 进行比较。分配给每种亚型的样本比例显示为肿瘤总数的百分比。标出了每个 CRPS 和 CMS 亚组的主要分子和临床特征。b、根据 CRPS 分类的 1,063 个样本的转录组特征。在 CRPS 中发生差异改变的预后局灶性 CNV 细胞带用星号表示(P < 0.05,nHM 肿瘤中的多变量 Cox 回归)。c、CRPS(顶部)和 CMS(底部)组总体(I-IV 期)和无复发(I-III 期)生存率的 Kaplan-Meier 生存曲线(对数秩检验)。 d、分配给 CRPS2 的 CMS4 样本和分配给 CRPS4 组的 CMS4 样本的 Kaplan-Meier 生存曲线(对数秩检验)。使用多变量 Cox 回归计算调整后的 HR(HRadj)和 P 值(Padj)或 HR 和 P 值(可调整或不调整肿瘤分期)。CIN,染色体不稳定性。


