小细胞肺癌也可能遗传,胚系基因检测有意义!
时间:2024-09-22 20:00:24 热度:37.1℃ 作者:网络
过去,人们认为小细胞肺癌 (SCLC) 是由吸烟等有毒暴露因素引起的。最近的证据表明,胚系变异也可能影响 SCLC 的发生,然而,这些变异仍未得到充分研究。本研究试图在我们的 SCLC 患者群体中识别新的胚系变异,包括胚系拷贝数变异 (CNV)。我们设计了一个定制的杂交捕获基因 panel,分析 192 个癌症易感基因和 SCLC 中常见突变基因的胚系变异。将该 panel 应用于我们机构中 67 名未接受治疗的 SCLC 患者的胚系检测。随后,使用美国医学遗传学学会 (ACMG) 标准注释了这些变异,并使用一组计算机工具(包括 DeepMind AlphaMissense、MutationTaster、SIFT 和 Polyphen2)进一步对意义不明的变异 (VUS) 进行分类。在 7/67 名患者中发现了 ACMG 致病/可能致病变异。5 个(71%)是新型突变(BCORL1、FANCC、ATR 和 BBC3)和新型 CNV(SLFN11),2 个(29%)是之前描述过的突变(CHEK1 和 BRIP1)。还在 60/67 名患者中发现了 191 个 VUS,根据计算机工具,其中 5-14% 被预测为致病。与其余队列相比,具有 7 种致病变异的 SCLC 患者的 OS(HR = 0.50)和 PFS(HR = 0.45)在数值上更长,但未达到统计学显著性。本研究发现了新的胚系变异,包括 CNV,提供了额外的证据表明胚系因素可能是 SCLC 发生的重要促成因素。
研究背景
小细胞肺癌 (SCLC) 是一种侵袭性癌症,与吸烟有关。分子学上,SCLC 肿瘤的特征是 TP53 和 RB1 缺失,当胚系突变时,这两者与癌症风险增加有关。2021 年的一项开创性研究发现,80 名 SCLC 患者中有 38 名存在胚系突变,包括 BRCA1、BRCA2、MUTYH 和 TP53。这些发现挑战了 SCLC 主要是吸烟导致的观点,并提出了有关 SCLC 致癌过程中胚系变异的问题。虽然这项研究有可能彻底改变我们对诱发因素的了解,但 SCLC 的胚系图谱仍未得到充分研究。胚系拷贝数变异 (CNV),尤其是癌症易感基因,如 BRCA1、BRCA2、APC 和错配修复基因,与许多癌症有关,但在 SCLC 中尚未发现。
本研究旨在识别可能促成 SCLC 发生的胚系变异。通过分析已知癌症易感基因和 SCLC 中常见突变基因,我们识别了具有新型致病胚系变异的患者,包括涉及 DNA 损伤修复基因 SLFN11 的新型 CNV。
研究结果
患者人口统计学特征
加拿大多伦多玛格丽特公主癌症中心纳入了 67 名 SCLC 患者。所有患者在检测时均未接受过治疗。平均年龄为 68 岁,64% 为男性,89% 为当前或先前吸烟者,58% 为广泛期。63% 的患者自述有癌症家族史,其中 13 人报告有肺癌家族史,11 人报告有乳腺癌家族史。16% 的患者自述有个人癌症史。自述的种族如下:13% 选择不自述,65% 为白种人,6% 为东亚人,6% 为东南亚人,5% 为黑人,3% 为拉丁美洲人,2% 为中东人。
识别的胚系变异
在去除已知的良性/可能良性变异后,我们识别了 218 个感兴趣的高置信度变异(图 1A)。使用 ACMG 标准来解读高置信度胚系变异,在 7 名患者(10%)中识别出表 2 中的致病/可能致病的胚系变异,在所有 67 名患者中识别了 191 个意义不明的变异(VUS)。ACMG 致病和可能致病的变异包括 CHEK1、BCORL1、FANCC、BRIP1、ATR 和 BBC3 突变(图 1B,表 2)。除了 SNV 和插入缺失之外,我们还发现了新型 SLFN11 外显子 4-6 缺失。
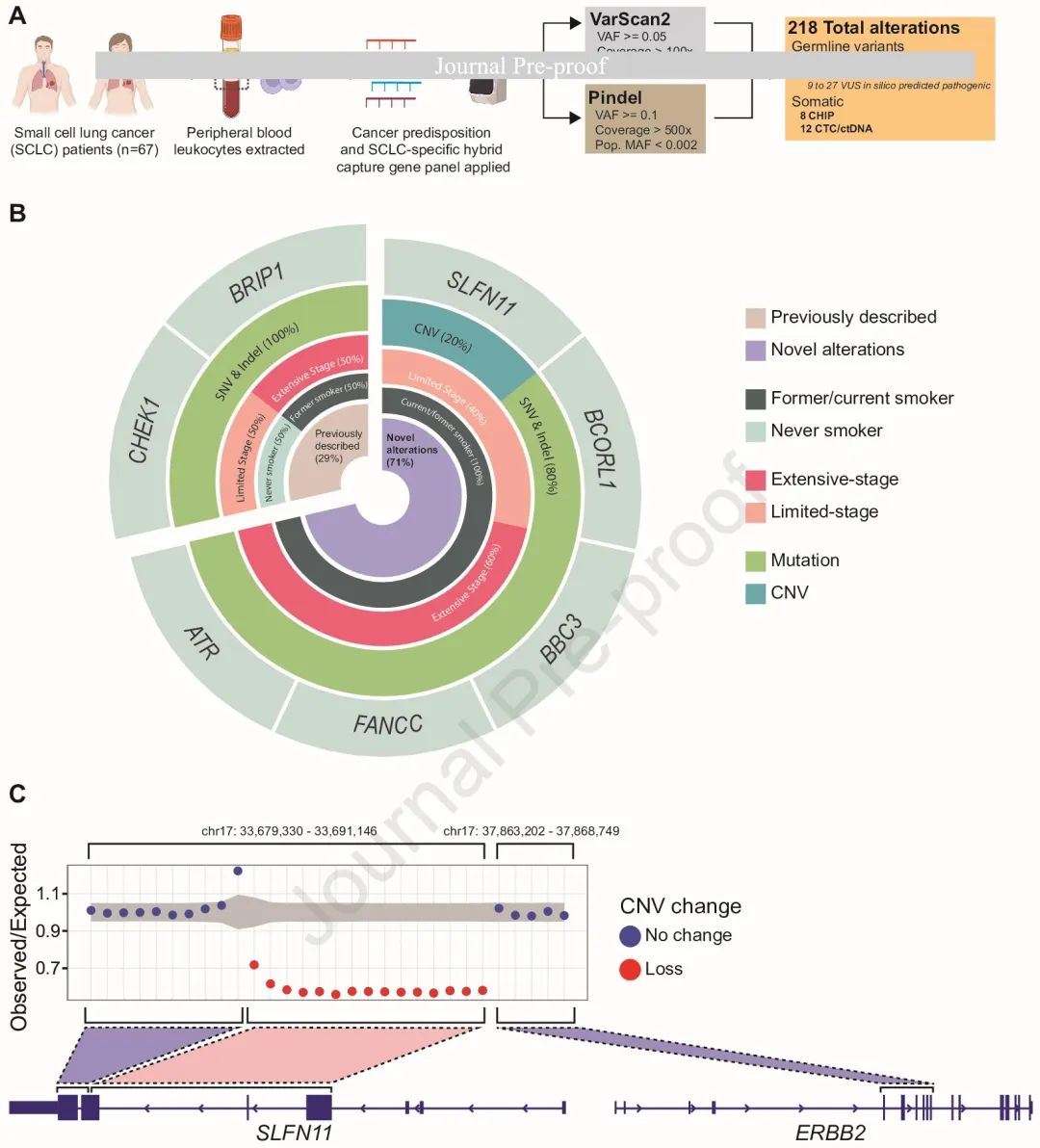

图1
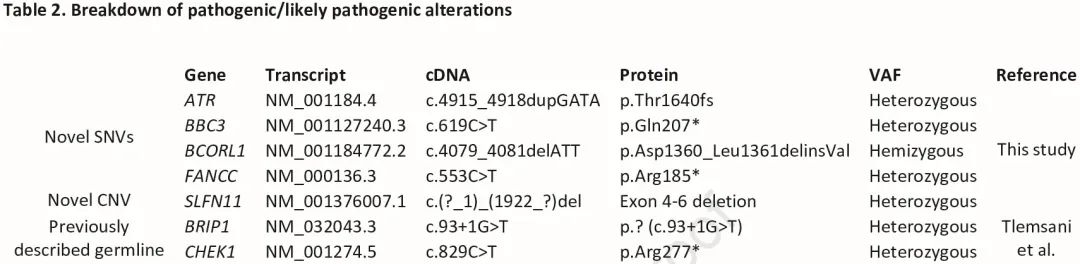
表2
诊断时有致病变异的患者中位年龄为 62 岁(IQR:58.979.3),无致病变异的患者中位年龄为 68 岁(IQR:60.8-75.5)(表 1)。在有致病/可能致病变异的患者中,6/7 为男性,6/7 为前吸烟者或现吸烟者,4/7 为广泛期,3/7 为局限期,6/7 为白种人,1/7 为黑人。2名患者有母系和父系癌症病史。与队列中的其他患者相比,具有致病突变的患者吸烟史更长(中位 65 包年 [IQR 59.2-77.5] vs 中位 40 包年 [IQR 30.0-50.0]),有癌症家族史的比例更高(5/7 [71%] vs 37/60 [62%])。
虽然我们的样本量小,但我们观察到,具有致病/可能致病变异的患者 OS(HR = 0.50)和 PFS(HR = 0.45)在数值上更长,但未达到统计学显著性。
大多数临床变量,包括年龄、性别、种族、吸烟状况或癌症家族史,在检测到或未检测到致病变异的患者之间没有显著差异(表 1)。关于癌症家族史,我们进一步将分析范围限制在一级亲属,但仍然不显著。值得注意的是,我们观察到吸烟包年数存在显著差异(p=0.013)。然而,生物学相关性尚不清楚,因为吸烟包年数不太可能影响胚系变异,并且总体上所有患者的包年数都较高(中位数=40,IQR 30-59)。最后,我们不能排除这种观察结果仅仅是偶然的可能性。
为了了解 191 个 VUS 的潜在临床意义,我们使用了一组计算机工具。14% 的 VUS(27/191)一致预测为有损害/致病作用,13% 的 VUS(25/191)一致预测为良性。我们单独应用了 2023 Deepmind AlphaMissense AI 模型目录,与传统的计算机工具不同,它结合了额外的数据,包括结构背景、人群突变频率数据和预测的蛋白质折叠背景。AlphaMissense 预测 9% 的 VUS(17/191)是致病的。同时使用 AlphaMissense 和其他计算机工具时,预测所有 VUS 中有 5%(9/191)是致病的。
其他发现包括胚系 MAP4K3 CNV 重复,但由于整个基因区域都是重复的,不清楚其临床遗传意义。20 个变异丰度较低,可能是体细胞突变的结果。具体而言,这些变异丰度为 0.05 到 0.24,未在其他队列样本中观察到以排除可能的人为错误。一些变异通常与潜能不明克隆性造血 (CHIP) 相关,例如 TP53、GNAS、STAG、TET2 和 MGA。其余基因,例如 BCLAF1、MED12、BRCA1、PCLG2、PRKDC 和 FLT1,可能来自体细胞组织,因为变异丰度 (VAF) 高于 CHIP 基因,可能是由白细胞层中存在的循环肿瘤细胞/细胞游离 DNA 导致的。
讨 论
本研究证实了 SCLC 患者中几种癌症易感基因胚系变异,发现大约 10% 的患者携带 ACMG 致病/可能致病的胚系变异。
据我们所知,本研究首次探索了 SCLC 中的胚系 CNV,补充了之前报告的肿瘤 DNA 而非胚系 DNA 的 CNV 分析。具体而言,我们识别了一个新的胚系 CNV —— SLFN11 外显子 4-6 缺失。该缺失已在健康/非癌症个体的基因变异数据库中报告,但频率较低(0.55%)。SLFN11 与 DNA 复制应激反应有关,我们推测了胚系 SLFN11 CNV是否会增加个体患 SCLC 的风险。需要进行其他研究来评估该缺失的功能影响,例如对肿瘤组织中的 SLFN11 蛋白进行免疫组织化学分析。不幸的是,本研究中该患者的肿瘤样本中剩余的材料不足以进行进一步检测。
7名具有致病/可能致病变异的患者的 OS 和 PFS 在数值上更长。但是,由于样本量,我们的统计分析结果不够有力,应谨慎解读。大多数具有致病变异的患者都是吸烟者,2名患者有母系(乳腺癌、肺癌)和父系癌症病史(白血病、骨癌)。这些患者携带 FANCC(与遗传性癌症有关)和 BBC3 突变。
有趣的是,BBC3 在细胞凋亡中很重要,并且与头颈部鳞状细胞癌有关,其表达与肿瘤大小和淋巴结受累相关。在较大的肿瘤中,BBC3 表达下调,提示其在肿瘤抑制中发挥作用。这些肿瘤相关发现是否具有胚系意义值得进一步研究。
关于种族,大多数 ACMG 致病突变或 VUS 突变是在白人患者中检测到的(6/7),这可能是因为 gnomeAD 中白人参考样本占比很高(77%)。相比之下,东亚、南亚或中东种族样本在 gnomeAD 中占比很低(<5%)。因此,在我们 35% 的非白人群体中可能存在未被发现的致病变异,这凸显了在基因组研究中增加种族多样性的需要。
我们验证了既往识别的致病变异,包括 CHEK1 和 BRIP14。还识别了 191 个 VUS,使用一组计算机工具(如 2023 DeepMind AlphaMissense AI 模型),其中 5-14% 被预测为致病变异。此外,识别了通常与 CHIP 有关的基因以及 TP53 和 BRCA1 体细胞突变。有趣的是,发现了 PLCG2 体细胞突变,其与 SCLC 较差生存和免疫抑制表型有关。
本研究有几个局限性。我们的样本量仅限于 67 人,我们的panel只分析 192 个基因的蛋白质编码区。有时,外周血中的体细胞变异可能难以与胚系变异区分开来。在本研究中,我们通过使用严格的过滤标准解决了这一限制,包括使用 VAF 过滤掉伪影,以及使用已知数据库定性排除 CHIP/肿瘤突变。然而,尽管存在这些限制,这些数据提供了重要的新证据,表明遗传因素可能会增加个人患 SCLC 的风险,而不仅仅是公认的环境因素。
目前,没有关于 SCLC 患者进行胚系检测的临床指导。本研究结果支持,在 SCLC 患者中胚系突变检测的诊断率为 10%。许多患者报告有癌症家族史,有和无致病/可能致病变异的患者分别有5/7 (71%) 和37/60 (63%) 报告有癌症家族史。我们的结果表明,应进一步研究有癌症家族史的 SCLC 患者的胚系检测。
总之,我们在 SCLC 患者中发现了几种新的胚系变异(突变和 CNV)。此外,计算机预测模型进一步对潜在高风险 VUS 进行了分类。本研究结果提示,非环境遗传因素也可能影响 SCLC 肿瘤发生的风险。最后,本研究对 SCLC 的潜在管理具有意义。未来的方向可能包括确定 SCLC 患者的胚系发现是否有助于筛查患者的高风险家庭成员。此外,SCLC 患者的胚系发现(DNA 损伤反应基因变异)可能强调对 DNA 修复抑制剂和其他 DNA 靶向疗法的敏感性。
参考文献:
Sami Ul Haq, Gregory Downs, Luna Jia Zhan, Sabine Schmid, Devalben Patel, Danielle Sacdalan, Janice J.N. Li, Dangxiao Cheng, Nicolas Meti, Vivek Philip, Raymond H. Kim, Geoffrey Liu, Scott V. Bratman, Peter J.B. Sabatini, Benjamin H. Lok, Brief Report: Identifying novel germline mutations and copy number variations in patients with small cell lung cancer., JTO Clinical and Research Reports, 2024, 100702, ISSN 2666-3643, https://doi.org/10.1016/j.jtocrr.2024.100702.



