Cancer Res:中国医学科学院张太平团队揭示了FBXO32刺激蛋白合成驱动胰腺癌进展和转移
时间:2024-08-27 19:00:19 热度:37.1℃ 作者:网络
胰腺导管腺癌(PDAC)是全球癌症相关死亡的主要原因之一,主要由于其快速进展。当前PDAC的治疗选择有限,需要更好地了解PDAC进展的潜在机制,以确定改进的治疗策略。
2024年8月15日,中国医学科学院张太平团队讯在Cancer Research在线发表题为“FBXO32 Stimulates Protein Synthesis to Drive Pancreatic Cancer Progression and Metastasis”的研究论文。该研究发现FBXO32是PDAC的致癌驱动因子。FBXO32在PDAC中异常上调,高水平的FBXO32表达与PDAC患者不良预后显著相关。
FRG1缺乏促进了PDAC中FBXO32的上调。FBXO32在体外促进细胞迁移和侵袭,在体内促进肿瘤生长和转移。机制上,FBXO32直接与eEF1A1相互作用,并促进其在K273位点的多泛素化,从而增强eEF1A1的活性并增加PDAC细胞中的蛋白质合成。此外,FBXO32催化的eEF1A1泛素化增强了ITGB5 mRNA的翻译,并激活了焦点粘附激酶(FAK)信号通路,从而促进了焦点粘附的组装并推动PDAC的进展。重要的是,干扰FBXO32–eEF1A1轴或使用FDA批准的FAK抑制剂defactinib进行药物抑制,显著抑制了由异常激活的FBXO32–eEF1A1信号驱动的PDAC生长和转移。总体而言,这项研究揭示了PDAC细胞如何依赖FBXO32介导的eEF1A1激活来推动进展和转移。FBXO32可能成为选择适合使用defactinib治疗的PDAC患者的有前景的生物标志物。

胰腺导管腺癌(PDAC)是胰腺癌的最常见组织病理类型,预计将成为美国癌症相关死亡的第二大原因。对于胰腺癌患者,手术切除结合辅助化疗是唯一可能实现长期生存或治愈的治疗方案。然而,约80%的患者在初次诊断时就已表现为局部晚期或转移性疾病,因此无法进行手术切除。目前PDAC的治疗标准有限,主要是因为对PDAC进展的潜在机制了解不够。
泛素化是最普遍的蛋白质翻译后修饰(PTM)之一,在肿瘤发生中发挥着关键作用,通过控制各种蛋白质的数量和质量来影响肿瘤的进展。最具代表性的E3泛素连接酶之一是S期激酶相关蛋白1(SKP1)–cullin 1(CUL1)–F-box蛋白(SCF)复合体,这些复合体利用一类F-box蛋白作为底物结合亚单位。FBXO32,也称为肌肉萎缩F-box蛋白(MAFbx)或atrogin-1,早在二十多年前被鉴定为一种肌肉特异性E3连接酶。近期研究揭示了FBXO32在肿瘤发生中的多重作用。重要的是,FBXO32通过为乳腺癌中的上皮–间质转化进程创建适宜环境来促进转移。然而,FBXO32在PDAC进展中的病理功能和机制仍未明了。
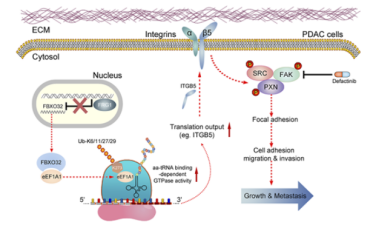
模式机理图(图片源自Cancer Research)
焦点粘附(FA)是细胞与细胞外基质(ECM)相互作用的主要形式,是一个重要的信号传导中心,将细胞内或细胞外刺激整合以控制细胞的生存、增殖、形态、分化和运动。FA复合体的组装由整合素介导的粘附于ECM蛋白(如胶原蛋白或纤维连接蛋白(FN))开始,随后招募多种信号分子,包括焦点粘附激酶(FAK)、SRC和paxillin(PXN),并随之发生细胞骨架重塑。大量证据已强调FA动态在促进肿瘤细胞生长、侵袭和转移中的重要作用。然而,尚不清楚在PDAC中如何通过泛素–蛋白酶体系统的基因调节FA组装。
在本研究中,E3泛素连接酶FBXO32在PDAC组织中异常高表达,并且FBXO32的升高表达与PDAC患者的不良预后显著相关。功能获得或丧失实验表明FBXO32促进了PDAC的生长和转移。进一步的实验验证了FBXO32直接与eEF1A1相互作用,并促进其在K273位点的多泛素化,从而在aa-tRNA刺激下增强eEF1A1的GTP酶活性,并增加PDAC细胞中的蛋白质合成。此外,FBXO32催化的eEF1A1泛素化增强了ITGB5 mRNA的翻译,并激活了下游的FAK/SRC/PXN信号通路,从而促进了焦点粘附的组装,最终推动了PDAC的进展。总之,作者的研究揭示了FBXO32驱动PDAC进展的潜在机制,并提出了一种新型的治疗策略用于治疗PDAC患者。
参考消息:
https://doi.org/10.1158/0008-5472.CAN-23-3638


