论著|视觉诱发电位评估帕金森病视幻觉视觉传导通路临床价值
时间:2024-08-26 23:01:53 热度:37.1℃ 作者:网络
摘 要
目的 本研究旨在通过视觉诱发电位(visual evoked potential,VEP)评估帕金森病(Parkinson disease,PD)患者的视觉传导通路完整性,特别是那些伴有视幻觉的患者。
方法 共纳入76例PD患者,根据是否伴有视幻觉分为两组:伴有视幻觉组24例,无视幻觉组52例。为控制变量,同时选取22例性别和年龄匹配的健康对照组。所有受试者接受VEP检测,并针对PD患者进行了统一帕金森病评分量表(UPDRS)、Hoehn&Yahr分期(H-Y分期)和简易智能精神状态检查量表(MMSE)评估。
结果 伴有视幻觉的PD患者N75、P100、N135潜伏期(88.26±10.47)ms 、(118.48±8.53)ms、(144.71±9.48)ms较无视幻觉组(79.00±6.96)ms、(108.60±7.01)ms、(135.95±8.21)ms显著延长(P均<0.001),而N75-P100、N135-P100峰峰波幅 [4.35(2.73, 7.30)μV]、[6.40(4.15 , 9.90 )μV]则较无视幻觉组[7.10(5.28, 9.98 )μV]、[9.05(6.30 , 12.60 )μV]显著降低,差异有统计学意义(P<0.001,P =0.037)。相关性分析发现,PD视幻觉组中P100潜伏期与H-Y分期及UPDRS-I、UPDRS-II、UPDRS-III总分呈正相关(r=0.537,P=0.007;r= 0.635,P=0.001;r=0.594,P=0.004;r=0.558,P=0.005)。
结论 视幻觉组PD患者的视觉传导通路完整性受损,且随着疾病进展,视觉传导通路可能遭受进一步破坏,影响可能扩展至上行通路以外的脑区。
关键词
帕金森病;视幻觉;视觉诱发电位;视觉传导通路;上行通路
帕金森病(Parkinson disease,PD)是一种常见的神经退行性疾病,除了典型的运动症状以外还伴有许多非运动症状。视觉功能障碍是其中常见的一种,包括视敏度下降,色觉减弱、高级视觉功能受损等[1]。30%~70%帕金森病患者伴有视幻觉(visual hallucinations,VH)的发生[2],其表现形式也因病程不同而有所差异,早期主要表现为通过性幻觉(感觉视野中有物体经过)和错觉(对真实视觉刺激的错误或扭曲感知),随着疾病的进展,复杂性视幻觉变得常见,幻觉的主体可以是人、动物或者其他物体[3]。视幻觉的发生往往预示着预后不佳,但是其发生的具体机制仍不清楚,可能与视觉形成的上下行通路有关[4-5]。视觉诱发电位(visual evoked potential,VEP)是神经内科中常用的一种检查手段,主要反映了来源于视野中央3°~6°视觉刺激在大脑枕叶视觉皮质产生的电信号,并通过头皮电极进行采集和分析,可以在一定程度上反映视觉形成上行通路的完整性。本研究通过对伴有视幻觉的帕金森病患者进行视觉诱发电位的检测,以探讨视觉传导通路在帕金森病患者出现视幻觉中的作用。
1 对象与方法
1.1 研究对象 回顾性队列研究,纳入2019年6月至2022年3月在苏州大学附属第二医院门诊或住院诊断为PD患者76例。纳入标准:① PD患者均符合《中国帕金森病的诊断标准》[6]。②PD患者均进行了视觉诱发电位检测。排除标准:①继发性帕金森综合征和帕金森叠加综合征;②青光眼及其他眼部疾病的患者;③痴呆及其他不能配合检查者;④合并严重肝肾等疾病的患者;⑤资料不全的患者。将有视幻觉且近1个月内至少有一次视幻觉发作的PD患者归入PD伴有视幻觉组(PD-VH组),将不伴视幻觉的PD患者归入PD无视幻觉组(PD-NVH组),并选取同时期年龄、性别匹配的健康体检者作为健康对照组(Control组)。本研究经苏州大学附属第二医院伦理委员会批准(批文号:JD-LK-2018-061-01)。
所有受试者完善年龄、性别、受教育程度等一般人口统计学资料。帕金森病患者均由经过专门培训的神经内科医师在“开”期进行评估,统一帕金森病评分量表(unified parkinson’s disease rating scale,UPDRS)、Hoehn&Yahr分期(H-Y分期)用于疾病严重程度的评估及疾病的分期;简易智能精神状态检查量表(mini-mental state examination, MMSE)用于评估患者的认知功能状态。
1.2 视觉诱发电位检测方法 采用丹麦维迪Keypoint 6通道肌电图仪进行棋盘格模式翻转视觉诱发电位检测。受试者在黑暗、安静的环境中取坐位,确保注意力集中,刺激眼距离脑电屏幕100 cm,且在同一水平面。两眼分别检测,检查一眼时,将另一眼盖住,要求被刺激眼注视屏幕中央。根据国际脑电图10/20系统,记录电极置于Oz,参考电极置于FPz,棋盘格大小为12/16,灵敏度为5 μV,滤波为2~50 Hz,记录长度300 ms,重复频率1.7 Hz,叠加次数100次,各导联重复3次,取平均值。
视觉诱发电位主要测量指标包括双眼N75、P100、N135潜伏期(ms)以及N75-P100、N135-P100峰峰波幅(μV)。
1.3 统计学方法 采用SPSS 23.0进行统计分析。在分析数据前先用Shapiro-Wilk检验检查数据是否符合正态分布,对于符合正态分布的数据以x±s表示,偏态分布的数据以M(QL,QU)表示。符合正态分布的两组间比较采用独立样本t检验,偏态分布的两组间比较采用两独立样本的非参数检验(Mann-Whitney U Test)。三组数据符合正态分布且方差齐则采用单因素方差分析,事后三组间两两比较若方差齐则采用Bonferroni检验,若方差不齐则采用Tamhane's T2检验。三组数据为偏态分布或方差不齐则采用Kruskal-Wallis H检验,事后三组间两两比较直接选择Pairwise Comparisons。构成比间的比较采用χ2检验。两个连续变量之间的相关性采用Pearson及Spearman相关性分析。检验水准α=0.05。
2 结果
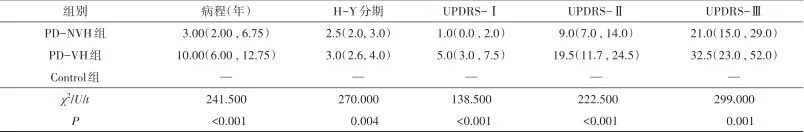
2.1 临床资料 PD-VH组共24例,PD-NVH组共52例,健康对照组22例,三组间在年龄及性别构成上无统计学差异。而PD-NVH组与PD-VH组在病程、H-Y分期、UPDRS-I和UPDRS-II、UPDRS-III总分及左旋多巴日等效剂量(LEDD)上均有统计学差异(P分别为<0.001,0.004,<0.001,<0.001,0.001及0.022)。见表1。
表1 伴/不伴视幻觉PD患者的临床资料分析Tab.1 Analysis of clinical features of PD patients with/without visual hallucinations
2.2 伴或不伴视幻觉的帕金森病患者视觉诱发电位参数的改变
2.2.1 潜伏期的改变 对22例健康体检者,52例不伴视幻觉的PD患者及24例伴有视幻觉的PD患者196只眼进行视觉诱发电位检测,各波潜伏期的结果显示N75、P100、N135潜伏期在3组间存在统计学差异(F=23.827,P<0.001;F=34.907,P<0.001;F=17.504,P<0.001)。两两比较显示PD-VH组N75、P100、N135的潜伏期较PD-NVH组及Control组显著延长(P<0.001)。但Control组与PD-NVH组两组间在N75、P100、N135潜伏期上无统计学差异(表2)。
表2 视觉诱发电位各参数(N75、P100、N135)潜伏期和波幅的比较Tab.2 Comparison of the visual evoked potential component (N75, P100, and N135) amplitude and latency
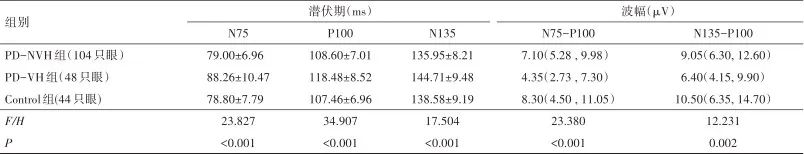
2.2.2 波幅的改变 对3组的N75-P100及N135-P100峰峰波幅(μV)也进行统计分析,结果显示3组间在N75-P100及N135-P100峰峰波幅上存在统计学差异(H=23.380,P<0.001;H=12.231,P=0.002)。两两比较结果显示PD-VH组N75-P100峰峰波幅较PD-NVH组和Control组显著降低(P均<0.001);PD-VH组N135-P100峰峰波幅也较PD-NVH组和Control组显著降低(P分别为0.037,0.002);而N75-P100及N135-P100峰峰波幅在PD-NVH组和Control组间未见统计学差异(表2)。
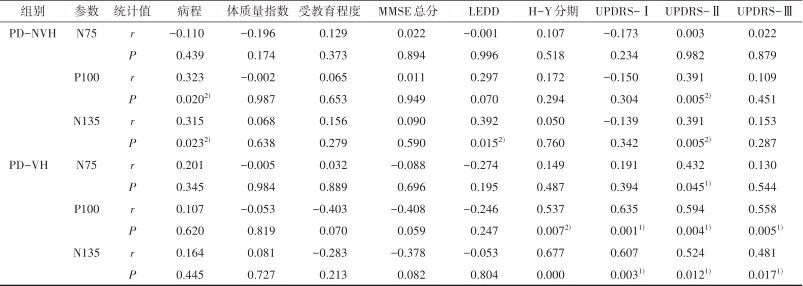
2.3 视觉诱发电位各参数与临床变量相关性分析 视觉诱发电位N75、P100、N135的潜伏期取双眼的平均值与临床变量的相关性分析见表3,在帕金森病不伴视幻觉(PD-NVH)组中可以看到病程与P100及N135潜伏期呈正相关(r=0.323,P=0.020)及(r=0.315,P=0.023),LEDD与N135潜伏期呈正相关(r=0.392,P=0.015),UPDRS-II与P100及N135潜伏期呈正相关(r=0.391,P=0.005)及(r=0.391,P= 0.005)。在帕金森病伴有视幻觉(PD-VH)组中N75潜伏期与UPDRS-II呈正相关(r=0.432,P=0.045),P100潜伏期与H-Y分期及UPDRS-Ⅰ、UPDRS-Ⅱ、UPDRS-Ⅲ总分呈正相关(r=0.537,P= 0.007;r=0.635,P=0.001;r=0.594,P=0.004;r= 0.558,P=0.005),N135潜伏期与UPDRS-Ⅰ、UPDRS-Ⅱ、UPDRS-Ⅲ总分呈正相关(r=0.607,P=0.003;r=0.524,P=0.012;r=0.481,P=0.017)。
表3 视觉诱发电位各波潜伏期与临床变量的相关性Tab.3 Correlation between latency of visual evoked potentials and clinical variables
1) Pearson相关性分析;2) Spearman相关性分析。
3 讨论
本研究通过对帕金森病及伴有视幻觉患者的视觉诱发电位来研究视觉传导通路在帕金森病视幻觉产生中的作用,结果显示与没有视幻觉的患者相比,伴发视幻觉的帕金森病患者VEP各波(N75、P100、N135)潜伏期明显延长,波幅(N75-P100、N135-P100)明显降低。视觉诱发电位是一种由多个成分组成的复杂反应,常被用来量化从视网膜经视神经、视神经束到丘脑以及投射到视皮质和枕叶视觉中枢的视觉通路功能的完整性,记录成分包括N75、P100和N135[7]。N75作为VEP的第一个主要成分,起源于多个视觉区域,并且波形的早期部分主要来自于初级视觉皮层V1区[8],主要代表早期自下而上的视觉处理过程,其潜伏期和波幅的异常预示着在PD患者中视幻觉的出现可能与自下而上视觉传导通路的受损有关。P100可能产生于腹侧和背侧纹外皮质,其形态、波幅和潜伏期是评估光通路完整性的重要电生理学参数[8-9]。在多种神经系统疾病中都可以出现P100潜伏期延长[10-13],但是P100会受多种生理因素的影响,包括性别、年龄等[14]。本研究各组间在年龄和性别上并无统计学差异,但是PD-VH组较PD-NVH组病程长,疾病分期和严重程度高,而既往的文献也已指出与幻觉的发生及严重程度相关的因素包括病程长及运动和非运动症状,如抑郁、睡眠障碍、认知障碍等[15]。N135由包括顶叶深部在内的多个区域产生[16]。伴发视幻觉的PD患者P100、N135潜伏期延长及N135-P100波幅下降也在一定程度上反映了伴发视幻觉的PD患者视觉传导通路的完整性受影响,且可能涉及自下而上传导通路以外的其他传导通路。此外,我们的结果还提示在帕金森病视幻觉中P100潜伏期与H-Y分期及UPDRS各部分评分呈正相关,换言之P100潜伏期与疾病严重程度呈正相关。因此,我们推测在出现视幻觉的PD患者中,随着疾病的进展,视觉通路的完整性逐渐破坏,视幻觉也由早期的轻微幻觉进展为复杂性视幻觉,影响从枕皮质区到其他脑区的神经活动,尤其是那些与枕区存在结构及功能连接的区域。
尽管帕金森病患者出现视幻觉的临床重要性早已被认可,但是其产生的病理生理学证据仍然不足,主要涉及视觉信息处理功能受损、脑网络的改变、神经递质的影响等多个方面[17-20]。而近年来关于视觉系统及相关结构改变的研究结果提示PD视幻觉的产生与视网膜及视觉相关脑区的结构及功能异常相关[21-25]。视觉诱发电位作为评估视觉传导通路完整性的重要指标目前相关的研究较少,而本研究通过这一简单、无创的方法来量化帕金森病中视幻觉的产生对视觉传导通路完整性的影响。但本研究也存在一定的局限性,首先样本量较小,并且伴/不伴视幻觉的PD患者在病程及疾病严重程度上存在差异。其次,视觉诱发电位并不能提供确切的定位信息。因此,下一步将通过进一步扩大样本量以及运用其他检查手段如光学相干断层扫描技术、结构和功能磁共振等来验证和明确帕金森病视幻觉中视觉传导通路的改变。
参考文献:
1. WEIL R S. Visual Dysfunction and Parkinson's Disease[J]. Mov Disord, 2020, 35(9): 1499-1501.
2. ZARKALI A, MCCOLGAN P, RYTEN M, et al. Differences in network controllability and regional gene expression underlie hallucinations in Parkinson's disease[J]. Brain, 2020, 143(11): 3435-3448.
3. DUJARDIN K, ROMAN D, BAILLE G, et al. What can we learn from fMRI capture of visual hallucinations in Parkinson's disease?[J]. Brain Imaging Behav, 2020, 14(2): 329-335.
4. MURPHY N, KILLEN A, GUPTA R K, et al. Exploring Bottom-Up Visual Processing and Visual Hallucinations in Parkinson's Disease With Dementia[J]. Front Neurol, 2020, 11: 579113.
5. GALLAGHER DA, PARKKINEN L, O'SULLIVAN S S, et al. Testing an aetiological model of visual hallucinations in Parkinson's disease[J]. Brain, 2011, 134(Pt 11): 3299-309.
6. 中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍专业. 中国帕金森病的诊断标准(2016版)[J]. 中华神经科杂志, 2016, 49(4):268-271.
7. YOUNG B, EGGENBERGER E, KAUFMAN D. Current electrophysiology in ophthalmology: a review[J]. Curr Opin Ophthalmol, 2012, 23(6): 497-505.
8. MIURA G. Visual Evoked Potentials for the Detection of Diabetic Retinal Neuropathy[J]. Int J Mol Sci, 2023, 24(8): 7361.
9. BAIANO C, ZEPPIERI M. Visual Evoked Potential [M/OL] // ACKLEY W B, ADOLPHE T S, AEBY T C, et al. StatPearls. Treasure Island (FL): StatPearls Publishing, 2024. https: //www.ncbi.nlm.nih.gov/books/NBR582128.
10. LIU C, ZHANG Y, TANG W, et al. Evoked potential changes in patients with Parkinson's disease[J]. Brain Behav, 2017,7(5):e00703.
11. CARRARINI C, RUSSO M, PAGLIACCIO G, et al. Visual evoked potential abnormalities in dementia with Lewy bodies[J]. Neurophysiol Clin, 2021, 51(5): 425-431.
12. HE S B, LIU C Y, CHEN LD, et al. Meta-Analysis of Visual Evoked Potential and Parkinson's Disease[J]. Parkinsons Dis, 2018, 2018: 3201308.
13. 张献文, 张杉杉, 郑燎源, 等. 以视力下降为表现的抗GQ1b抗体综合征1例[J]. 中国神经精神疾病杂志, 2022,48(8):489-492.
14. SHARMA R, JOSHI S, SINGH K D, et al. Visual Evoked Potentials: Normative Values and Gender Differences[J]. J Clin Diagn Res, 2015, 9(7): CC12-15.
15. MARINUS J, ZHU K, MARRAS C, et al. Risk factors for non-motor symptoms in Parkinson's disease[J]. Lancet Neurol, 2018,17(6):559-568.
16. DI RUSSO F, PITZALIS S, SPITONI G, et al. Identification of the neural sources of the pattern-reversal VEP[J]. Neuroimage, 2005, 24(3): 874-886.
17. O'BRIEN J, TAYLOR JP, BALLARD C, et al. Visual hallucinations in neurological and ophthalmological disease: pathophysiology and management[J]. J Neurol Neurosurg Psychiatry, 2020, 91(5): 512-519.
18. WEIL R S, LEES A J. Visual hallucinations[J]. Pract Neurol, 2021:practneurol-2021-003016.
19. PEZZOLI S, SÁNCHEZ-VALLE R, SOLANES A, et al. Neuroanatomical and cognitive correlates of visual hallucinations in Parkinson's disease and dementia with Lewy bodies: Voxel-based morphometry and neuropsychological meta-analysis[J]. Neurosci Biobehav Rev, 2021, 128: 367-382.
20. 常景建, 周兢, 胡洋扬, 等. 帕金森患者中脑中缝核回声变化与抑郁、焦虑症状及自主神经功能障碍相关性研究[J]. 临床军医杂志, 2023, 51(12): 1301-1302+1305.
21. MARQUES A, BEZE S, PEREIRA B, et al. Visual hallucinations and illusions in Parkinson's disease: the role of ocular pathology[J]. J Neurol, 2020, 267(10): 2829-2841.
22. DIEZ-CIRARDA M, CABRERA-ZUBIZARRETA A, MURUETA-GOYENA A, et al. Multimodal visual system analysis as a biomarker of visual hallucinations in Parkinson's disease[J]. J Neurol, 2023, 270(1): 519-529.
23. MONTAGNESE M, VIGNANDO M, FFYTCHE D, et al. Cognitive and visual processing performance in Parkinson's disease patients with vs without visual hallucinations: A meta-analysis[J]. Cortex, 2022, 146: 161-172.
24. MARQUES A, TAYLOR NL, ROQUET D, et al. Structural and Functional Correlates of Hallucinations and Illusions in Parkinson's Disease[J]. J Parkinsons Dis, 2022, 12(1): 397-409.
25. THOMAS G, ZEIDMAN P, SULTANA T, et al. Changes in both top-down and bottom-up effective connectivity drive visual hallucinations in Parkinson's disease[J]. Brain Commun, 2023, 5(1):fcac329.
【引用格式】李向,张琪林,陈菲,等.视觉诱发电位评估帕金森病视幻觉视觉传导通路临床价值[J]. 中国神经精神疾病杂志,2024,50(5):257-262.
【Cite this article】LI X,ZHANG Q L,CHEN F,et al. The clinical value of visual evoked potential in assessing visual pathway of visual hallucinations in Parkinson disease[J]. Chin J Nervous Mental Dis,2024,50(5):257-262.
DOI:10.3969/j.issn.1002-0152.2024.05.001


