【论著】| 靶向CD99的CAR-T细胞扩增优化研究
时间:2024-08-18 06:00:28 热度:37.1℃ 作者:网络
[摘要] 背景与目的:嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞疗法对血液和淋巴系统肿瘤的治疗效果显著,但对实体瘤效果较差,这与靶点选择的因素有关。针对尤因肉瘤(Ewing sarcoma,ES),CD99可作为CAR-T细胞潜在的靶点。由于T细胞自身表达CD99蛋白,靶向CD99的CAR-T细胞存在体外扩增能力有限的问题。本研究旨在通过增加CD99敲低的短发夹RNA(short hairpin RNA,shRNA)、优化慢病毒转导的感染复数(multiplicity of infection,MOI)、筛选培养CAR-T细胞的培养基及培养容器,以获得CD99 CAR-T细胞制备的最优条件。方法:筛选shRNA序列,提高CD99 CAR-T细胞的扩增能力。采用不同的MOI、培养基和培养容器,分别检测在不同条件下CAR-T细胞的转导效率、细胞存活率、增殖能力、特异性杀伤能力及干扰素-γ(interferon-γ,IFN-γ)释放水平等,筛选出最优的细胞制备条件。结果:通过shRNA敲低得到的KO-CD99 CAR-T细胞扩增水平显著高于CD99 CAR-T细胞[(16.40±0.40)vs(6.33±1.53),P<0.01]。转导MOI为0.25~1.0、培养基为OptiVitro时细胞的扩增效果最优。在透气瓶中培养的CAR-T细胞扩增倍数显著高于在培养袋中培养的细胞[MOI=0.25:(50.23±3.32)vs(13.02±4.82);MOI=0.50:(49.96±0.83) vs(18.25±2.88);MOI=1.00:(48.27±5.08)vs(13.16±6.26);P<0.01],且细胞分型更优、特异性杀伤更高。结论:通过shRNA技术得到的KO-CD99 CAR-T细胞可实现稳定扩增。从扩增条件优化结果看,MOI为0.25~1.00,培养基为OptiVitro,培养容器为透气瓶的条件下,KO-CD99 CAR-T细胞可获得更优的扩增能力、更多比例的记忆T细胞,为后续开展CD99 CAR-T细胞治疗ES的临床试验奠定了坚实基础。
[关键词] CD99;嵌合抗原受体T细胞;扩增优化;KO-CD99
[Abstract] Background and purpose: Chimeric antigen receptor T (CAR-T) cell therapy has shown remarkable efficacy in treating hematological and lymphatic system tumors, but its effectiveness in solid tumors is relatively poor, which is partly attributed to target selection. For Ewing sarcoma (ES), CD99 can be a potential target for CAR-T cells. However, due to T cells’ endogenous expression of CD99 protein, CAR-T cells targeting CD99 face limitations in their expansion capacity in vitro. This study aimed to identify the optimal conditions for preparing CD99 CAR-T cells by incorporating CD99 knockdown short hairpin RNA (shRNA), optimizing the multiplicity of infection (MOI) for lentiviral transduction, and screening for the best culture medium and container for CAR-T cell expansion. Methods: shRNA sequences were screened to enhance the expansion capacity of CD99 CAR-T cells. Different MOI, culture media, and containers were used to assess CAR-T cell transduction efficiency, cell viability, proliferation capacity, specific killing ability, and interferon-γ (IFN-γ) release levels under various conditions, in order to identify the optimal cell preparation conditions. Results: The expansion level of KO-CD99 CAR-T cells obtained through shRNA knockdown was significantly higher than that of CD99 CAR-T cells[(16.40±0.40) vs (6.33±1.53), P<0.01]. The optimal expansion effect was observed when the transduction MOI was between 0.25 and 1.0, and OptiVitro was used as the culture medium. CAR-T cells cultured in ventilated flasks exhibited significantly higher expansion rates compared to cells cultured in bags[MOI=0.25: (50.23±3.32) vs (13.02±4.82); MOI=0.50: (49.96±0.83) vs (18.25±2.88); MOI=1.00: (48.27±5.08) vs (13.16±6.26); P<0.01], with better cell phenotype and higher specific killing ability. Conclusion: KO-CD99 CAR-T cells obtained through shRNA technology can achieve stable expansion. Based on the optimization of expansion conditions, KO-CD99 CAR-T cells exhibit superior expansion capacity and a higher proportion of memory T cells when the MOI is between 0.25 and 1.00, OptiVitro is used as the culture medium, and ventilated flasks are used as the culture container. These findings lay a solid foundation for further clinical trials of CD99 CAR-T cell therapy for ES.
[Key words] CD99; Chimeric antigen receptor T cell; Amplification optimization; KO-CD99
嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞疗法是一种很有前景的免疫疗法,已经获批在临床上用于治疗恶性肿瘤。CAR-T细胞是通过反转录病毒或慢病毒将基因工程技术改造的CAR基因序列插入T细胞基因组中,进而可得到稳定表达CAR结构的T细胞。目前批准的CAR-T细胞由单链可变片段(single-chain fragment variable,ScFv)抗原识别结构域、CD3来源的T细胞激活结构域(CD3z)和共刺激结构域(CD28或4-1BB)组成[1]。然而,CAR-T细胞并不是对所有类型的癌症都有效。目前,CAR-T细胞治疗血液系统恶性肿瘤的效果较好,例如,CD19 CAR-T细胞治疗难治性/复发性B细胞急性淋巴细胞白血病(B-cell-acute lymphoblastic leukemia,B-ALL)效果显著[2]。但对于实体瘤,CAR-T细胞疗法仍不太成功,这与靶点选择的因素有关[3-4]。尤因肉瘤(Ewing sarcoma,ES)是儿童和年轻人群中第二常见的骨肉瘤[5-7]。目前归类于骨和软组织的未分化小圆细胞肉瘤[8]。近年来,局部治疗和多药辅助化疗在治疗ES等局限性疾病方面取得了长足进步,但其复发率仍很高。对于复发和难治性ES,仍没有标准的治疗方法[9]。目前,针对包括ES在内的实体肿瘤的CAR-T细胞疗法正在研究中。ES样本中的CD99阳性率几乎为100%,临床上也将CD99作为其诊断标志物[10-11],可作为ES的潜在治疗靶点。
为满足临床试验回输剂量,提高CD99 CAR-T细胞的记忆分型,本研究通过基因修饰和优化培养方式完成CD99 CAR-T细胞的优化。通过shRNA对CD99蛋白进行敲低,降低CD99 CAR-T细胞表面CD99蛋白的表达水平,提高CD99 CAR-T细胞的扩增能力。本研究进一步对比了不同慢病毒转导的感染复数(multiplicity of infection,MOI)、培养基和培养容器对CAR-T细胞扩增的影响,以制备出稳定且质量高的CAR-T细胞,为CAR-T细胞生产工艺的稳定提供保障,为临床试验的开展奠定基础。
1 材料和方法
1.1 材料
表达CD99 CAR慢病毒的穿梭质粒和CD99检测蛋白为武汉波睿达生物科技有限公司赠予,CD99 shRNA序列的引物由武汉擎科生物科技有限公司合成,引物信息见表1。人横纹肌肉瘤细胞A-673来自武汉科技大学,人原代T细胞从人外周血中提取,人CD3磁珠和人T细胞TransAct购自德国Miltenyi Biotec公司,转染试剂聚凝胺购自上海翌圣生物科技有限公司,DMEM-Basic、Gibco CTSTM OpTmizerTM T-Cell Expansion Basal Medium-L-Glutamine培养基及0.25% Trypsin-EDTA购自美国Thermo Fisher Scientific公司,OptiVitro T细胞无血清培养基和OptiVitro UniEx T细胞无血清培养基均购自苏州依科赛生物科技股份有限公司,胎牛血清购自上海吉泰依科赛生物科技有限公司,T25、T75和T175细胞培养瓶(透气瓶)购自康宁生命科学(吴江)有限公司,MACS® GMP Cell Differentiation Bag购自德国Miltenyi Biotec公司,INNOVEL® 220 mL Cell Culture Immuno Vessel购自英诺维尔智能科技(苏州)有限公司。
流式抗体7-AAD Viability Staining Solution、APC anti-His Tag Antibody、FITC Mouse IgG1,k Isotype Ctrl(FC)、FITC anti-human CD3、PE Mouse anti-human CD99、PE Mouse IgG2a,k Isotype Control、PE anti-human CCR7、BV421 anti-human CD45RA Antibody、BV650 anti-human CD45RO Antibody、PE anti-human CD25 Antibody、BV421 anti-human CD69 Antibody、BV650 anti-human CD71 Antibody和凋亡检测试剂盒均购自美国Biolegend公司,钙黄绿素购自上海阿拉丁生化科技股份有限公司,Human干扰素-γ(interferon-γ,IFN-γ)precoated ELISA kit(Cat: 1110002)试剂盒购自上海达科为生物科技有限公司。

1.2 方法
1.2.1 KO-CD99 CAR-T细胞的构建及制备
将由上述引物退火得到的shRNA片段导入RNA Pol Ⅲ启动子后,插入PLVX-EF1α-CD99 CAR载体的上游,重组质粒经武汉擎科生物科技有限公司鉴定和美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)比对验证。DNA回收采用日本Takara公司的琼脂糖凝胶DNA回收试剂盒,并采用NanoDrop微量紫外分光光度计定量。
1.2.2 人原代T细胞的分离
将健康供者来源的外周血缓慢加入到装有 20 mL淋巴细胞分离液的50 mL离心管中,700×g离心15 min,离心机升降参数调至3,离心后将环状乳白色淋巴细胞层用移液器吸出,得到单个核细胞,进行单个核细胞计数。以10 μL/2×107个细胞的比例加入人CD3磁珠,并用4倍体积的分选缓冲液重悬后室温温育30 min,再用5 mL分选缓冲液重悬,将悬液通过磁力柱,T细胞会通过磁珠被吸附到柱子上,用2 mL分选缓冲液洗 2遍柱子后,在柱子中加入5 mL分选缓冲液,用力快速推动柱子上的活塞将T细胞冲洗下来,收集冲洗下来的细胞。
1.2.3 慢病毒转染T细胞
取所需数目的生长状况良好的原代T细胞于6孔板中,采用相应MOI对T细胞进行转染,转染时补加聚凝胺使其终浓度为5 µg/mL。转染后持续监测CAR-T细胞的增殖情况,采用流式细胞术检测转染效率和细胞存活率。
1.2.4 流式细胞术检测
收集大于5×105个CAR-T细胞于流式管中,向每管中加入1 mL流式缓冲液,300×g离心5 min,去掉上清液,重复洗2遍,用50 µL流式缓冲液重悬细胞,加入相应量的CD99蛋白或抗体进行染色标记,4 ℃避光染色30 min后,加入1 mL流式缓冲液终止染色,300×g离心5 min,去掉上清液,重复洗2遍,用250 µL流式缓冲液重悬细胞后加入2.5 µL 7-AAD抗体,染色10 min,采用流式细胞术分析检测。
1.2.5 采用钙黄绿素释放法检测CD99 CAR-T细胞的细胞毒性
选取A-673细胞作为阳性靶细胞,效应细胞为CD99 CAR-T细胞。将经钙黄绿素标记、浓度为5×104个/mL的靶细胞接种于U底96孔培养板中,100 µL/孔。按不同效应细胞与靶细胞比例(25︰1、5︰1、1︰1)加入各组效应细胞,体积为100 µL/孔。设置阳性对照组(加入裂解液)和阴性对照组(加入1×磷酸缓冲盐溶液)。各组均设4个复孔,在37 ℃生化培养箱中温育3.5 h后将96孔板300×g离心10 min,从各孔吸取150 µL上清液对应转移到预先标记好的新的平底96孔板中,置于酶标仪(参数设置:激发光波长485/20;发射光波长530/25)扫描读取荧光值。根据以下公式计算各组效应细胞的细胞毒性:特异性裂解百分比(%)=(实验组荧光值-阴性对照组荧光值)/(阳性对照组荧光值-阴性对照组荧光值)×100%。实验重复3次。
1.2.6 采用ELISA法检测CD99 CAR-T细胞中IFN-γ的分泌水平
取适量靶细胞A-673 细胞于96孔板中(5×104个/孔,体积100 µL)作为阳性靶细胞组,按照25∶1的效应细胞与靶细胞比例,加入T细胞和CD99 CAR-T细胞(1.25×106个/孔,体积100 µL)于对应的孔中,每个样品设3个复孔,使用含10%胎牛血清的DMEM-Basic培养基作为共培养体系。在37 ℃生化培养箱中温育24 h后,将96孔板在常温下300×g离心10 min后收集120 µL上清液,按酶联免疫吸附试剂盒的说明书常温操作检测IFN-γ的分泌水平,在450 nm波长下检测吸光度(D)值,并根据标准曲线计算各样本细胞因子的含量(pg/mL)。
1.3 统计学处理
采用GraphPad Prism 9软件对数据进行统计分析。实验数据以x±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 靶向CD99的CAR-T细胞由于识别自身抗原难以扩增
利用基因合成和分子克隆技术分别构建出含有CD19 CAR片段、CD30 CAR片段和CD99 CAR片段的质粒(图1A),除ScFv不同外,其他组成原件均一致。用这3种质粒包装出的病毒对新鲜分离出的T细胞进行转染。细胞扩增实验结果表明,培养到第14天的CD99 CAR-T细胞的扩增倍数(20.00±5.57)显著低于CD19 CAR-T细胞和CD30 CAR-T细胞[(46.67±4.51)和(40.33±1.53),P<0.01,图1B];在CAR-T细胞培养到第7、14和21天时,分别采用流式细胞术进行检测,结果显示,CD99 CAR-T细胞的转染效率最高,接近100%,CD30 CAR-T细胞和CD19 CAR-T细胞的转染效率则分别为70%和30%左右(图1C)。
为了找出影响CD99 CAR-T细胞扩增的因素,本实验对T细胞表面CD99抗原的表达进行了检测,发现T细胞上CD99的抗原表达会随着T细胞的激活时间逐渐增强,但其膜蛋白表达水平比人横纹肌肉瘤细胞A-673低(图1D),这也证明了CD99作为ES的潜在靶点的可能。本实验对CD19 CAR-T细胞、CD30 CAR-T细胞和CD99 CAR-T细胞进行了流式凋亡检测,发现CD99 CAR-T细胞的早期凋亡细胞比例和坏死细胞比例都明显高于CD19 CAR-T细胞和CD30 CAR-T细胞(图1E)。由此推断CD99 CAR-T细胞自身表达的CD99蛋白会对自身产生不良影响。
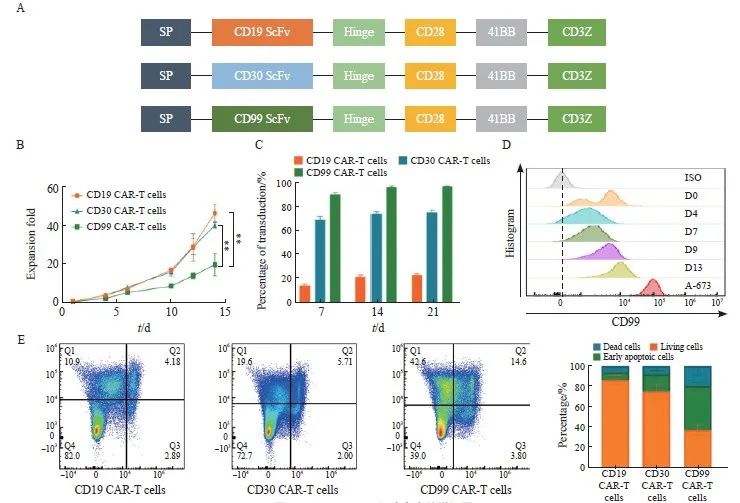
图1 CD99 CAR-T细胞存在扩增问题
Fig. 1 The CD99 CAR-T cells exhibit proliferation challenges
A: Structure diagram of CD19-CAR, CD30-CAR and CD99-CAR; B:Fold expansion of CD19 CAR-T cells, CD30 CAR-T cells and CD99 CAR-T cells; C: Transduction efficiency of CD19 CAR-T cells, CD30 CAR-T cells and CD99 CAR-T cells; D: Expression of CD99 protein on T cells and A-673 cells; E: The flow apoptosis diagram of CD19 CAR-T cells, CD30 CAR-T cells and CD99 CAR-T cells. **: P<0.01, compared with CD99 CAR-T cells.
2.2 CAR-T细胞表面CD99蛋白表达的降低提高了CD99 CAR-T细胞扩增能力
为了降低细胞表面CD99蛋白的表达,提高CD99 CAR-T细胞的扩增。本实验采用shRNA技术降低CD99 CAR-T细胞表面CD99抗原的表达。首先选取了两段不同的shRNA序列,在Jurkat人类T细胞白血病细胞系上进行shRNA筛选,以获得最优的敲低效率,从细胞表面CD99抗原的表达情况可以看到,shRNA-1的敲低效果最优,敲低效率接近其同型对照组(isotype),如图2A所示。
将筛选出的shRNA构建到CD99 CAR的质粒上,慢病毒包装及转染T细胞后获得KO-CD99 CAR-T细胞。在确保培养条件均一致的情况下,发现第14天的KO-CD99 CAR-T细胞的扩增倍数显著高于CD99 CAR-T细胞[(16.40±0.40)vs(6.33±1.53),P<0.01,图2B]。为了确保KO-CD99 CAR-T细胞的功能没有因基因敲低而受到影响,本实验对比了KO-CD99 CAR-T细胞和CD99 CAR-T细胞的转染效率、特异性杀伤效果和IFN-γ释放水平等检测结果,发现这两种CAR-T细胞均无显著差异(P>0.05,图2C~2E)。上述结果提示,通过敲低T细胞表面的CD99抗原可以实现CD99 CAR-T细胞的稳定扩增。
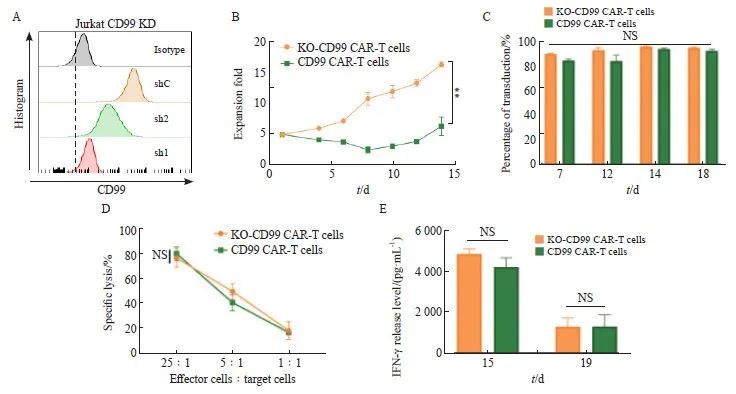
图2 通过shRNA技术提高 CD99 CAR-T细胞扩增
Fig. 2 Enhancement of CD99 CAR-T cell expansion by shRNA technology
A: Knockdown the expression of CD99 protein on the cell surface of different shRNA; B: Proliferation of CD99 CAR-T cells and KO-CD99 CAR-T cells; C: Transduction efficiency of CD99 CAR-T cells and KO-CD99 CAR-T cells; D: Killing effect of CD99 CAR-T cells and KO-CD99 CAR-T cells; E: IFN-γ release level of CD99 CAR-T cells and KO-CD99 CAR-T cells; **: P<0.01, compared with CD99 CAR-T cells; NS: No significance.
2.3 不同MOI对KO-CD99 CAR-T细胞扩增效果的影响
为了使KO-CD99 CAR-T细胞的扩增效果更好,本实验首先优化了MOI,MOI可能会影响CAR-T细胞的扩增。参考本课题组前期研究[12],分别采用MOI=0.25、0.50、1.00、1.50和2.00对健康人外周血来源的新鲜T细胞进行转导。通过流式细胞术检测不同MOI对KO-CD99 CAR-T细胞转染效率的影响,结果显示,不同MOI对KO-CD99 CAR-T细胞的转染效率均为90%左右,组间差异无统计学意义[(89.50±4.77)%、(91.17±4.53)%、(91.5±4.58)%、(91.33±4.64)%和(78.50±21.55)%,P>0.05,图3A];同时在细胞培养的第7、12、14和18天时分别进行细胞存活率流式细胞术检测,发现这4个不同时间点各个实验组之间的细胞存活率差异无统计学意义(P >0.05,图3B)。
不同MOI对KO-CD99 CAR-T细胞增殖能力具有显著影响。实验结果显示,MOI为0.25和0.50的细胞扩增倍数与MOI为1.50的细胞扩增倍数均存在显著差异[(21.55±6.5) vs (8.70±2.09),P<0.05;(18.48±2.08) vs (8.70±2.09),P<0.01,图3C],MOI为1.00的细胞扩增倍数优于MOI为1.50和2.00的细胞扩增倍数,但差异无统计学意义(P>0.05)。除此之外,本实验还探究了由不同MOI转染得到的CAR-T细胞的特异性杀伤活性和IFN-γ释放水平,结果显示,在3组不同的效应细胞与靶细胞比例下不同MOI实验组之间的细胞特异性杀伤活性差异无统计学意义(P>0.05,图3D)。从IFN-γ释放水平来看,不同时间点MOI为2.00的释放水平与MOI为0.25~1.50的释放水平均存在显著差异[第15天:(3 353.00±469.52)vs(1 765.00±299.81)、(1 806.00±16.97)、(1 818.50±481.54)、(2 114.5±16.26),P<0.01;第19天:(2 470.50±335.88)vs(1 321.00±193.75)、(1 493.50±72.83)、(1 461.00±5.66)、(1 750.50±152.03),P <0.05,图3E]。
综上所述,发现MOI对KO-CD99 CAR-T细胞的转染效率、特异性杀伤活性等均无影响,但当MOI为0.25 ~ 1.00时转染得到的KO-CD99 CAR-T细胞的扩增效果最佳。
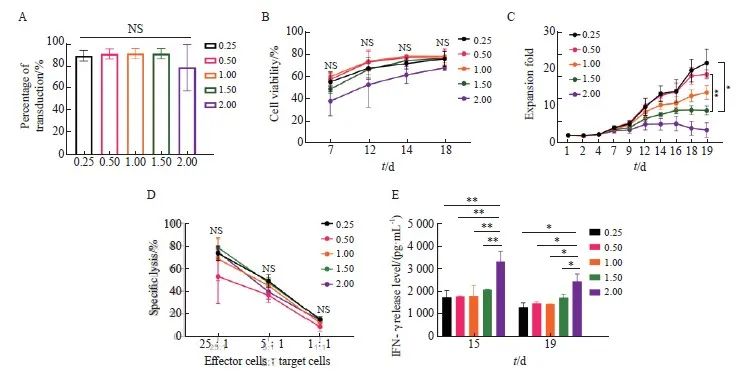
图3 不同MOI对sh-CD99 CAR-T细胞转染的影响
Fig. 3 Effects of different MOIs on sh-CD99 CAR-T cell transfection
A: Transfection efficiency of KO-CD99 CAR-T cells in each MOI; B: Cell viability of KO-CD99 CAR-T cells obtained from different MOI; C: Fold expansion of KO-CD99 CAR-T cells obtained from different MOI; D: Killing effect of KO-CD99 CAR-T cells obtained from different MOI; E: IFN- γ release level of KO-CD99 CAR-T cells obtained from different MOI. *: P<0.05; **: P<0.01; NS: No significance.
2.4 不同培养基对KO-CD99 CRA-T细胞扩增效果的影响
培养基的选择可能对KO-CD99 CAR-T细胞的扩增产生影响。本实验选用了3种GMP级别的T细胞培养基,分别是Gibco CTSTM OpTmizerTM T-Cell Expansion Basal Medium-L-Glutamine培养基、OptiVitro T细胞无血清培养基和OptiVitro UniEx T细胞无血清培养基。采用流式细胞术检测不同培养基对KO-CD99 CAR-T细胞的影响,结果显示,用3种培养基培养的CAR-T细胞的细胞转染效率和细胞存活率差异均无统计学意义(P>0.05,图4A、4B)。从细胞扩增效果看,用OptiVitro培养基培养的CAR-T细胞扩增倍数高于Gibco培养基和OptiVitro UniEx培养基[(36.79±23.02)vs(14.92±14.29)、(31.36±21.54),图4C]。
本实验还探究了不同培养基对KO-CD99 CAR-T细胞特异性杀伤效果的影响,结果显示,第16天,用OptiVitro培养基培养的细胞杀伤效果与用Gibco培养基培养的细胞差异无统计学意义(P>0.05),而用OptiVitro培养基培养的细胞杀伤效果显著高于OptiVitro UniEx培养基[(64.33±4.04)vs(49.67±3.51),P<0.01,图4D]。第22天,3种培养基培养的细胞杀伤效果差异无统计学意义(P>0.05,图4D),但OptiVitro培养基培养的细胞杀伤效果仍高于OptiVitro UniEx培养基。
综上所述,在3种无血清培养基中,OptiVitro培养基比Gibco培养基和OptiVitro UniEx培养基更适用于KO-CD99 CAR-T细胞的培养,因为 KO-CD99 CAR-T细胞在OptiVitro培养基中的增殖效果最优。这为KO-CD99 CAR-T细胞的培养奠定了坚实基础。
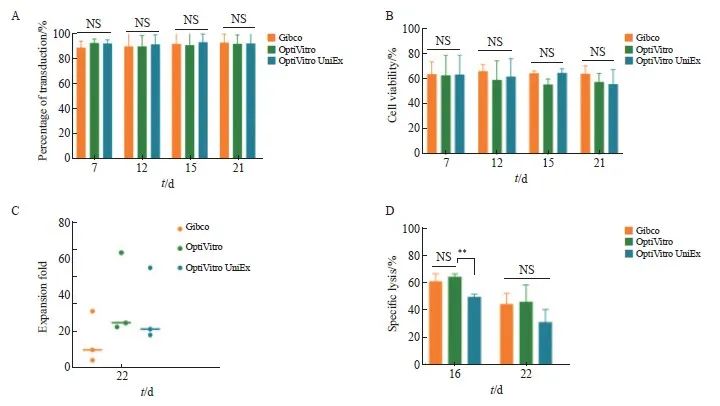
图4 不同培养基对KO-CD99 CAR-T 细胞的影响
Fig. 4 Effect of different culture media on KO-CD99 CAR-T cells
A: Transfection efficiency of KO-CD99 CAR-T cells in different medium; B: Cell viability of KO-CD99 CAR-T cells in different medium; C: Fold expansion of KO-CD99 CAR-T cells in different medium; D: Killing effect of KO-CD99 CAR-T cells in different medium. **: P<0.01, compared with OptiVitro; NS: No significance.
2.5 培养容器对KO-CD99 CAR-T细胞转染扩增的影响
在上述研究的基础上,得出MOI为0.25~1.00的转导条件下,细胞扩增效果较好,考虑到培养容器的选择对CAR-T细胞的扩增也有重要影响,因此本实验选取了透气瓶和培养袋两种培养容器进行比较。首先用3种不同的MOI(0.25、0.50和1.00)对CAR-T细胞进行感染,并在细胞扩增到一定体积后将细胞平均转移到不同的培养容器中,进行后续培养。采用流式细胞术检测不同培养容器对KO-CD99 CAR-T细胞转染效率和细胞存活率的影响,结果显示,不同条件下的KO-CD99 CAR-T细胞在转染第7、15和21天的转染效率和细胞存活率差异均无统计学意义(P >0.05,图5A、5B)。
比较不同条件下的第22天的细胞扩增水平,结果显示,不同MOI(0.25、0.50和1.00)感染的细胞在相同容器中无差别,但同一MOI在不同容器中存在显著差异,在透气瓶中培养的细胞扩增倍数明显高于在培养袋中培养的细胞[MOI=0.25:(50.23±3.32)vs(13.02±4.82);MOI=0.50:(49.96±0.83)vs(18.25±2.88);MOI=1.00:(48.27±5.08)vs(13.16±6.26);P<0.01,图5C]。并且同一MOI的KO-CD99 CAR-T细胞在效效应细胞与靶细胞比例为25∶1的情况下,在透气瓶中培养的CAR-T细胞的杀伤效果和IFN-γ释放水平均显著高于在培养袋中培养的CAR-T细胞(P<0.01,图5D、5E)。
同时本实验还评估了细胞的分化和激活水平,从分化水平看,透气瓶培养的CAR-T细胞中中央记忆T细胞占比较培养袋高(图5F)。CAR-T细胞的激活程度可以根据CD25、CD69和CD71的表达水平来判断。从激活水平看,在检测的3种激活标志物中,透气瓶中细胞的CD25、CD71表达水平显著高于培养袋中的细胞(P <0.001,图5G)。上述结果提示,透气瓶更适合KO-CD99 CAR-T细胞增殖。
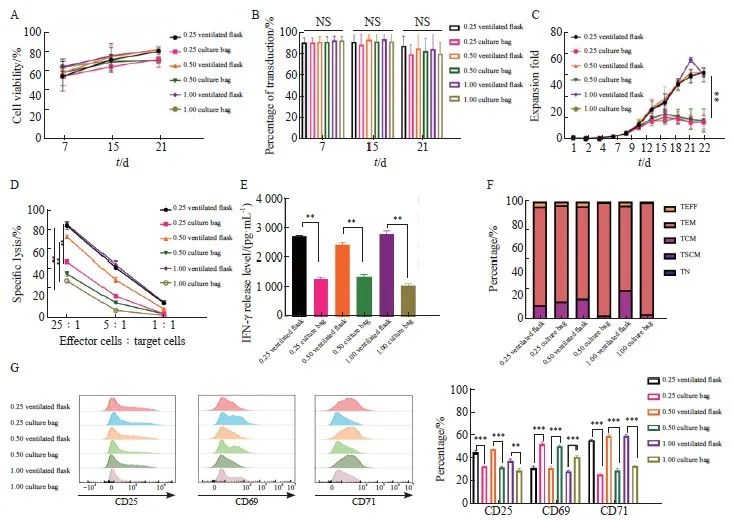
图5 不同MOI和培养容器对KO-CD99 CAR-T 细胞的影响
Fig. 5 Effects of different MOIs and culture vessels on KO-CD99 CAR-T cells
A: Transfection efficiency of KO-CD99 CAR-T cells in each MOI and different culture containers; B: Cell viability of KO-CD99 CAR-T cells obtained from different MOI and different culture containers; C: Fold expansion of KO-CD99 CAR-T cells obtained from different MOI and different culture containers; D: Killing effect of KO-CD99 CAR-T cells obtained from different MOI and different culture container; E: IFN-γ release level of KO-CD99 CAR-T cells obtained from different MOI and different culture containers; F: Cluster of differentiation of KO-CD99 CAR-T cells obtained from different MOI and different culture containers; G: The expression level of CD25, CD69 and CD71 on KO-CD99 CAR-T cells obtained from different MOI and different culture containers. TEFF: Effector T cell; TEM: Effector memory T cell; TCM: Central memory T cell; TSCM: Stem cell memory T cell; TN: Naive T cell. **: P<0.01; ***: P<0.001.
3 讨 论
CAR-T细胞疗法是一种对血液和淋巴系统肿瘤具有显著疗效的免疫疗法[13]。CAR-T细胞可以直接结合靶细胞表位,分泌可以杀死肿瘤细胞的细胞因子,并自我增殖以发挥持久的抗肿瘤作用[14-16]。有研究发现,CD99蛋白在血液恶性肿瘤、骨肉瘤、乳腺癌、胰腺癌及恶性胶质瘤等肿瘤细胞中表达异常[17-21]。大量的临床前研究数据[22-23]表明,CD99可以作为肿瘤的标志物用于疾病的诊断和治疗。本课题组前期对CD99 CAR-T细胞展开研究[24],发现并解决了CD99 CAR-T细胞的扩增问题。本研究通过对MOI、培养基和培养容器等培养条件的探究,以寻找适合CD99 CAR-T细胞扩增的最优条件,为ES的治疗研究提供参考。
本课题组以往对CD99 CAR-T细胞治疗T细胞急性淋巴细胞白血病(T-cell-acute lymphoblastic leukemia,T-ALL)的研究[24]发现,靶向CD99 CAR-T细胞可以有效地根除T-ALL,CD99 CAR-T细胞的扩增倍数远低于CD19 CAR-T细胞,但在转染3 d后分选出的CD99 CAR+细胞中并未检测到CD99抗原的表达,并且分选后的CD99 CAR+细胞与分选后的CD19 CAR+细胞扩增倍数无显著性差异。由此,我们提出以CD99为靶点的CAR-T细胞可能由于自身细胞表面存在CD99蛋白,会对自身产生不良影响。本实验采用shRNA技术降低CD99 CAR-T细胞表面CD99抗原的表达,以减少CD99 CAR-T细胞之间的相互影响,使CD99 CAR-T细胞可以稳定扩增。
从MOI的优化结果来看,不同MOI的转染效率一致,但MOI为0.25~1.00的KO-CD99 CAR-T细胞扩增效果最佳。由于shRNA对CD99蛋白的敲低,被慢病毒感染的T细胞表面CD99表达水平降低,KO-CD99 CAR-T细胞会对培养体系中未被感染的T细胞产生杀伤作用。因此由5种MOI转染得到的CAR-T细胞转染效率无显著性差异,但大量的病毒会对T细胞产生细胞毒性,影响其增殖能力。
培养基是培养环境中的重要成分,因为它能提供细胞生长所需要的营养物质、生长因子和激素,并调节培养物的渗透压和pH值。由于GMP标准化的要求以及在伦理和生态方面的考量,无血清培养基更适合CAR-T细胞的GMP级别的生产。然而,不同的无血清培养基提供了不同的培养条件,且具有各自不同的特性。因此,亟需寻找一款适合CD99 CAR-T细胞生长的培养基。本研究结果显示,与其他2种无血清培养基相比,OptiVitro培养基更具有优势。
培养容器会影响细胞培养过程中培养物质的分配和气体交换,之前已有多项研究[25-27]证明透气容器在细胞培养方面具有优势。用透气瓶培养的KO-CD99 CAR-T细胞的扩增水平、细胞分型、特异性杀伤活性及IFN-γ释放水平都显著优于用培养袋培养的KO-CD99 CAR-T细胞。透气瓶的底部有一层平坦的透气性硅树脂膜[28],细胞会在重力作用下沉降在透气膜上,彼此靠近,与外界进行高效的气体交换,这一点对于倾向于集群生长的T细胞而言更为有利[29],这可能是细胞在透气瓶中的扩增比培养袋好的原因。CD71已被证明与T细胞受体(T cell receptor,TCR-CD3)复合物ζ链和ZAP70的磷酸化相关,并可能进一步参与TCR信号转导[30],其在静止淋巴细胞中的表达非常低,但激活后表达上调,表明细胞进行铁依赖性增殖[31]。已有研究[32-35]表明,CD71的表达与细胞增殖呈正相关,与本实验结果一致,透气瓶中培养的细胞CD71表达量比培养袋高。在透气瓶中培养的KO-CD99 CAR-T细胞比在培养袋中培养的KO-CD99 CAR-T细胞显示出更多的中央记忆T细胞亚群,表明其具有长期抗肿瘤功能。已有研究[36-37]发现,记忆T细胞的耗氧量更高,高溶解氧的环境可能对耗氧量高的中央记忆T细胞群体扩增更有利。T细胞激活后,信号驱动初始T细胞分化为记忆T细胞或效应T细胞,记忆T细胞比效应T细胞分化程度低,可持续介导抗肿瘤反应。除此之外,透气瓶培养的KO-CD99 CAR-T细胞激活程度高,具有更高的IFN-γ释放能力,表现出更强的杀伤效果。本研究检测了两组细胞的CD25表达水平,发现在透气瓶中培养的细胞CD25表达比培养袋高。CD25蛋白被认为是细胞活化的标志,在体外通过刺激TCR-CD3复合物或使用phorbol酯激活后,其表达上调,常用CD25来表征T细胞激活水平[38]。
综上所述,通过shRNA技术提高了CD99 CAR-T细胞的扩增能力。MOI为0.25~1.00、培养基为OptiVitro、培养容器为透气瓶时更适合KO-CD99 CAR-T细胞的扩增,为后续开展CD99 CAR-T细胞治疗ES的临床试验奠定了坚实基础。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
王伊玄:研究方案可行性调查分析,实验操作,实验数据分析,数据可视化处理,撰写及修订文章;
于淼:实验操作,实验数据收集分析;
赵家旋:实验操作,审核及修订文章;
赵芬芳,曾毅,王友湧:实验操作;
祝海川,张同存:审核文章;
史江舟:提出研究方向,设计实验方案,设计文章框架,审核文章。
[参考文献]
[1]ZHANG X, LI J J, LU P H. Advances in the development of chimeric antigen receptor-T-cell therapy in B-cell acute lymphoblastic leukemia[J]. Chin Med J, 2020, 133(4): 474-482.
[2]PARK J H, GEYER M B, BRENTJENS R J. CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date[J]. Blood, 2016, 127(26): 3312-3320.
[3]MAROFI F, MOTAVALLI R, SAFONOV V A, et al. CAR T cells in solid tumors: challenges and opportunities[J]. Stem Cell Res Ther, 2021, 12(1): 81.
[4]WAGNER J, WICKMAN E, DERENZO C, et al. CAR T cell therapy for solid tumors: bright future or dark reality? [J]. Mol Ther, 2020, 28(11): 2320-2339.
[5]RIGGI N, CIRONI L, PROVERO P, et al. Development of Ewing sarcoma from primary bone marrow-derived mesenchymal progenitor cells[J]. Cancer Res, 2005, 65(24): 11459-11468.
[6]RIGGI N, SUVÀ M L, SUVÀ D, et al. EWS-FLI-1 expression triggers a Ewing sarcoma initiation program in primary human mesenchymal stem cells[J]. Cancer Res, 2008, 68(7): 2176-2185.
[7]DESAI S S, JAMBHEKAR N A. Pathology of Ewing sarcoma/PNET: current opinion and emerging concepts[J]. Indian J Orthop, 2010, 44(4): 363-368.
[8]KALLEN M E, HORNICK J L. The 2020 WHO classification[J]. Am J Surg Pathol, 2020, 45(1): e1-e23.
[9]VAN MATER D, WAGNER L. Management of recurrent Ewing sarcoma: challenges and approaches[J]. Onco Targets Ther, 2019, 12: 2279-2288.
[10]BALDAUF M C, ORTH M F, DALLMAYER M, et al. Robust diagnosis of Ewing sarcoma by immunohistochemical detection of super-enhancer-driven EWSR1-ETS targets[J]. Oncotarget, 2018, 9(2): 1587-1601.
[11]ROCCHI A, MANARA M C, SCIANDRA M, et al. CD99 inhibits neural differentiation of human Ewing sarcoma cells and thereby contributes to oncogenesis[J]. J Clin Invest, 2010, 120(3): 668-680.
[12]ZHANG S K, GU C J, HUANG L F, et al. The third-generation anti-CD30 CAR T-cells specifically homing to the tumor and mediating powerful antitumor activity[J]. Sci Rep, 2022, 12(1): 10488.
[13]ELSALLAB M, LEVINE B L, WAYNE A S, et al. CAR T-cell product performance in haematological malignancies before and after marketing authorisation[J]. Lancet Oncol, 2020, 21(2): e104-e116.
[14]FEINS S, KONG W M, WILLIAMS E F, et al. An introduction to chimeric antigen receptor (CAR) T-cell immunotherapy for human cancer[J]. Am J Hematol, 2019, 94(S1): S3-S9.
[15]AHMED N, SALSMAN V S, YVON E, et al. Immunotherapy for osteosarcoma: genetic modification of T cells overcomes low levels of tumor antigen expression[J]. Mol Ther, 2009, 17(10): 1779-1787.
[16] ANDERS K, BLANKENSTEIN T. Molecular pathways: comparing the effects of drugs and T cells to effectively target oncogenes[J]. Clin Cancer Res, 2013, 19(2): 320-326.
[17] SCIANDRA M, MARINO M T, MANARA M C, et al. CD99 drives terminal differentiation of osteosarcoma cells by acting as a spatial regulator of ERK 1/2[J]. J Bone Miner Res, 2014, 29(5): 1295-1309.
[18] BYUN H J, HONG I K, KIM E, et al. A splice variant of CD99 increases motility and MMP-9 expression of human breast cancer cells through the AKT-, ERK-, and JNK-dependent AP-1 activation signaling pathways[J]. J Biol Chem, 2006, 281(46): 34833-34847.
[19] BACCAR A, FERCHICHI I, TROUDI W, et al. CD99 and HLA-Ⅱ immunostaining in breast cancer tissue and their correlation with lymph node metastasis[J]. Dis Markers, 2013, 34(5): 363-371.
[20] GOTO A, NIKI T, TERADO Y, et al. Prevalence of CD99 protein expression in pancreatic endocrine tumours (PETs)[J]. Histopathology, 2004, 45(4): 384-392.
[21] CARDOSO L C, SOARES R D S, LAURENTINO T S, et al. CD99 expression in glioblastoma molecular subtypes and role in migration and invasion[J]. Int J Mol Sci, 2019, 20(5): 1137.
[22] PASELLO M, MANARA M C, SCOTLANDI K. CD99 at the crossroads of physiology and pathology[J]. J Cell Commun Signal, 2018, 12(1): 55-68.
[23] SCOTLANDI K, BALDINI N, CERISANO V, et al. CD99 engagement: an effective therapeutic strategy for Ewing tumors[J]. Cancer Res, 2000, 60(18): 5134-5142.
[24] SHI J Z, ZHANG Z J, CEN H, et al. CAR T cells targeting CD99 as an approach to eradicate T-cell acute lymphoblastic leukemia without normal blood cells toxicity[J]. J Hematol Oncol, 2021, 14(1): 162.
[25] JIN J J, SABATINO M, SOMERVILLE R, et al. Simplified method of the growth of human tumor infiltrating lymphocytes in gas-permeable flasks to numbers needed for patient treatment[J]. J Immunother, 2012, 35(3): 283-292.
[26] BAJGAIN P, MUCHARLA R, WILSON J, et al. Optimizing the production of suspension cells using the G-Rex “M” series[J]. Mol Ther Methods Clin Dev, 2014, 1: 14015.
[27] GAGLIARDI C, KHALIL M, FOSTER A E. Streamlined production of genetically modified T cells with activation, transduction and expansion in closed-system G-Rex bioreactors[J]. Cytotherapy, 2019, 21(12): 1246-1257.
[28] LUDWIG J, HIRSCHEL M. Methods and process optimization for large-scale CAR T expansion using the G-rex cell culture platform[J]. Methods Mol Biol, 2020, 2086: 165-177.
[29] GARCIA-APONTE O F, HERWIG C, KOZMA B. Lymphocyte expansion in bioreactors: upgrading adoptive cell therapy[J]. J Biol Eng, 2021, 15(1): 13.
[30] SALMERÓN A, BORROTO A, FRESNO M, et al. Transferrin receptor induces tyrosine phosphorylation in T cells and is physically associated with the TCR zeta-chain[J]. J Immunol, 1995, 154(4): 1675-1683.
[31] LUM J B, INFANTE A J, MAKKER D M, et al. Transferrin synthesis by inducer T lymphocytes[J]. J Clin Invest, 1986, 77(3): 841-849.
[32] MOTAMEDI M, XU L, ELAHI S. Correlation of transferrin receptor (CD71) with Ki67 expression on stimulated human and mouse T cells: the kinetics of expression of T cell activation markers[J]. J Immunol Methods, 2016, 437: 43-52.
[33] NGUYEN X D, EICHLER H, DUGRILLON A, et al. Flow cytometric analysis of T cell proliferation in a mixed lymphocyte reaction with dendritic cells[J]. J Immunol Methods, 2003, 275(1/2): 57-68.
[34] SCHWAB L, MICHEL G, BEIN G, et al. CD71 surface analysis of T cells: a simple alternative for extracorporeal photopheresis quality control[J]. Vox Sang, 2020, 115(1): 81-93.
[35] CHEN C, GU Y M, ZHANG F, et al. Construction of PD1/CD28 chimeric-switch receptor enhances anti-tumor ability of c-Met CAR-T in gastric cancer[J]. Oncoimmunology, 2021, 10(1): 1901434.
[36] RATHMELL J C, VANDER HEIDEN M G, HARRIS M H, et al. In the absence of extrinsic signals, nutrient utilization by lymphocytes is insufficient to maintain either cell size or viability[J]. Mol Cell, 2000, 6(3): 683-692.
[37] KRAUSS S, BRAND M D, BUTTGEREIT F. Signaling takes a breath: new quantitative perspectives on bioenergetics and signal transduction[J]. Immunity, 2001, 15(4): 497-502.
[38] JACKSON A L, MATSUMOTO H, JANSZEN M, et al. Restricted expression of p55 interleukin 2 receptor (CD25) on normal T cells[J]. Clin Immunol Immunopathol, 1990, 54(1): 126-133.


