Nature:中山七院何裕隆、张常华教授团队发表肿瘤耐药机制研究
时间:2024-07-14 09:00:21 热度:37.1℃ 作者:网络
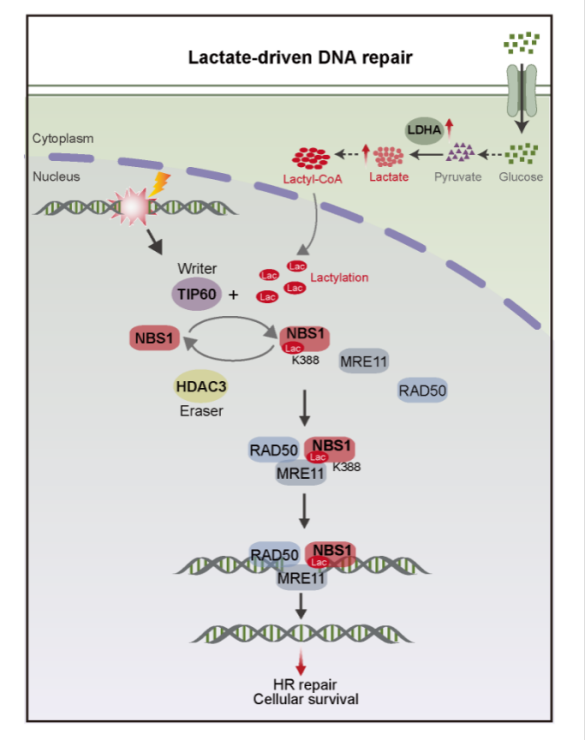
北京时间7月3日23时,《自然》杂志(Nature)刊登中山大学附属第七医院何裕隆、张常华教授团队主导的科研成果NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance。研究揭示了一种DNA修复蛋白(NBS1)蛋白乳酸化修饰在肿瘤化疗耐药中的关键调控作用,并创新性地提出了通过靶向抑制NBS1蛋白的乳酸化修饰或调控乳酸代谢通路,以逆转化疗耐药的全新方案。 张常华教授、尹东教授、Axel Behrens教授、何裕隆教授是论文的共同通讯作者,陈恒星博士、李贇博士、李华福博士是共同第一作者。 (研究成果在Nature刊发) 这是全球肿瘤疾病研究的一项重大突破性成果,不仅揭示了肿瘤细胞如何抵抗化疗产生耐药性,还筛选出能克服肿瘤细胞耐药性的靶向药物,为肿瘤免疫治疗、肿瘤放疗、肿瘤复发等问题研究开辟了新视角,将造福数以千万计的肿瘤耐药患者。 核心:阻断肿瘤细胞的耐药机制 肿瘤放化疗是治疗癌症的重要手段。在肿瘤放化疗治疗过程中,药物不断攻击肿瘤细胞,导致肿瘤细胞DNA双链发生断裂。DNA彻底断裂后,肿瘤细胞就会死亡。 但肿瘤细胞非常狡猾,它在受到化疗药物的攻击时,不会乖乖死亡,而是迅速升级防御系统,修复断裂的DNA。经过屡次交手后,肿瘤细胞对化疗药物的敏感性逐渐下降,也就是医生常说的“产生了耐药性”。一旦肿瘤细胞产生耐药性,就像穿上了“复活甲”,化疗药物虽有心杀贼却也无力回天。因此,肿瘤细胞的这种应变能力,使本就顽固的癌症变得更难对付。 如何为化疗耐药患者寻回生机?何裕隆、张常华教授团队通过大量实验发现,在DNA修复和化疗耐药中乳酸起着关键作用,相当于肿瘤细胞的“复活甲”,于是对其进一步研究,最终首次筛选出一种能够有效阻断这种耐药机制的靶向药物。 我们在这里报告乳酸驱动的 NBS1 乳酸化促进同源重组 (HR) 介导的 DNA 修复。NBS1 在赖氨酸 388 (K388) 处的乳酸化对于 MRE11-RAD50-NBS1 (MRN) 复合物的形成和 HR 修复蛋白在 DNA 双链断裂位点的积累至关重要。此外,我们将 TIP60 确定为 NBS1 赖氨酸乳酰转移酶和 NBS1 K388 乳酸化的“编写者”,将 HDAC3 确定为 NBS1 去乳酸酶。 NBS1 K388 乳酸化水平高预示着新辅助化疗的患者预后较差,而使用乳酸脱氢酶 A (LDHA) 的基因耗竭或司替戊醇(一种临床用于抗癫痫治疗的乳酸脱氢酶 A 抑制剂)来降低乳酸水平可抑制 NBS1 K388 乳酸化,降低 DNA 修复功效并克服对化疗的耐药性。总之,我们的研究确定了 NBS1 乳酸化是基因组稳定性的关键机制,有助于化疗耐药性,并确定抑制乳酸生成是一种有前途的癌症治疗策略。 其一是揭示了Warburg效应促进肿瘤生长、抵御外来损伤的作用。研究发现,肿瘤细胞通过糖酵解作用将葡萄糖转化为乳酸。这种乳酸修饰“乳酸化”的过程,会增强肿瘤细胞DNA的损伤修复能力。因此,每当肿瘤细胞受到放化疗损伤,它们都可以快速修复受损的DNA,从而降低放化疗的效果,导致耐药发生。 其二是发现了可应对Warburg效应的靶向药物。团队首次发现了一种能够阻断DNA损伤修复的靶向药物,即司替戊醇。这种药物能够抑制乳酸的产生和乳酸化过程,从而破坏肿瘤细胞的DNA修复机制,使它们重新对放化疗敏感。这一发现为临床治疗带来了新的希望,有望转化为有效的抗癌疗法。 (本研究的机制示意图) “100多年来,科学家们一直在讨论肿瘤有氧糖酵解的作用,却从未明确。我们这项研究回答了这个问题,即肿瘤细胞通过产生乳酸,使蛋白质进行乳酸化修饰,从而迅速修复肿瘤细胞DNA断裂的双链,促进自身修复和存活。”张常华教授说,“百年谜题终于找到了它的答案。” 另一个好消息是,研究发现的靶向药物司替戊醇在临床上的安全性已经明确。以往它是治疗儿童癫痫的常见药,这次属于“老药新用”。研究人员可以直接从剂量、适应证和有效性进行临床试验。 此外,由于研究还揭示了代谢与DNA修复之间的串联是细胞存活的一种普遍机制,因此这项研究虽然是针对胃癌进行,但分子机制适用于所有癌症。团队成员蔡楠博士认为,这项研究从临床中发现问题,并串联起“临床问题-基础研究-靶向药物-老药新用”的完整研究链条,将更易于进入临床转化阶段,使患者更早受益。 肿瘤的耐药机制一经阻断,化疗药物便能发挥作用,防止肿瘤细胞死灰复燃。这就是此项研究的核心要义。 原始出处: NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance,Nature . 2024 Jul 3. doi: 10.1038/s41586-024-07620-9