STTT:复旦大学袁正宏/占昌友等合作开发治疗乙型肝炎病毒感染的潜在新策略
时间:2024-06-26 19:00:51 热度:37.1℃ 作者:网络
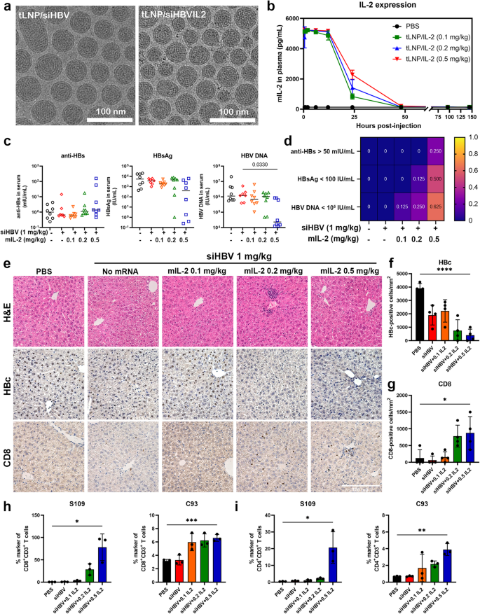
2024年6月21日,复旦大学袁正宏、占昌友及上海交通大学付炜共同通讯在Signal Transduction and Targeted Therapy发表题为“Optimized RNA interference therapeutics combined with interleukin-2 mRNA for treating hepatitis B virus infection”的研究论文,本研究旨在开发一种针对乙型肝炎病毒(HBV)的泛基因型和多功能小干扰RNA(siRNA),并具有治疗慢性乙型肝炎(CHB)的高效递送系统,并探索RNA干扰(RNAi)和免疫调节的联合方式,以更好地控制病毒。设计并评估了20个靶向分布在整个HBV基因组中的共识基序的合成siRNA,采用HO-PEG2000-DMG脂质,修改LNP处方中传统聚乙二醇(PEG)脂质的摩尔比,优化脂质纳米粒(LNP)处方。在rAAV-HBV1.3 小鼠模型中评估了该制剂递送siHBV(tLNP/siHBV)和小鼠IL-2(mIL-2)mRNA(tLNP/siHBVIL2)的疗效和安全性。
选择基因型覆盖率为 98.55%的siRNA组合,对其进行化学修饰,并将其封装在高效、高安全性的优化 LNP(tLNP)中,以制备CHB治疗制剂。结果显示,tLNP/siHBV显著降低了病毒抗原和DNA的表达,在单剂量或多剂量频率下以剂量和时间依赖性方式进行,具有令人满意的安全性。进一步的研究表明,tLNP/siHBVIL2通过RNA引入有效的 HBsAg 清除并通过表达的mIL-2 蛋白触发强烈的HBV特异性CD4+ T和CD8+T细胞反应,从而实现病毒的附加抗原和免疫控制。通过采用tLNP作为核酸纳米载体,siHBV和mIL-2 mRNA的共同递送能够协同抗原和免疫控制HBV,从而为治疗CHB提供了一种有前途的转化治疗策略。

乙型肝炎病毒(HBV)感染可导致慢性乙型肝炎(CHB)、肝纤维化、肝硬化和肝细胞癌(HCC);然而,治疗选择是有限的。HBV基因组是一个紧凑的3.2 kb环状、部分双链、松弛的环状 DNA(rcDNA)。一旦进入细胞核,rcDNA就会被内源性酶修复成共价闭合环状 DNA(cccDNA),该环状DNA编码四个重叠的开放阅读框 (ORF),包括核心抗原 (HBcAg)、表面抗原(HBsAg)、e抗原(HBeAg)和 X 蛋白(HBx)。所有 HBV转录本都具有共同的3'末端,并共享相同的多聚腺苷酸化信号(PAS)。此外,复制能力不全的HBV线性片段可以整合到宿主基因组(intHBV)中,是HBeAg阴性患者HBsAg的主要来源。高循环HBV抗原水平,尤其是HBsAg,有助于免疫耐受和病毒持久性。由于无法完全治愈,因此 CHB 的治疗目标是通过有限疗程的治疗实现 HBsAg 血清清除,即“功能性治愈”。
RNA干扰(RNAi)技术在治疗遗传病和病毒感染疾病方面显示出前景。它也被认为是一种有吸引力的治疗方式,通过诱导抗原抑制、减少病毒血症和 cccDNA 沉默来实现 CHB 的功能性治愈。基于siRNA的疗法还可以缓解高病毒抗原诱导的免疫耐受性,从而有机会通过随后的免疫刺激获得对病毒的免疫控制。然而,考虑到 10 种不同基因型(A到J)之间极高的遗传多样性,设计针对 HBV 等复杂病毒的功能性小干扰 RNA(siRNA)具有挑战性。设计用于靶向 HBV 基因型中保守区域的 siRNA 可以通过计算预测实现,并有望抵抗潜在的病毒突变逃逸,而靶向 cccDNA 衍生转录本共享的常见 3′-末端序列的 siRNA 可能会丢失 intHBV 衍生转录本上的靶标。使用旨在解决 cccDNA和 intHBV 驱动合成的 siRNA 触发器的进一步研究有望在功效和功能方面超过以前的药物。
tLNP/siHBVIL2在rAAV-HBV1.3小鼠模型中的相加抗病毒疗效(图源自Signal Transduction and Targeted Therapy )
RNAi疗法的临床应用受到与肝脏靶向递送系统相关的挑战的阻碍。凭借新开发的GalNAc((N-乙酰半乳糖胺)技术和用于肝脏特异性递送的脂质纳米颗粒的优势,基于siRNA的药物,在临床上可用。然而,也存在“PEG困境”。PEG比率影响LNP在体内的性能。尽管PEG的免疫原性较弱,但一定比例的人类可能会产生低水平的PEG特异性抗体,导致聚乙二醇化纳米药物的加速清除和疗效降低。末端聚乙二醇化基团影响PEG的免疫原性,羟基PEG的免疫原性低于甲氧基聚乙二醇。此外,研究小组最近发现羟基-PEG的抗原性比甲氧基-PEG弱。羟基-PEG可以避免人血中预先存在的抗PEG抗体的结合,从而减少补体活化,从而使LNPs逃避抗体识别和快速清除。
虽然RNAi和抗体介导的HBsAg清除可以通过降低病毒负荷来消除免疫功能障碍,但它们不能激活病毒特异性T细胞来实现长期病毒控制。在临床上,只有极少数患者产生抗HBsAg抗体,停药后病毒抗原恢复。最近,临床前和临床研究一直在研究新的联合策略,以实现更好的治疗结果。研究认为,RNAi同时抑制病毒载量和IL-2增强宿主免疫可能足以打破免疫耐受并重建抗病毒免疫。
在本研究中,筛选并化学修饰了一种针对所有形式的 cccDNA 和 intHBV 衍生转录本的泛基因型和多功能siRNA组合(siHBV),并验证了其在多种细胞培养和小鼠模型中的疗效和安全性。利用具有低抗原性和高疗效的优化LNP平台(tLNP)来定义siHBV在控制HBV转录和复制中的作用,并评估其安全性。利用tLNP包封不同形式核酸的可行性,将siHBV和小鼠IL-2(mIL-2)mRNA共递送至单一tLNP制剂中,获得病毒的抗原和免疫控制,研究预计基于tLNP的siHBV和mIL-2 mRNA共递送可能为治疗CHB提供一种可行的方法。
参考消息:
hhttps://doi.org/10.1038/s41392-024-01871-8


