戚锐锋/王浩:NRAS突变型恶性黑色素瘤多线治疗个案分析
时间:2024-06-18 19:00:18 热度:37.1℃ 作者:网络
编者按:恶性黑素瘤是容易转移、恶性程度较高的一种皮肤肿瘤。近年来,人们对恶性黑素瘤的认识逐渐提高,同时免疫治疗、靶向治疗等新治疗手段的不断增加,中国黑色素瘤的诊疗规范化逐步完善,预后有明显提升,但仍存在早期诊断率低,治疗手段滞后,患者预后差等问题。现将巴州医院的一例NRAS突变型肢端黑色素瘤多线治疗的病例分享给大家!
本期「专家组稿」由河北医科大学第四医院崔彦芝教授担任执行主编,与巴州人民医院戚锐锋教授、王浩医生共同分享NRAS突变型肢端黑色素瘤多线治疗的病例报道,为医者和患者提供更多参考。
基本情况:患者女性,56岁,汉族,于2015-11-12行右足底浅表肿物切除术。
术后病理:(右足)皮肤恶性黑色素瘤,肿瘤浸润深度0.4cm一侧切缘皮肤见肿瘤组织,肿瘤距足底最近切缘小于0.1mm。
诊断:右足底恶性黑色素瘤。
2015-12-02行右足底皮肤病损切除术(皮肤黑色素瘤扩大切除术)+取皮植皮术,
术后病理示:(右足底黑色素瘤扩切标本)病变符合恶性黑色素瘤,肿瘤侵及皮下组织,肿瘤最大径3.5cm,趾侧、足跟、外侧、内侧切缘及基底未见肿瘤组织。术后给予干扰素a-2b *11个月。
2018-01发现右侧右侧腹股沟区肿大淋巴结,2018-01-15行“右侧腹股淋巴结快速冰冻活检+右侧腹股沟淋巴结清扫术”;
术后病理提示:(右侧腹股沟淋巴结)可见肿瘤转移(1/1)。原手术残腔、皮肤及基底切缘未见肿瘤组织,未见明确淋巴结结构;另送(柯氏淋巴结)淋巴结未见肿瘤转移(0/1)。
2018-03-06开始右侧腹股沟强调放疗,同时应用重组人干扰素α-2b*8个月。2018-11停药。
停药后半年右侧腹股沟区出现多个肿块,蔓延至右腿,未诊疗,肿块长期破溃不愈。
2022-01-08右侧大腿浅表肿物切检病理:(右下肢)梭形细胞肿瘤,基底未见病变残留,近切缘可见病变残留。免疫组化:CD34(-),CK(Pan)(-),Desmin(-),HMB45(+),ki-67指数约(5%),SMA(-),SOX10(+),Vimentin(+)。支持恶性黑色素瘤,诊断:(右下肢)皮下转移性恶性黑色素瘤。
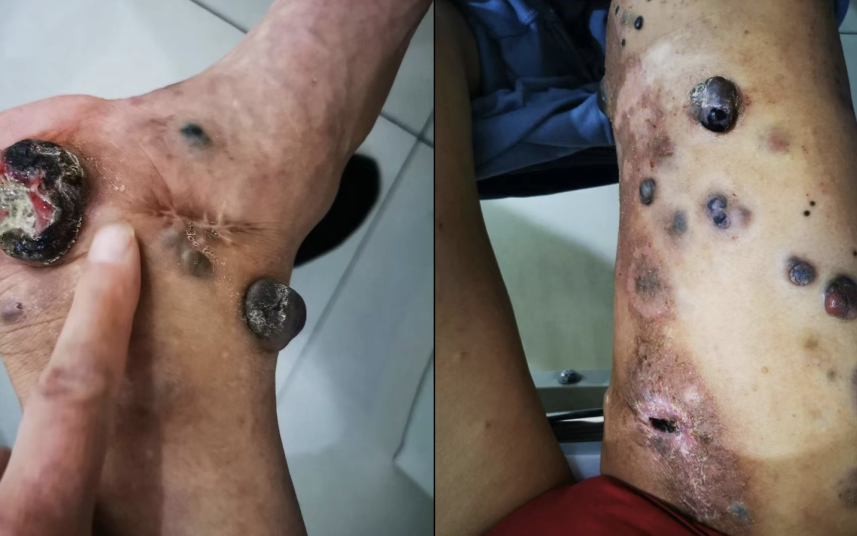
2022-01肿瘤供血动脉栓塞,开始特瑞普利单抗*12次,后当地治疗。
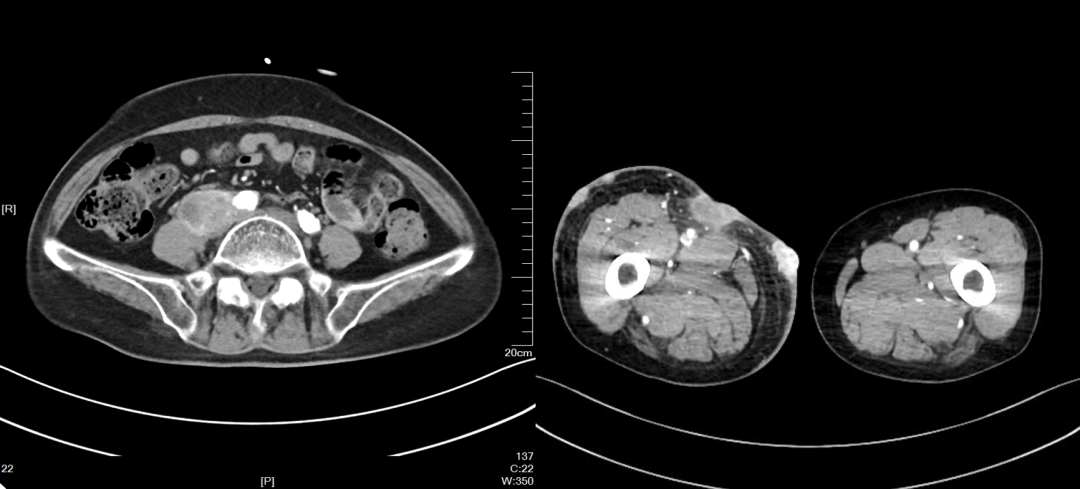
2022-04-12
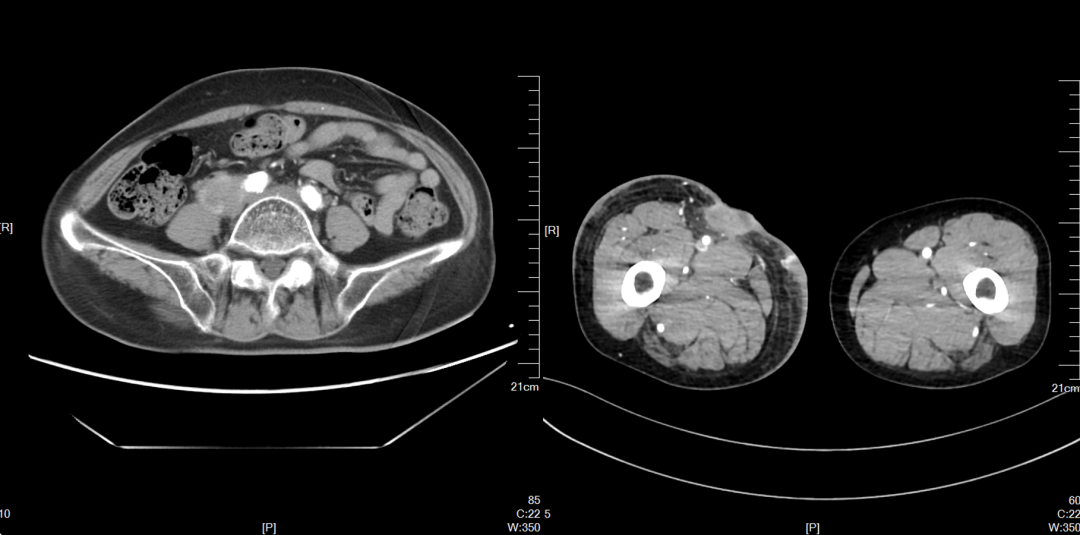
2022-07-21(SD)
2022-12 CT提示病情缓慢进展,疗效评价SD。继续:特瑞普利单抗。
完善基因检测:NRAS p.Q61K(30.8%)突变;BRAF V600突变阴性
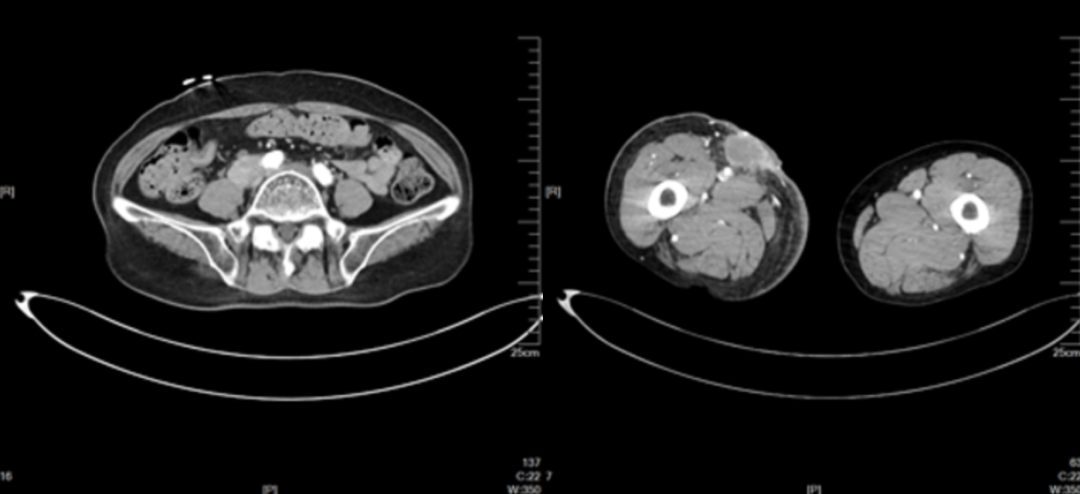
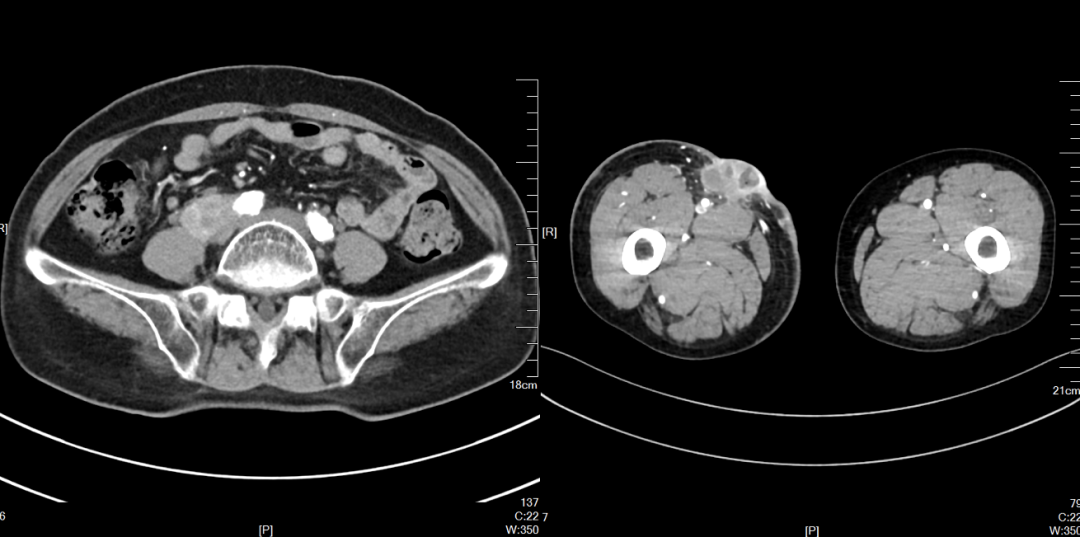
2022-12(病情缓慢进展)
2023-05 CT 提示腹膜后、双侧髂血管旁及左侧腹股沟区多发肿大淋巴结、部分融合,较前明显增多、增大,右侧股骨近端层面皮下多发转移灶,较前增大。评价PD。
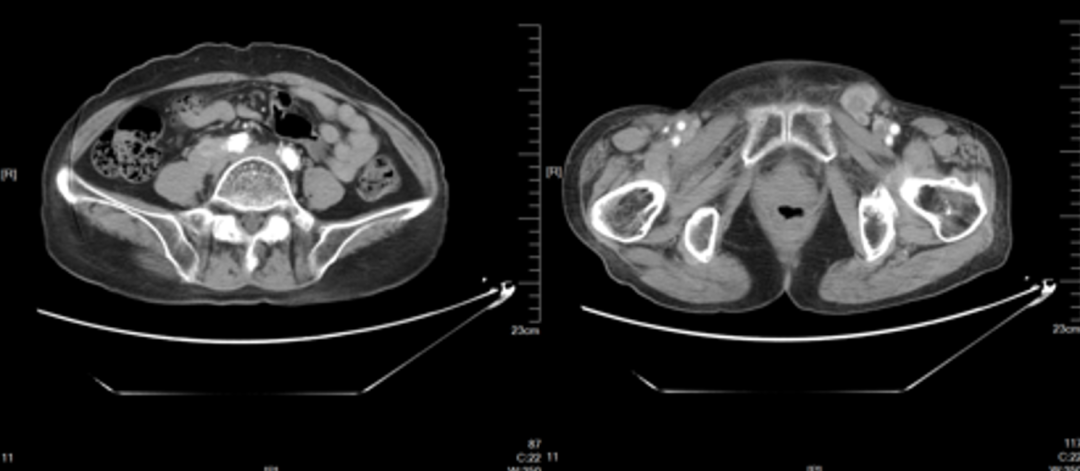
2023-05
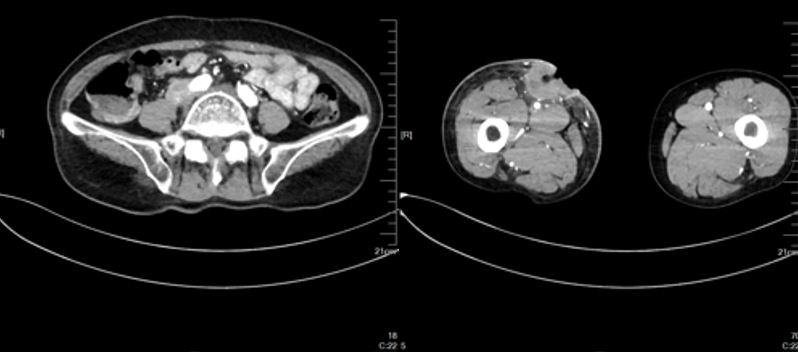
2023-08
二线:靶向+免疫:仑伐替尼+特瑞普利单抗。2023-08CT提示淋巴结转移灶较前缩,但出现药物性心功能不全(射血分数67%降至47%)。调整方案为:特瑞普利单抗+贝伐珠单抗。
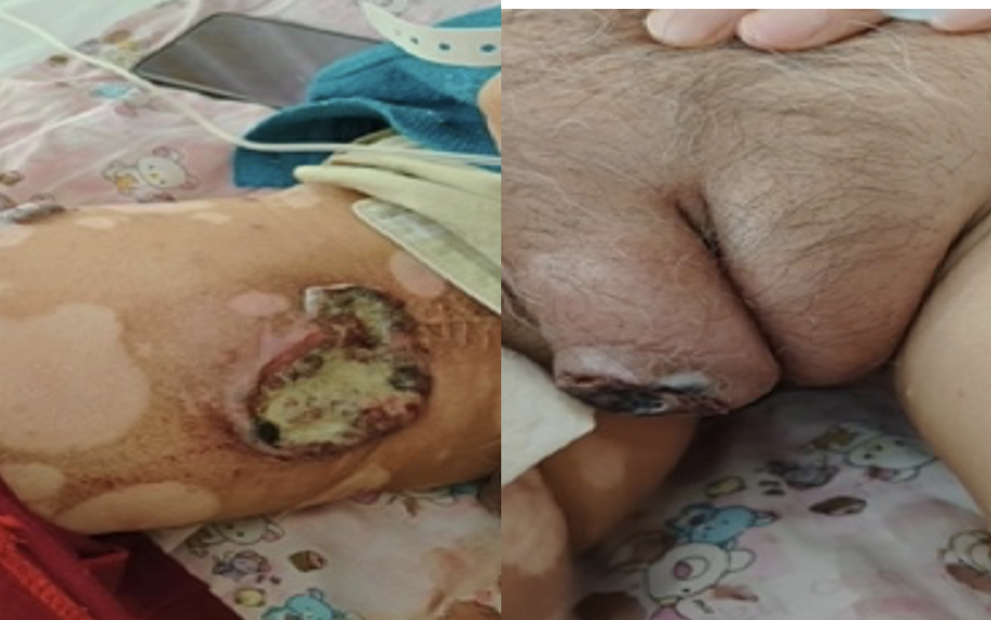
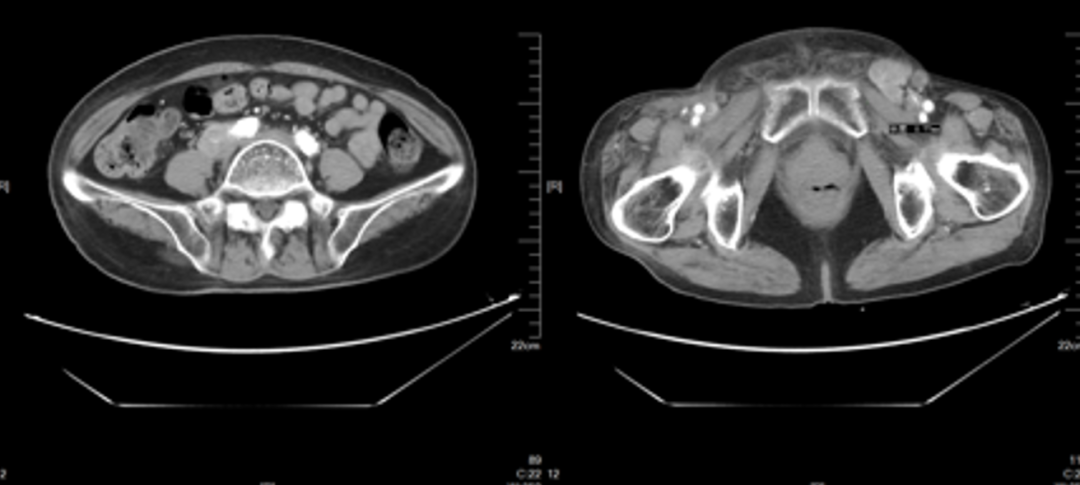
2023-11-06(PD,增大,出现新发病灶)
2023-11-06复查CT,腹腔淋巴结、左侧腹股沟区病变增大,外阴新发病灶。下肢肿胀加重。
于2023-11-10 免疫+化疗:特瑞普利单抗+达卡巴嗪 *4周期。
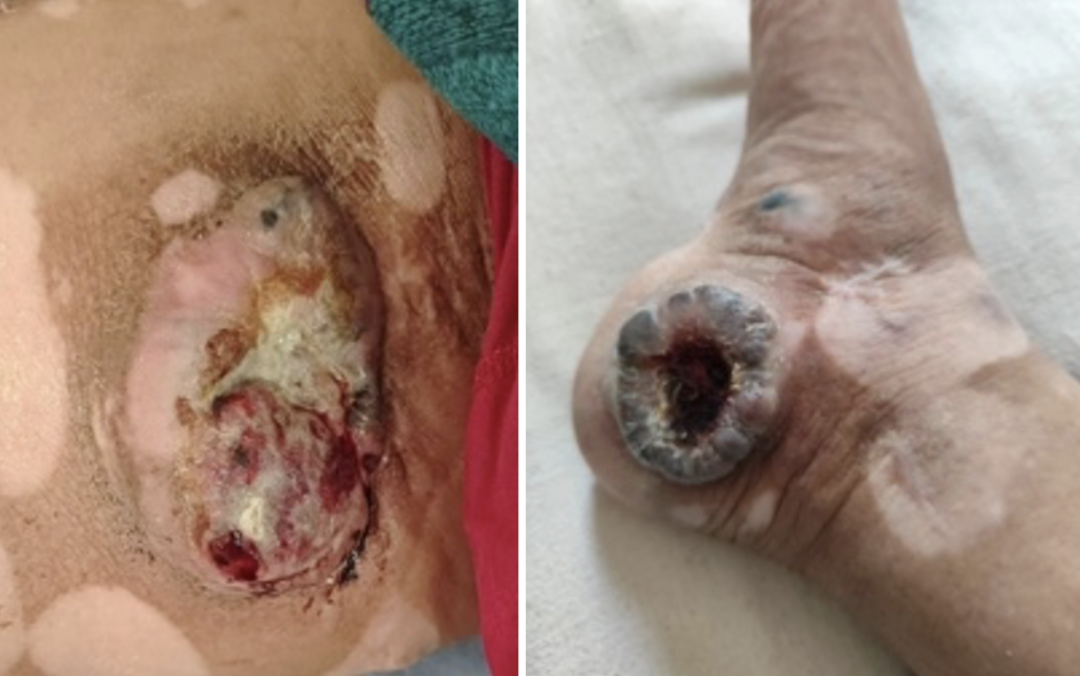
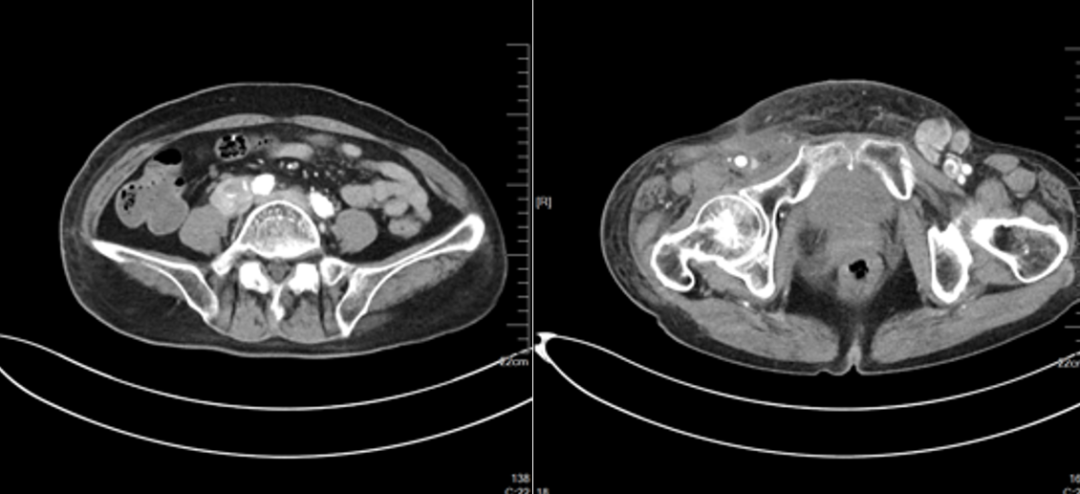
2024-03-30(评估病情进展,下肢病灶增大,腹腔淋巴结增大,下肢肿胀加重)
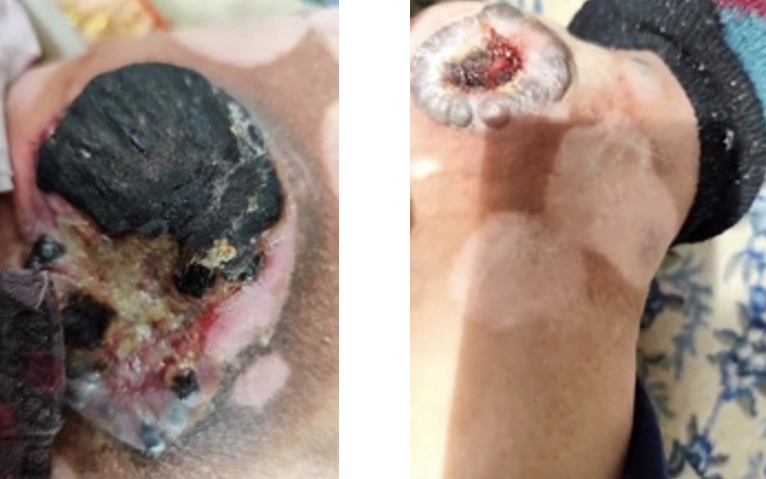
2024-04-01调整治疗方案:特瑞普利单抗+替莫唑胺+阿帕替尼;(建议妥拉美替尼)
讨论
1、本例患者为肢端黑色素瘤
肢端型黑色素瘤和黏膜型黑色素瘤是亚洲常见的亚型,中国的黑色素瘤中一半是肢端型,1/4是黏膜型,而美国的肢端加黏膜型黑色素瘤占总体的比例还不到5%,东西方患者特征与预后也存在多方面的差异。早期黑色素瘤的活检有局部活检及全切活检,一般建议全切活检。治疗涉及到手术、放射治疗、药物治疗等多方面,诊治必须重视多学科诊疗团队的模式,根据分期制定相应治疗策略。手术是治疗的基石,国内已经发布《皮肤及肢端恶性黑色素瘤外科诊治中国专家共识》[1],通过规范外科切除让患者获益最大化。对于复发风险较高的黑色素瘤患者,需要术后辅助治疗,来降低患者复发转移风险。术后分期主要根据原发灶肿瘤浸润的厚度、区域淋巴结转移的状态,是否存在远处转移三个方面。分期对后续治疗至关重要,不同分期,术后辅助治疗策略不同。I期患者推荐临床实验或观察。II期患者,尤其是IIb和IIc期的患者预后较差,需要有效的辅助治疗策略;过去一般采用大剂量的干扰素进行术后辅助治疗,目前可以建议患者进行观察或者参加临床试验。我国肢端黑色素瘤相对较多,这类肿瘤的肿瘤浸润淋巴细胞水平相对低,对免疫治疗的反应率可能会比较差,因此,肢端黑色素瘤的辅助治疗大剂量干扰素仍为推荐方案,PD-1单抗缺乏大规模循证医学证据。同时分子诊断也非常重要,诸如BRAF、c-KIT和NRAS等基因突变检测,将为后续治疗方案的制定奠定基础。晚期患者最初借助化疗、细胞因子治疗等手段,如今免疫、靶向等治疗药物陆续研发上市,治疗格局出现了翻天覆地的变化。常用的治疗药物包括大剂量干扰素α2b 治疗,BRAF 抑制剂±MEK 抑制剂(BRAF 突变)、PD-1单抗、CTLA4单抗等。
2、本患者为NRAS突变型肢端黑色素瘤
众所周知,黑色素瘤的发生、发展与多种癌基因激活密切相关。15%~20%的患者存在NRAS基因激活突变,多发生于第61位密码子,以Q61R为主,侵袭性强,治疗难度大。针对NRAS突变的晚期黑色素瘤患者的治疗,目前NCCN指南一线推荐是免疫治疗,二线如果患者检测出NRAS突变,则推荐MEK抑制剂比美替尼,推荐理由主要基于比美替尼在NRAS突变的一项III期关键研究,相比达卡巴嗪,比美替尼能获得更长的PFS,分别是2.8个月 vs 1.5个月,P<0.001; 而OS没有明显获益,分别是11.0个月vs10.1个月,P=0.05。因中西方人群种群差异,中国患者对免疫治疗的应答不佳, ORR仅为6.1%,因此与西方不同,中国CSCO黑色素瘤诊疗指南一线推荐化疗,免疫治疗或者化疗联合免疫治疗,二线如果有NRAS突变的患者,将妥拉美替尼(HL085)纳入I级推荐。
近年来,在NRAS突变亚型中靶向治疗方案的探索主要集中在NRAS下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,但结果不一;新型MEK1/2抑制剂妥拉美替尼(tunlametinib),在晚期NRAS突变患者中总体客观缓解率(objective response rate,ORR)达到34.7%,较既往的binimetinib显著提高[2];其中,既往接受过免疫治疗患者的ORR达39.1%;中位PFS为4.2个月,DCR为72.6%,1年OS率为57.2%。在安全性方面,最常见的≥3级TRAE包括血肌酸激酶升高、腹泻、水肿等,耐受性良好,未发现新的安全性信号。2024年3月15日,妥拉美替尼获得中国国家药品监督管理局(NMPA)的附条件批准,用于治疗含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。据新闻稿,这是目前首个获批NRAS突变晚期黑色素瘤适应证的MEK抑制剂。其他单药靶向治疗及联合治疗策略正在探索中,总之,目前针对NRAS突变型黑色素瘤的靶向和免疫治疗方案均未能媲美BRAF抑制剂在BRAF突变型病例中达到的治疗反应率,但近年来基于MEK抑制剂的部分联合治疗策略已经取得喜人的进展[3]。本患者后续有条件拟行妥拉美替尼治疗。
点评
准确的分期对黑色素瘤的预后和治疗至关重要。指南基于AJCC分期给予了相应的治疗推荐,规范的病理报告对于黑色素瘤规范化治疗非常重要,并强调了微卫星灶及SLNB对疾病分期的价值。早期黑色素瘤确诊后应尽快进行手术切除。术前新辅助和术后辅助治疗可降低患者术后复发风险。晚期黑色素瘤治疗手段包括辅助化疗、干扰素治疗、靶向治疗和免疫治疗。中国以肢端和黏膜型黑色素瘤为主,这类患者对免疫治疗反应的敏感性较差,这一现状给予了我们巨大的挑战。《2021 CSCO黑色素瘤诊疗指南》建议所有的黑色素瘤患者在治疗前都要进行基因检测,包括BRAF、c-KIT和NRAS,进行分子分型。依靠分子诊断的个体化靶向药物包括但不仅限于C-kit抑制剂、BRAF抑制剂、MEK抑制剂等,给携带这些特定基因突变的患者带来了新的治疗方案选择。分子检测、药物可及性及经济负担限制了这些药物的应用,随着医保及分子检测的普及,将迎来黑色素瘤治疗的新篇章。
参考文献:
1.皮肤和肢端恶性黑色素瘤的外科治疗规范中国专家共识,[J]中华肿瘤杂志, 2020,42(02) : 81-93.
2.DUMMER R, SCHADENDORF D, ASCIERTO P A, et al. Binimetinib versus dacarbazine in patients with advanced NRAS-mutant melanoma (NEMO): a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2017, 18(4):435-445.
3.MAO L, GUO J, ZHU L, et al. A first-in-human, phase 1a dose-escalation study of the selective MEK1/2 inhibitor FCN-159 in patients with advanced NRAS-mutant melanoma[J]. Eur J Cancer, 2022, 175: 125-135.


