Cell Death and Disease:新机制揭示USP3如何促进骨肉瘤进展?
时间:2024-06-12 19:00:28 热度:37.1℃ 作者:网络
骨肉瘤(OS)是儿童和青少年中最常见的恶性骨肿瘤,尽管近年来治疗技术的进步显著提高了非转移性OS患者的生存率,但转移性OS患者的生存率仍然较低。OS具有高侵袭性和远处转移的倾向,特别是肺转移。因此,深入理解OS的分子机制,特别是那些促进肿瘤进展和转移的分子,对于开发新的治疗策略至关重要。
近日,由 Anan Li 和 Shijiang Wang 等人发表于 Cell Death and Disease 题为 USP3 promotes osteosarcoma progression via deubiquitinating EPHA2 and activating the PI3K/AKT signaling pathway 的文章, 通过泛素组学,确定EPHA2为USP3的下游靶标,USP3通过去泛素化EPHA2并影响其稳定性,激活PI3K/AKT信号通路,从而影响骨肉瘤的进程。

研究团队首先通过生物信息学分析和实验验证发现,USP3在骨肉瘤组织中的表达水平显著高于正常骨组织,并且高表达的USP3与骨肉瘤患者的不良预后相关。
USP3(Ubiquitin-Specific Protease 3)是一种关键的含有催化域和锌指结构的去泛素化酶。能够通过逆转泛素化过程影响下游目标蛋白的稳定性,从而影响细胞的多种生物学过程,如细胞增殖、细胞周期和DNA损伤修复。USP3已在多种癌症中被发现参与肿瘤的进展
在细胞水平上,USP3的过表达促进了骨肉瘤细胞的增殖、迁移和侵袭,而USP3的敲低则抑制了这些过程。
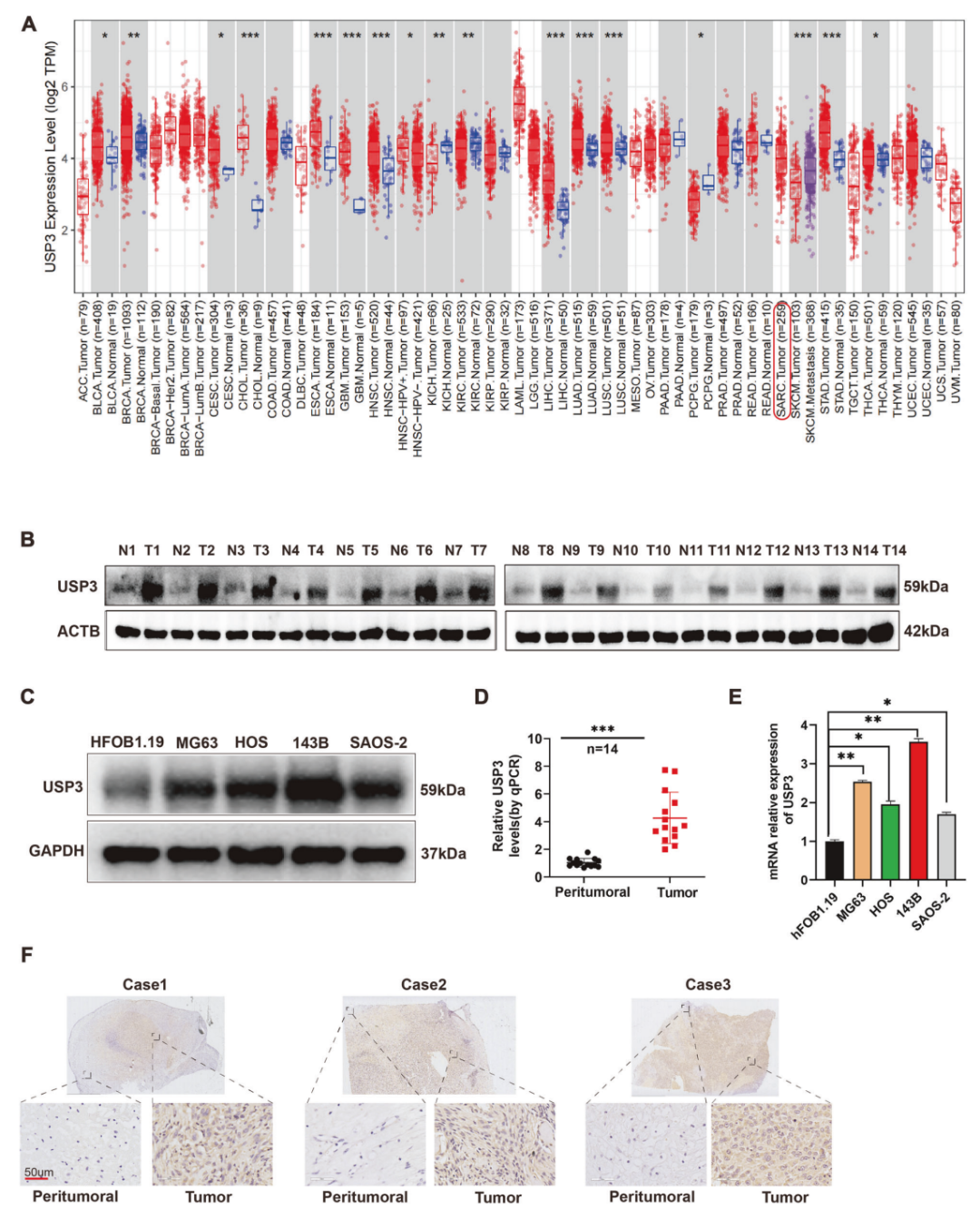
图1. USP 3在OS组织中表达高于正常骨组织,且高表达与不良预后相关。通过免疫组化分析,进一步证实USP3在OS组织中的过表达
进一步的机制研究揭示,USP3通过去泛素化(泛素化是蛋白质降解标记)作用稳定EPHA2,阻止其被降解。EPHA2是受体酪氨酸激酶家族的一员,与多种肿瘤的生长和转移有关。稳定的EPHA2激活PI3K/AKT信号通路。PI3K/AKT通路是细胞生长、存活和迁移的关键调节器,其异常激活促进肿瘤进展。
通过构建分子对接模型,研究者确定了USP3中203位氨基酸残基在与EPHA2相互作用中的关键作用,并发现K882和K945是EPHA2的关键泛素化位点,受USP3调控。
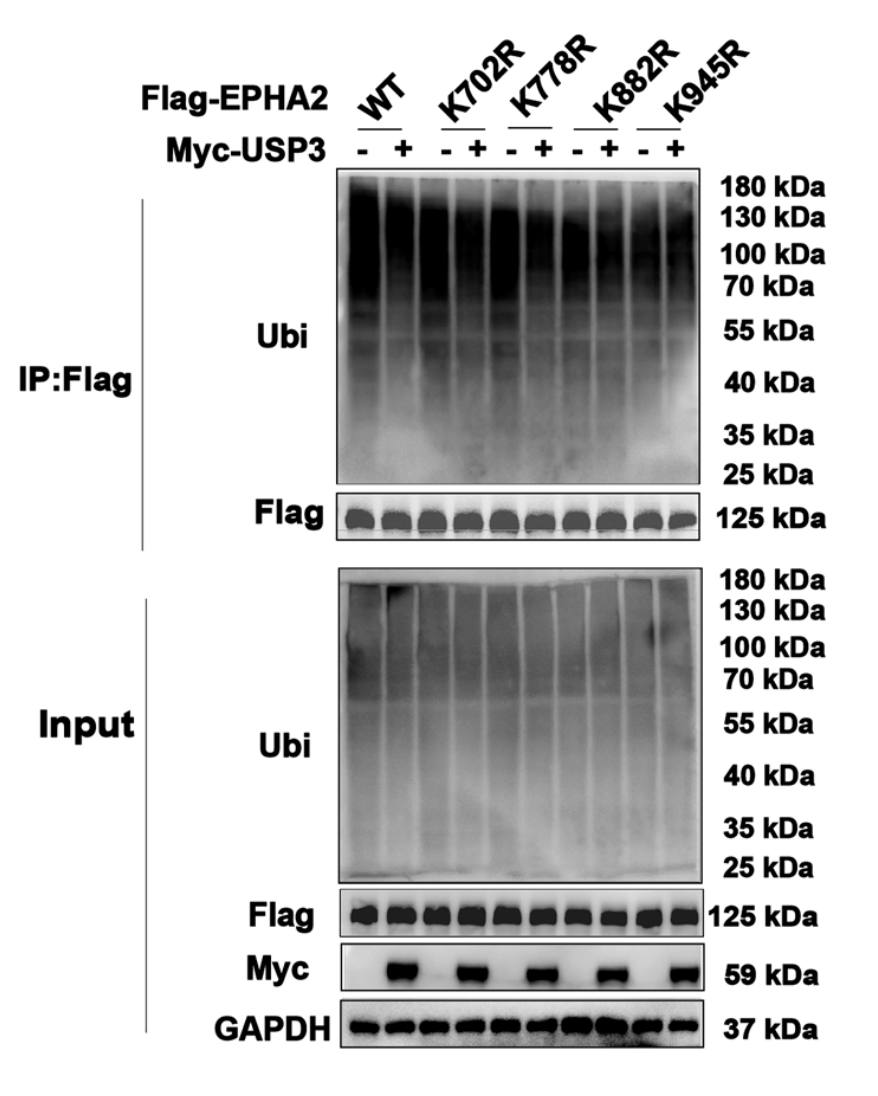
图2. 四种位点特异性突变体之一(K702 R、K778 R、K882 R和K945 R)转染的HEK 293 T细胞处理后,EPHA2结构的泛素化水平,确定USP3和EPHA2相互作用的关键位点。
此外,研究还发现,EPHA2的高表达与骨肉瘤的不良预后相关,且其通过激活PI3K/AKT信号通路促进骨肉瘤细胞的增殖、迁移和侵袭。且USP3过表达导致骨肉瘤细胞对化疗药物(如顺铂)的耐药性增强,在小鼠模型中,敲低USP3显著抑制了骨肉瘤的生长和肺转移。
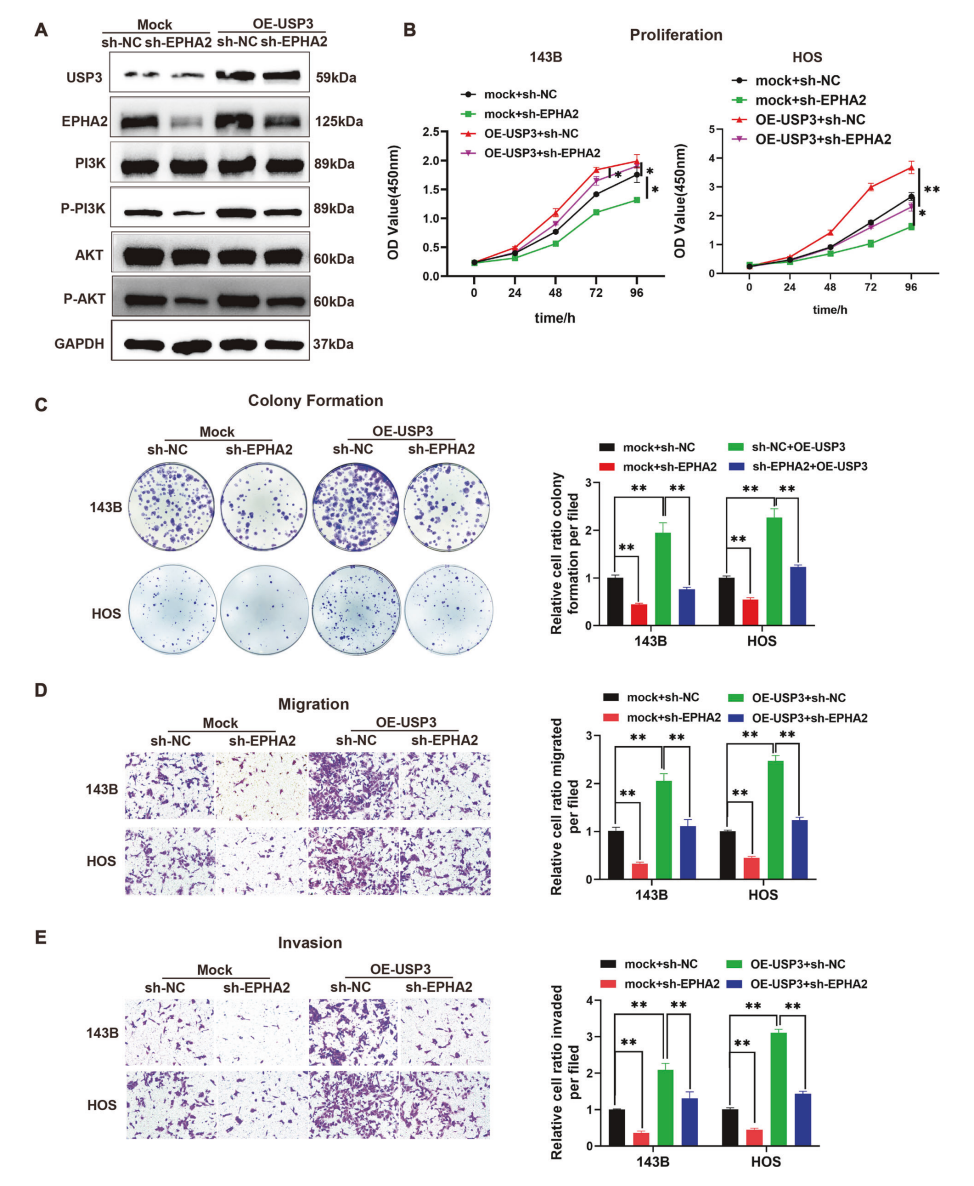
图3. USP 3通过调节EPHA 2和激活PI 3 K/AKT信号通路促进骨肉瘤的增殖、迁移和侵袭和对化疗药物的敏感性,以及在体内抑制肿瘤生长和肺转移。
综上所述,该研究揭示了USP3通过稳定EPHA2并激活PI3K/AKT信号通路促进骨肉瘤进展的新机制。文章中指出USP3/EPHA2轴的异常可能在骨肉瘤的恶性化中起关键作用,提示USP3/EPHA2轴可能成为骨肉瘤治疗的新靶点。抑制UPS3或EPHA2的活性可能抑制骨肉瘤的生长和转移,改善患者预后。
未来的研究需要进一步验证USP3抑制剂在临床应用中的效果,以及探索USP3和EPHA2相互作用的精确分子机制,以优化治疗策略。此外,还需要在更大规模的患者群体中验证USP3和EPHA2的表达水平与OS预后的关系,以及在不同OS亚型中的作用。

