GUT:蛋白质生物标志物和替代无细胞DNA甲基化组序列测定的早期胰腺癌
时间:2023-12-18 09:55:09 热度:37.1℃ 作者:网络
胰腺癌是全球癌症死亡的主要原因。这种高死亡率在很大程度上来自>80%的患者,他们患有无法治愈的局部晚期或转移性疾病。相比之下,患有早期疾病的患者可以通过多模式治疗并实现长期存活。胰腺导管腺癌(PDAC)的早期检测仍然很困难。该疾病几乎没有早期预警症状,渗透率高的风险因素也很少。到目前为止,有强烈家族史或遗传倾向的患者和胰腺囊性病变的患者一直是早期检测计划的主要重点。
这些计划主要使用腹部核磁共振和内窥镜超声来连续评估胰腺癌症的发展。基于血液的早期检测方法可能允许识别那些从成像或内窥镜手术中获益最大的患者。循环碳水化合物抗原19-9(CA19-9)通常被用作PDAC中治疗反应的标记,但它也可能作为“安羕”标记的效用,可以为早期癌症检测添加进一步的血液技术。因此,研究人员试图开发一个循环标记小组,包括CA19-9,并可用于筛查环境来评估胰腺癌的无症状个体。
最近的研究评估了血浆中无细胞DNA(cfDNA)的突变,将其作为早期癌症存在的生物标志物。这种方法对胰腺癌的检测具有吸引力,因为约90%的这种恶性肿瘤患者在癌基因KRAS中存在点突变。然而,到目前为止,在cfDNA中检测驱动基因突变对早期恶性肿瘤的敏感性不大。
此外,识别KRAS等基因的突变并不能识别恶性肿瘤的组织起源,因为突变基因是跨肿瘤类型共享的。cfDNA中的致癌突变也可能反映非恶性条件,如克隆造血。提高早期癌症检测的敏感性并协助确定恶性起源部位的潜在方法利用组织特异性DNA甲基化模式。
与鸟嘌呤(CpG位点)相邻的胞嘧啶的甲基化是基因表达的基本决定因素,可以作为细胞身份的确定标志物。因此,从具有组织特异性甲基化模式的基因组位点衍生的cfDNA分子可用于识别特定细胞类型对cfDNA的相对贡献,并估计特定组织中的细胞死亡率。因为组织特异性甲基化标记主要在致癌转化上保持,cfDNA甲基化评估可以为检测和确定生长中癌症的起源组织提供强大的工具。最近,几项研究检查了循环cfDNA的甲基化改变,以检测单一癌症类型或多癌症检测。

鉴于将cfDNA检测添加到多标记面板中以进行无症状PDAC检测的潜在效用,2023年12月13日发表在GUT的文章,评估了三种蛋白质标记(CA19-9,TIMP1,LRG1),来自cfDNA的KRAS突变,以及来自cfDNA的外分泌胰腺特异性甲基化标记在PDAC病例和对照组中。在400多名患者中,本文展示了将蛋白质标记与cfDNA组织特异性甲基化措施相结合在检测早期PDAC方面的实用性。
为了评估培训、测试和验证患者队列(总n=426名患者)中的循环标记差异,测量PDAC病例和慢性胰腺炎、结直肠癌(CRC)和健康对照组患者的血浆标记。使用CA19-9作为锚标记,在包括61个CpG位点的9个位点测量了两个蛋白质标记(TIMP1、LRG1)和无细胞DNA(cfDNA)胰腺特异性甲基化。
研究结果显示,比较甲基组分析确定了9个在外分泌胰腺DNA中差异甲基化的位点。在训练集中(n=124名患者),cfDNA甲基化标记将PDAC与健康和CRC对照区分开来。在86个早期阶段PDAC和86个匹配的健康对照组的测试中,CA19-9在接收器操作特征曲线(AUC)下的面积为0.88(95%CI 0.83至0.94)。
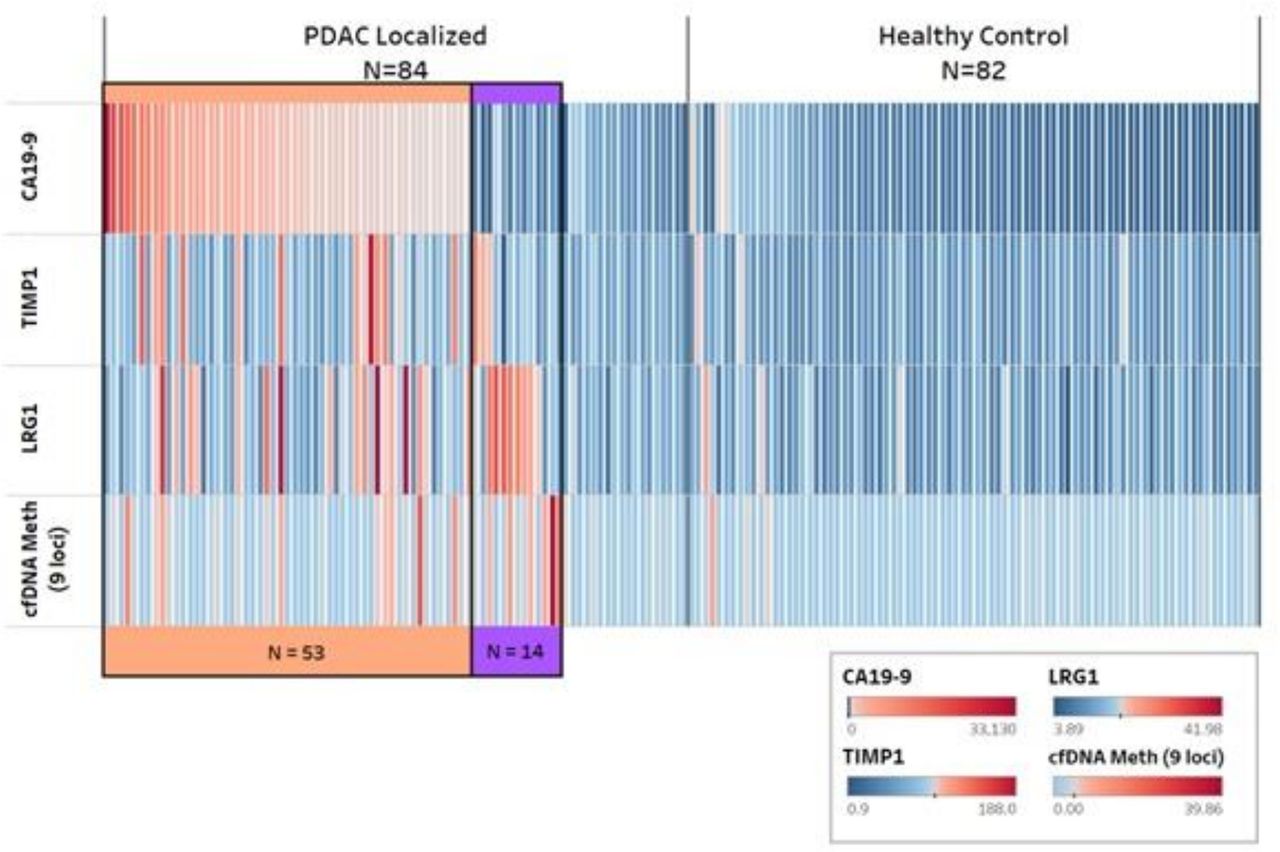
测试集中蛋白质和无细胞DNA标记对早期胰腺癌和健康对照的累积阳性
通过添加TIMP1(AUC 0.92;95%CI 0.88至0.96;p=0.06)、LRG1(AUC 0.92;95%CI 0.88至0.96;p=0.02)或9个位点(AUC 0.92;95%CI 0.88至0.96;p=0.02)的外分泌胰腺特异性cfDNA甲基化标记而增加。
在40个早期PDAC和40个匹配的健康对照组的验证中,包括CA19-9、TIMP1和9位点cfDNA甲基化面板在内的组合面板的鉴别性(AUC 0.86,95%CI 0.77至0.95)比CA19-9单独(AUC 0.82;95%CI 0.72至0.92)的鉴别性更大。
综上所述,与单独使用血浆CA19-9相比,循环cfDNA中蛋白质标志物和胰腺特异性甲基化的组合检测可能会改善早期阶段局部PDAC检测的辨别。需要进行更多研究,以确定这种方法和其他上述方法是否可以导致在普通人群或高风险人群中诊断无症状的早期PDAC,并降低这种高致死性恶性肿瘤的死亡率。
原始出处
Ben-Ami R, Wang Q, Zhang J, et al Protein biomarkers and alternatively methylated cell-free DNA detect early stage pancreatic cancer Gut Published Online First: 13 December 2023. doi: 10.1136/gutjnl-2023-331074


