【Leukemia】综述:AML基于MRD状态的抢先治疗
时间:2024-11-22 15:01:21 热度:37.1℃ 作者:网络
在急性髓系白血病(AML)中,将可测量残留病(MRD)用作预后、风险分层和治疗决策的生物标志物越来越重要,MRD定义为白血病细胞持续存在但低于形态学检测的阈值。MRD评估可以基于外周血或首次抽取的骨髓穿刺液,可以在不同的时间点进行,包括初始治疗后、治疗期间和治疗完成后。
目前采用多种技术评估AML中的MRD,包括基于白血病相关免疫表型(LAIP)或different from normal(DfN)法的多参数流式细胞术(MFC),以及聚合酶链反应(PCR)和二代测序(NGS)等分子技术。这些技术在检测MRD方面有不同的灵敏度、优势和缺点,往往有助于临床决策。MRD阴性与长期生存率相关,AML强化疗后及异基因造血干细胞移植(allo-HCT)前持续存在 FLT3-ITD MRD与复发风险增加和生存率降低有关,allo-HCT前的 MRD 是allo-HCT后结局(包括复发和死亡)的独立风险因素;使用PCR技术对 NPM1 突变和核心结合因子 AML 进行 MRD 监测以评估强化疗后的疾病也得到广泛应用。
除此之外,基于MRD的抢先(pre-emptive)治疗决策也在AML中不断发展,即对MRD阳性进行预防性干预,这已超出其初始的预后功能。在 AML 中使用创新治疗策略靶向 MRD 可改善患者预后,但需要进行大规模且精心设计的临床试验来验证其预后价值和对治疗的影响。
《Leukemia》近日发表综述“Pre-emptive therapeutic decisions based on measurable residual disease status in acute myeloid leukemia: ready for prime time?”,探讨了AML临床决策中如何考虑MRD动力学和的反应深度(图1)。
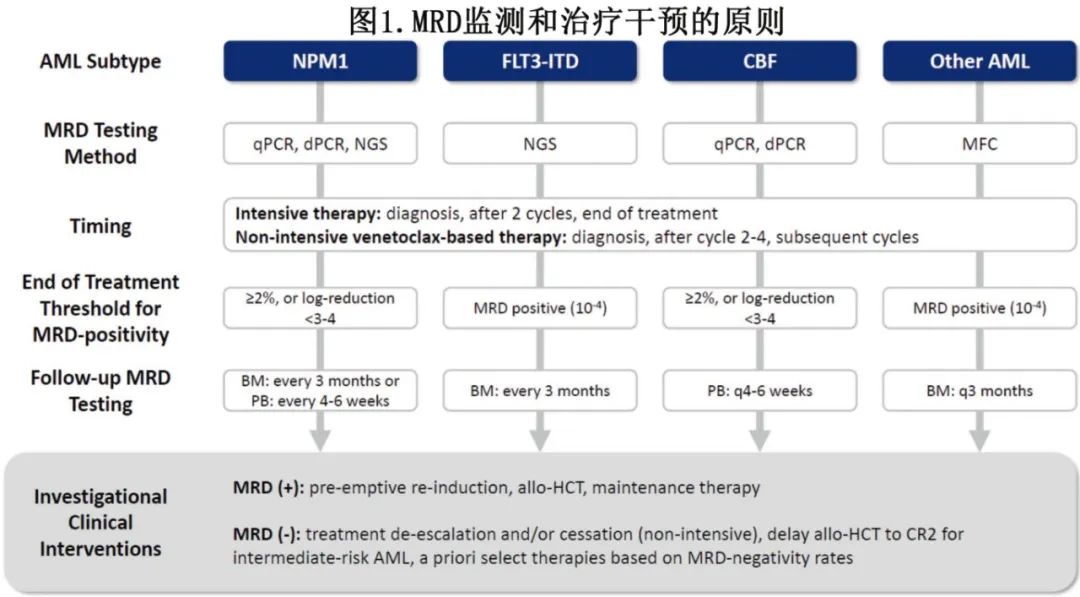
伴有NPM1突变的急性髓系白血病
对于NPM1突变AML,使用PCR技术(包括实时定量PCR[qPCR],数字PCR[dPCR]和NGS)进行MRD检测在临床上是有用的且高度敏感。NPM1 突变在AML MRD监测方面具有多个优越特征,包括 AML 的特异性、稳定性、反复的热点突变及不存在克隆性造血驱动的潜力。
NPM1 突变AML的 MRD 监测在评估强化疗后的疾病方面已得到广泛应用。在第二个化疗周期后,外周血中存在 NPM1 突变转录本与3年复发风险显著增加有关(相对于无转录本;82% vs 30%;单因素风险比[HR]为 4.80;p<0.001),并且生存率更低(24% vs 75%;死亡的单因素HR 为 4.38;p<0.001)。值得注意的是,NPM1转录本的持续高于1000-2000拷贝/105 ABL 与较高的复发风险相关。然而,MRD转录本低拷贝数分子持续存在(molecular persistence at a low copy number,MP-LCN) <1-2%且任何阳性治疗后骨髓样本之间变化<1-log的患者,可自发达到完全分子学缓解(CRMRD-)或保留低水平NPM1转录本(MRD-LL,low-level)而不发生疾病复发。即使如此,最初诊断为 NPM1 突变的患者中已有 NPM1 突变阴性复发的报告。
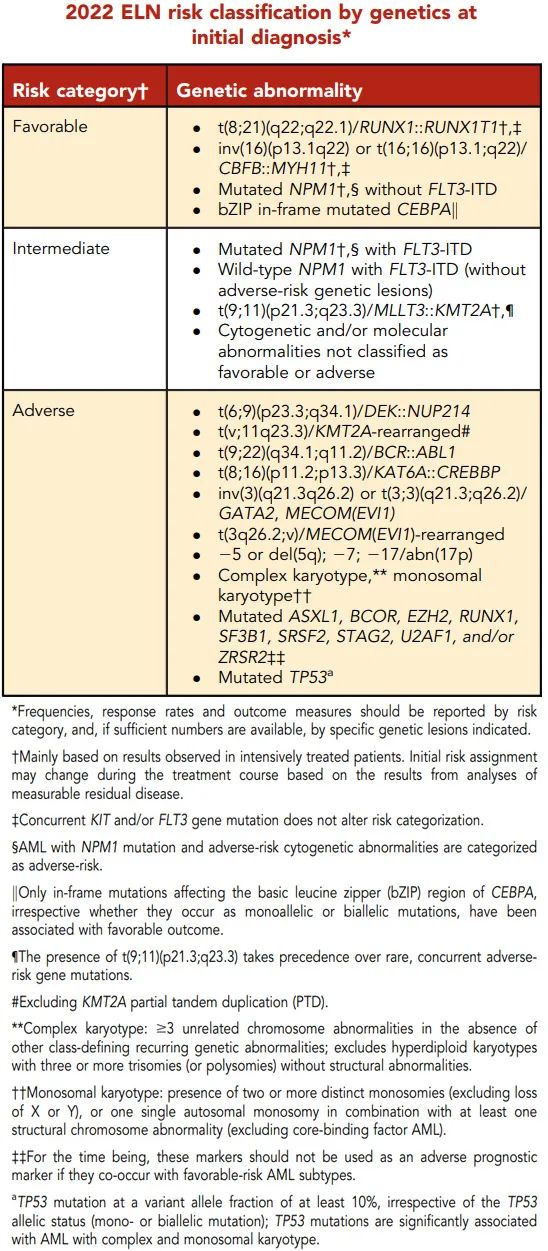
2022 年ELN 修订了伴有 NPM1 突变和FLT3-ITD且无高危基因改变的AML的风险分层,这些患者现在归为中危(无论 FLT3-ITD 等位基因比例如何),该更新是由于标准化 FLT3-ITD 等位基因比率检测存在挑战、midostaurin为基础治疗的影响及越来越认识到MRD作为治疗结局决定因素。
对于因同时存在高危因素而接受allo-HCT的 NPM1 突变AML患者,移植前无MRD(通过逆转录酶qPCR检测)与实现长期生存的高几率显著相关,无论其 FLT3 状态如何,也无论移植预处理方案的强度如何。尽管allo-HCT前 NPM1 MRD水平可预测移植后的结局,与 MFC 或 NGS 确定的 MRD 阳性 AML 患者不同,allo-HCT前 NPM1 突变转录本阳性的患者不一定会出现不良结局,许多患者仍可实现长期生存。
NPM1 突变AML患者MRD阳性率增加的危险因素包括 FLT3-ITD、DNMT3A、WT1 以及非 ABD 型 NPM1 突变,与这些患者不良预后相关的风险因素包括高 MRD 水平(外周血中>200拷贝/105 ABL 或骨髓中>1000拷贝)。近期研究表明,清髓性预处理(MAC)方案可能会克服allo-HCT前的MRD阳性,一项研究纳入首次完全缓解且存在MRD基因组证据的AML患者,使用MAC方案而非减低强度预处理(RIC)方案可降低复发风险并改善总生存期(OS)。UK NCRI研究也强调了allo-HCT对MRD患者的获益。Othman等研究了AML17和AML19研究的联合数据,关注诱导后MRD如何影响NPM1突变AML患者在首次完全缓解(CR1)期allo-HCT的结局。在AML17中,CR1期allo-HCT的选择是基于基线风险因素,而在AML19中,两个诱导化疗疗程后的MRD状态指导CR1期allo-HCT的建议。两项研究显示,持续NPM1 MRD患者可从CR1期allo-HCT中显著获益,三年OS为61%,而未接受移植的患者为24%(HR=0.39);而NPM1 MRD阴性的患者未从CR1期allo-HCT显示出OS获益,3年 OS 分别为 79%和82%(HR=0.82)。将分析限制于同时存在 FLT3 - ITD 突变的患者中也显示出类似结果:CR1期allo-HCT仅对 MRD 阳性患者改善OS(3年 OS,45% vs 18%),而对 MRD 阴性患者无获益(83% vs 76%),且未观察到与 FLT3 等位基因比例的相互作用。因此对于NPM1 突变AML患者,决定CR1期allo-HCT获益的是 MRD 状态,而非 FLT3。虽然 AML17 侧重于基线风险评估,但 AML19 转为由 MRD 指导的选择来决定CR1期allo-HCT的获益,其表明使用 NPM1 MRD 监测来指导移植的治疗决策是有益的,但仍需要随机对照试验予以证实。
除了allo-HCT,当前的研究还应集中于allo-HCT前MRD阳性AML患者是否获益于移植前额外化疗或移植后维持治疗。此外,对于 NPM1 MRD水平低的患者或阴性的患者,目前尚不清楚是否可安全地降低治疗强度。因此,对于 NPM1 突变AML患者,建议在两个化疗周期后评估MRD(主要是外周血),在巩固治疗结束时评估骨髓MRD,并在完成巩固治疗后每三个月评估一次骨髓MRD(共 24 个月)。亦或在 24 个月的随访期间,每4到6周进行外周血MRD评估。
治疗完成后,检测到分子学复发或进展均与临床复发相关,然而对于化疗结束时检测到MRD的患者的治疗,目前尚未达成共识,抢先干预对 NPM1 突变MRD阳性自然史的潜在影响也仍不清楚。在 NCRI AML17 研究中,对 27 例分子学复发患者进行了强化疗,其中 16 例(59%)实现MRD阴性。在 RELAZA2 研究中,33 例患者中有 17 例(52%)的 NPM1 MRD水平通过阿扎胞苷治疗降低至<1%,并且MRD阴性患者的无复发生存期(RFS)有所增加。维奈克拉联合小剂量阿糖腺苷(Ara-C)或阿扎胞苷在强化疗后根除持续性或复发性 NPM1 MRD方面显示出良好疗效。在一项小型回顾性研究中,7 例患者中有 6例(86%)在治疗 1-2个周期后实现CRMRD-。在一项2 期研究中,NPM1 突变AML患者在MRD复发时接受小剂量阿糖腺苷和维奈克拉治疗,69%(18/26)实现MRD缓解,12例(46%)实现MRD阴性缓解。在另一项纳入 11例适合移植NPM1 突变AML患者的小型回顾性研究中,患者接受阿扎胞苷和维奈克拉治疗作为移植的桥接策略,9/11(81.8%)在中位两个周期化疗后实现CRMRD-。在一项前瞻性 II 期研究中,低剂量阿糖腺苷(LDAC)联合维奈克拉治疗 MRD 复发(77%为 NPM1 突变)的患者,到第 2 个周期时,69%的患者 MRD 减少了一个对数级(log10),46%的患者实现MRD 阴性缓解。一项多中心队列研究评估维奈克拉联合低剂量阿糖腺苷或阿扎胞苷对 79 例分子学失败的 NPM1 突变AML患者进行抢先治疗,MRD缓解率为84%,71%的患者实现MRD 阴性,2 年总生存率为 67%。因此,将去甲基化药物与维奈克拉联合使用可能是实现深度 MRD 阴性缓解并使患者适合allo-HCT的有效策略。然而,目前仍不清楚早期治疗MRD 复发还是等待形态学复发可获得更好的总生存率,还需要进一步研究来确定干预的最佳时机。然而,最近一项纳入 227 例连续 NPM1 突变AML的回顾性分析表明,与在分子学复发CR1期移植的患者相比,出现明显血液学复发的患者接受allo-HCT与更差的OS和EFS相关。在另一项纳入 303 例 CBF 和 NPM1 突变AML患者的回顾性研究中,接受抢先治疗的患者比出现形态学复发的患者总生存期更高,表明由分子学监测指导的抢先治疗是改善具有这些特定基因突变患者预后的一种新兴策略。
在接受非强化维奈克拉联合化疗的NPM1突变AML患者中,通过qRT-PCR检测MRD的结果显示,实现骨髓 MRD 阴性与 2 年总生存率(OS)的改善相关(84%),而检测到 MRD 但较基线减少≥4 个对数级(≥4 log10)的患者为50%,较基线减少<4个对数级的患者为22%;且这些关联与基线特征无关。部分NPM1 突变 AML 且 MRD 阴性的患者可能获益于长期无治疗缓解;但的长期随访尚未达到生存平台期,表明尚未实现治愈。此外,NPM1的靶向纠错 DNA 测序(targeted error-corrected DNA sequencing)NGS-MRD 检测与复发和 OS 相关,与变异等位基因分数阈值无关。即使如此,NGS-MRD 检测的临床应用仍未得到满足。此外,新出现的数据表明,在完全分子学缓解 NPM1 突变AML患者中,CHOP-like突变(具有致癌潜能的克隆性造血)的持续存在与较差的OS相关(HR=5.5,p=0.002)。最后,利用MRD来降低或停止基于维奈克拉的持续治疗方案是一个很有前景的、以患者为中心的研究领域。将MRD阴性作为停止治疗的标志物,可以减少治疗、毒性和医疗就诊次数,并提高生活质量。
伴有FLT3突变的急性髓系白血病
虽然关于AML中MRD的最新共识更新认为,FLT3 信号通路突变的持续存在,结合其他 MRD 标志物,很可能代表残留病,但在强化诱导治疗后CR时基于NGS FLT3-ITD MRD 阳性与累积复发发生率(CIR)增加(4 年 CIR,FLT3-ITD MRD 75% vs 无 FLT3-ITD MRD 33%;p<0.001)和总生存期(OS)降低(4 年 OS,31% vs 57%;P<0.001)相关。基于 NGS 的 FLT3-ITD MRD 检测的预后价值优于诊断时伴随的 NPM1 突变的存在或缺失以及FLT3-ITD 等位基因比例。然而,尽管基于 NGS 的 MRD 检测技术目前检测深度相当大,但仍未能识别出所有有复发风险的 AML 病例,可能是由于技术限制。随着 FLT3 抑制剂的纳入,在 AML 复发时出现了新活化的信号基因带来的新挑战。
QuANTUM-First研究纳入新诊断的 FLT3-ITD 突变AML,对比quizartinib 与安慰剂,并评估 FLT3-ITD 特异性MRD的清除情况;使用二代测序技术,并以 10-4 个白血病细胞为阈值。达到CR且MRD低于 10-4的患者OS显著改善,MRD阳性和阴性患者的OS分别为 29.4 个月和未达到(HR=0.562)。quizartinib 在降低MRD水平方面比安慰剂更有效,quizartinib 组中有 12.3%的患者实现MRD阴性,而安慰剂组为 7.0%(P=0.0403)。该结果支持 FLT3-ITD 特异性MRD监测的预后效用,以及 quizartinib 增强 FLT3-ITD 突变MRD患者MRD阴性的潜力。
在CR1的AML患者中,使用灵敏度为 0.01%的靶向纠错 DNA 测序检测,发现 FLT3-ITD 和/或 NPM1 在allo-HCT前持续存在与复发风险增加(3 年时,59% vs 24%,HR=3.71)和OS降低(3 年时,34% vs 66%,HR=2.60)相关。发现队列也证实该结果,证实复发风险也增加(3 年时,68% vs 21%,HR=4.32)、OS 率降低(3 年时,39% vs 63%,HR=2.43)。在其他研究中,使用高灵敏度 PCR-NGS评估allo-HCT前 FLT3-ITD MRD状态也有类似结果。在一个由 104 例处于形态学缓解期的 FLT3-ITD 突变 AML 患者组成的队列中,通过基于 PCR-NGS 的技术检测到allo-HCT前的 FLT3-ITD MRD(其灵敏度比基于毛细管电泳的技术高 100 至 1000 倍),与RFS恶化(HR=4.94,p<0.0001)和 OS 率降低(HR=4.16,p<0.0001)相关。此外,使用市售kit(MRD的阳性阈值为 0.01%或更高),CR1 AML患者血液检测到allo-HCT前 FLT3-ITD MRD阳性结果与复发和死亡风险增加有关,且随着MRD负荷的增加,风险也会增加。
allo-HCT前和移植后给予FLT3 抑制剂可降低复发风险。在一项 3 期随机研究中,allo-HCT后索拉非尼维持治疗与降低CIR及改善无白血病生存期(LFS)和OS相关。然而在亚组分析中,移植时MRD状态并非预后改善的统计学显著预测因素,而allo-HCT后MRD 阳性与复发风险增加和 LFS 降低有关(即使使用索拉非尼)。在一项小规模的2 期随机研究的探索性分析中,allo-HCT后索拉非尼维持治疗对移植前MRD以你选哪个及移植后 MRD 阳性的患者最为有益。在3 期 BMT-CTN 1506 研究中,allo-HCT后吉瑞替尼维持治疗并未改善 FLT3-ITD 突变AML的RFS(HR=0.68;p=0.0518)。然而相对于allo-HCT后 MRD 阴性患者,allo-HCT后 MRD 阳性患者在 RFS 方面显示出临床改善。尽管如此,在FLT3 抑制剂已融合入AML诱导和巩固化疗的时代,FLT3 抑制剂维持治疗的作用仍不清楚。然而,在一项针对 FLT3-ITD 的小型研究中,使用高度灵敏PCR-NGS检测MRD,与仅接受化疗的AML患者相比,添加 FLT3 抑制剂后ITD 突变变异等位基因频率水平更低。
对于不适合强化疗的AML患者,去甲基化化疗、维奈克拉和 FLT3 抑制剂的三联疗法与更高的CR/CRi、FLT3-PCR 阴性和MRD阴性(流式细胞术)相关。然而,“三联疗法”仍处于临床试验的早期阶段,在采用之前还需要进一步开展更大规模的研究。
伴有IDH突变的急性髓系白血病
在接受强化或低强度化疗缓解后,AML患者骨髓中 IDH 突变的持续存在与复发风险增加相关,但似乎并不影响至复发时间。此外,在携带 IDH 突变且并接受年龄依赖性强化疗的AML患者中,通过 ddPCR 检测,达到缓解的AML患者中75%(33/44)可检测到allo-HCT前 IDH MRD,尽管中位变异等位基因频率水平较低(1.2%)。值得注意的是,只有移植时 IDH1 R132 和 IDH2 R172 突变与复发风险增加相关;而IDH2 R140 MRD阳性与复发累积发生率的增加未显示出统计学显著关联。该结果表明,其可能是与潜能未定的克隆性造血(CHIP)相关突变,而非AML特异性突变。
在allo-HCT前环境中,通过靶向纠错 DNA 测序检测到IDH1 突变MRD的持续存在与复发风险增加(p=0.5)或OS降低(p=0.4)无关;然而对于伴有其他突变的患者,NPM1和/或 FLT3-ITD 的持续存在与更高的复发率相关(p=0.01)。与 IDH1 突变AML不同,allo-HCT前持续存在 IDH2 MRD与复发风险增加(HR=2.1,p=0.003)和OS降低(HR=2.5,p<0.001)相关。尽管如此,在 IDH2 共突变AML中,存在NPM1 或 FLT3-ITD MRD是更有效的预后指标。然而在一项单中心研究中,55 例IDH 突变的AML患者CR期接受非清髓性allo-HCT伴移植后环磷酰胺,缓解期任何 IDH 突变的持续存在均与复发或死亡风险增加无关。对于IDH 突变AML,通过MFC检测MRD可能是比NGS评估 IDH 突变MRD更能预示长期生存期的指标。
去甲基化药物联合维奈克拉对 IDH 突变AML非常有效,可诱导深度缓解伴MRD阴性,通过MFC检测可达 93%,通NGS检测可达 32%。去甲基化药物联合维奈克拉及 IDH2 抑制剂的三联方案在新诊断AML 中也非常有效,MRD 阴性效果显著,但毒性也会增加。因此,对于IDH2 克隆占主导地位的AML 患者,先采用 IDH2 抑制剂单药治疗,对于无充分反应的患者随后添加去甲基化药物,已证明是一种将化疗副作用最小化的潜在策略。类似的以 MRD 为导向的剂量递增或递减是否有效还有待确定。allo-HCT后的 IDH 维持治疗是一种新兴策略,早期结果很有希望。
核心结合因子急性髓系白血病
核心结合因子(CBF)AML定义为存在 t(8;21)(q22;q22) 或 inv(16)(p13q22)/t(16;16),采用基于阿糖腺苷的化疗时为低危。特定的 PCR 检测(RUNX1::RUNX1T1 和 CBFB::MYH11)是 CBF-AML 首选的MRD检测手段。诱导治疗或两个化疗周期后便可见早期 PCR 转录减少。具体而言,首次巩固治疗后 MRD 减少少于 3 个对数级与更高的复发风险相关。此外,在连续监测期间 MRD 水平升高预示着疾病复发。连续监测是否可为干预提供足够的预警时间,以及针对形态学复发前的持续性 MRD 或分子学复发进行治疗干预是否可改善OS,仍是未解决的问题。在一项回顾性研究中,尽管每三个月监测一次 MRD,但大多数复发仍未及时预测以防止形态学复发,74.4%的患者出现快速复发。化疗结束时 MRD 转录减少少于 3 个对数级的患者更有可能复发。该研究发现,每三个月监测一次MRD是不够的,需要进一步研究以优化监测策略。ELN 建议,CBF-AML患者应每 4-6 周进行一次外周血qPCR监测。一项小规模研究表明,强化疗后处于形态学缓解但仍持续存在低水平 PCR 阳性的 CBF-AML 患者,可能会从表观遗传学治疗(如去甲基化药物)中获益,以根除MRD。近期研究表明,由于存在融合的肥大细胞,无病的CBF-AML患者中可能持续存在分子学水平MRD,从而导致CBF-AML的MRD解读更为复杂。在 15 个样本中,13 个样本只有肥大细胞(而非其他细胞类型)含有 CBF 融合。该发现使临床医生更加意识到,需要准确区分真正的MRD和由终末分化肥大细胞引起的分子学阳性,而误诊可能导致不必要的过度治疗。
临床上有价值的MRD相关决策工具
由于allo-HCT前MRD阳性是疾病复发的独立风险因素(无论缓解次数如何),无论MRD的阴性是在缓解后早期还是巩固后晚期获得,也无论检测方法如何,完全缓解期allo-HCT获益的决策均可以使用综合风险分层和缓解时MRD状态来指导。allo-HCT前MRD阴性的复发风险较低。目前尚缺乏随机研究,基于allo-HCT前MRD来支持化疗方案的强化或改变。allo-HCT前持续存MRD在可能归因于耐药的白血病克隆,对此额外的化疗可能无益,反而可能导致毒性增加。与RIC相比,MAC可提高生存率和降低复发风险,但MAC 与治疗相关的毒性增加有关,而强化RIC 并不能改善allo-HCT后的结局。尽管如此,含美法仑的预处理方案可以克服 NPM1 或 FLT3-ITD 的MRD持续存在,在一项回顾性研究中,脐血移植可使allo-HCT前MRD阳性的患者获益。此外,单细胞测序得到的克隆多样性,而非诊断时的突变数量,会影响allo-HCT前MRD的清除。值得注意的是,对于诱导化疗后CR的AML患者,不应将持续存在CHIP 相关突变视为MRD。allo-HCT后检测到MRD也与复发风险增加相关。有趣的是,使用纠错NGS,allo-HCT后连续监测 DTA(DNMT3A、TET2 和 ASXL1)及非 DTA 突变可以识别即将发生的复发。尽管通过 MFC 检测AML MRD很容易做到且能预测生存期,但它并非治疗决策的可靠工具,因为在CIBMTR的一项大型研究中,通过 MFC 检测allo-HCT前的MRD,复发率的阳性预测值仅有45%,阴性预测值也仅有64%。
结论
总之,随着检测变得更加灵敏和复杂,对AML中MRD的理解也在不断演变,尤其是随着更多地使用低强度方案,其聚焦于在形态学复发前从分子水平“消除”MRD。因此,人们越来越有兴趣采用创新策略来靶向 AML 中的 MRD,以改善患者预后。在 AML 中,MRD 已成为一个预测性生物标志物,用于指导治疗,并超越其最初的预后功能(MEASURE NCT05224661)。AMLM26 INTERCEPT(ACTRN12621000439842)和 MyeloMATCH(NCT05564390)是两个在这方面广泛协作的研究。
参考文献
El Chaer, F., Perissinotti, A.J., Loghavi, S. et al. Pre-emptive therapeutic decisions based on measurable residual disease status in acute myeloid leukemia: ready for prime time?. Leukemia (2024). https://doi.org/10.1038/s41375-024-02458-6


