超声对休克患者血流灌注和淤血的多器官评价
时间:2023-11-30 11:30:57 热度:37.1℃ 作者:网络
越来越多的证据表明,超声在评估心循环休克患者多器官灌注不足和淤血中既可以识别潜在的病理生理机制,又可以确定和监测治疗的作用。心肺超声作为一种综合的多参数评估方法被纳入到血流动力学不稳定/心源性休克患者的早期阶段;内脏超声主要应用于心力衰竭和循环衰竭中。尽管在危重患者中验证不足,但许多超声参数具有强大的生理背景来支持它们在急性情况中的应用,这些参数适用于心脏/肺和内脏器官的评估。本文综述了超声参数在诊断/治疗途径中显示的证据,以确定参与心脏循环、休克病理生理级联反应的器官的淤血/灌注特征。
介绍
休克是循环衰竭的最终临床表现。这是一个包含多种生理病理改变的术语,所有这些最终都会导致细胞氧供不足。各种形式的休克在重症监护领域普遍存在,大约三分之一的患者入住重症监护病房。ICU休克的后果是末端器官循环受损,可能是由于器官的灌注不足,也可能是由于器官的血流受损(淤血),或者更常见的是由于两种现象的合并。虽然总氧输送减少(DO2)通常归因于组织灌注减少,淤血同样降低了跨重要器官的动静脉梯度,这是由间质压升高而不是动脉压降低引起的。
在过去的二十年里,模式化的病人管理方法在人们对特定疾病的认识和筛查确实有所帮助,但一刀切的做法存在固有的缺点。通常,需要针对当前床边生理情况采取个性化的治疗方法。病人的全方位评估应包括几种方式;然而,当然这些工具中最强大和最通用的是即时超声(POCUS)。
POCUS 在急症患者中的作用是识别当前和相关的生理学,也称为“表型休克”。 一旦确定了休克的类型,就可以开始有针对性的管理。 精明的诊断并不能很好地替代源头控制。 相反,确定患者休克的根源并努力干预对于休克的管理和解决至关重要。 在此,我们回顾了对灌注和淤血的器官特异性 POCUS评估,同时讨论了这些评估的生理原理和在临床管理中使用的现有证据。 图 1 总结了常用的灌注和淤血形态,执行每种技术的实用方法可在补充中找到。
灌注缺陷
评估患者循环性能的第一步首先是对向目标器官的血液输送进行定量和定性评估,也称为灌注。灌注不匹配可能是由于心功能的主要改变(心源性休克),也可能与主要的循环功能障碍有关。因此,淤血/低灌注的评估应该包括所有可能涉及的器官,因为每一种超声方式在心脏、肺、腹部脏器和大脑的超声评估中提供了可操作的数据点。
灌注评估
心脏
超声心动图是床边超声评估心功能和整体灌注的基石,因为它既定义了相关的血流动力学参数,也确定了休克患者的潜在病因。已努力确定培训要求和超声心动图标准。2临床医生面临的挑战是将超声心动图检查结果与患者的临床表现结合起来,并相应地调整持续的支持(肌力药物/血管升压药、正压通气、机械循环支持)。心肌功能障碍的患者对重症监护医生来说是一个独特的挑战。左心室和右心室功能障碍可能是导致休克的主要原因,也可能是不同病理过程的附带现象,包括/导致心循环衰竭。
血流动力学评估在历史上曾将心功能等同于左室功能。在过去的十年中,在诸如脓毒症和急性呼吸窘迫综合征等疾病状态中,右心室功能障碍的流行率和后果变得更加明显。一种细致的血流动力学评估方法结合了左心室和右心室的功能,以提供一个准确的血流动力学情况。
左心室(LV)在每次收缩时起四种主要运动:心尖和基部之间的周向、径向、纵向和反向扭转。这些协同作用导致血流从左心室排出到体循环。超声心动图量化了左室功能的每个基本方向的表现;然而,床边超声心动图医生对左室纵向功能的评估是最具体的。左心室射血分数(LVEF)和每搏量(SV)是即时超声心动图中最常用的指标。左心室射血分数已经用于60多年的临床分类、决策和预测,尽管LVEF是最常用的心力衰竭描述指标,但在实践中,LVEF依赖于几个假设,这降低了它在重症监护环境中的效果。
左心室射血分数是一种基于体积的测量方法,这种假设测定方法有很大的缺陷性,例如要求左心室壁的同步、均匀收缩等功能。在局部缺血、心肌梗死、束支传导阻滞和心律失常的情况下,这些假设的前提被违反,导致对左心室功能的估计变得不可靠。此外,左心室射血分数会因心率、前负荷、后负荷和正性肌力等血流动力学而急剧变化,所有这些通常在重症监护领域进行调整。LVEF 表示所有三个方向分量的总和(辛普森法则)或周向分量和径向分量(Teichholz公式),但没有明确说明纵向函数。LVEF 的极端值与感染性休克患者的死亡率相关。
左心室纵向纤维在收缩期降低了从左室基底到左室心尖的尺寸,对左室功能的贡献高达30%。左室纵向功能的一个指标是二尖瓣环平面收缩位移(MAPSE),采用m模式和组织多普勒成像(TDI)进行评估。二尖瓣环平面收缩期位移利用一种简单的技术,在所有心室基底壁水平测量时,与LVEF 等其他LV 功能指标具有合理的相关性。
二尖瓣环平面收缩偏移对早期冠状动脉低灌注不足特别敏感,因为它代表左室心内膜下纤维的收缩,这个位置最容易发生冠状动脉缺血。这可能会导致纵向收缩减少和收缩期收缩延长,进而导致伴随的舒张异常,舒张受损发生在心肌缺血级联的早期。 二尖瓣环平面收缩期偏移可能与休克患者的死亡率相关,尽管MAPSE 的性能已被了解,但临床医生应保持谨慎,不要根据局部测量得出关于LV 整体功能的结论。
收缩期峰值速度(S’)由TDI测量。收缩期峰值速度通过速度而不是测量侧壁的移动率来测量其位移。S‘与dP/dT相关,且与负荷条件相对独立。在缺血发生后的15秒内,可检测到S‘速度的降低。S’收缩期后降低的存在与缺血性心肌病患者的不良重构和住院治疗相关。
直接测量每搏量避免了使用LVEF作为灌注指标所遇到的几个缺点。通过计算将脉冲多普勒的取样容积放置在右心室流出道(RVOT)或左心室流出道(LVOT)中所产生的速度-时间曲线下的面积,得到了速度-时间积分(VTI),它与每搏量成正比。来自RVOT或LVOT的VTI是用于估计每搏量的最可靠和可重复性的超声心动图参数之一。因此,在相似的心率下,LVOT VTI的连续测量对应于CO的变化,并可用于监测对干预措施的反应。LVOT VTI的变化对脓毒性休克和机械通气患者的液体反应性有很高的预测价值,以及可以预测成功脱离静脉-动脉体外膜氧合(V-A ECMO)的价值。
还有其他超声心动图参数已证明在描述与休克结果相关的心室性能和/或血流动力学特征方面具有很高的准确性。 诸如 LV 总等容时间(LV t-IVT 在线补充材料,图S3)、每搏功指数、心输出量等参数描述了LV 性能; 然而,缺乏对休克患者的前瞻性大规模验证。
右心室超声心动图提出了独特的挑战,部分原因是其复杂的几何形状和更靠近于肺部。因此,需要明确心内膜边界的常见左心室测量,如射血分数和面积变化分数,对于右心室(RV),尤其是机械通气的患者,通常是无法获得的。 床旁超声心动图最常报告的 RV 指标是RV/LV 比率,这是RV 过负荷的指标。RV 收缩功能的定性估计虽然在实践中经常报道,但缺乏敏感性且观察者间一致性较差。定量RV 指标类似于上述LV 指标,三尖瓣环收缩期平面偏移(TAPSE) 和三尖瓣环处的TDI RV S' 反映RV 纵向纤维缩短并反映RV 收缩性。TAPSE 和 RV S' 都是广泛患者群体中MACE事件 和死亡率的预测因子。
使用修正的伯努利方程,可以估计心室和肺动脉(PA)压力。虽然右心室收缩压、PA收缩压和PA舒张压通常在完整的超声心动图中被报告,但这些值很少有助于确定休克的来源。相反,经瓣膜梯度可能表明存在充盈压力升高,这突出了对液体复苏的不耐受。对右心房压力(RAP)本身的估计往往不能提供可操作的临床信息。
虽然还有一些超声心动图指标揭示了心肌表现的独特方面,但它们的解释往往受到重症监护环境中常见的患者因素的限制,如快速心律失常和机械通气。在重症监护领域评估心肌表现的未来方向包括散斑点跟踪技术和经食道和心内超声心动图分析。
人们可以假设终末器官的低灌注通常是均匀的; 然而,当临床情况表明终末器官性能较差时,对终末器官灌注的有针对性的评估可能会提供额外的见解。 一旦对患者的休克进行了适当的表型分析,临床医生就应该调整正在进行的药物治疗以实现临床目标。
肺
确保足够的跨肺血流量应成为休克患者常规超声评估的一个要素。 跨肺血流需要从 RVOT 到左心房的有利压力梯度。 对 RVOT 脉冲波多普勒形态及其加速度的分析表明肺动脉高压的存在和/或严重程度。因此,用脉冲波多普勒检查RVOT 使临床医生不仅可以估计RV 每搏输出量,还可以深入了解肺动脉高压的阻力、 肺血管系统和对干预措施的潜在反应。
左心房(LA) 压力可以通过几种不同的超声心动图方式推断,包括透射多普勒、TDI舒张评估、肺静脉多普勒和胸部超声。 肺静脉多普勒可以深入了解左侧心室的表现,并且可以在90% 的非危重成人中获得。此外,肺静脉和肝静脉多普勒波形的解释之间存在显着的同源性。 在胸部超声检查中,A 线可能代表干燥的实质间隔,并且与低肺动脉楔压相关。
腹
在休克状态下,心脏和大脑的灌注通常以牺牲内脏循环为代价来维持,导致内脏灌注不足。 腹部器官的灌注可以使用典型的超声方式进行询问,包括二维亮度、彩色多普勒和脉冲波多普勒。 多普勒阻力指数(DRI)评估区域内脏血流动力学,并可以在生化和宏观血流动力学明显之前早期检测到与器官功能障碍相关的异常,从而表明体循环是否足以支持内脏灌注(参见在线补充材料,图S4)),在内脏血管收缩的情况下,组织对血流的阻力增加,导致舒张期速度减慢,从而增加DRI。 DRI可用于多个内脏脏器检查,并且易于计算[(收缩期峰值速度- 舒张期速度谷值)/收缩期峰值速度]。
对于患有低血容量的患者,肾血流量可较基线减少6倍。肾阻力指数(RRI)允许评估肾脏灌注,并受到肾内条件和血流动力学条件的影响。RRI利用了危重患者急性肾损伤发展的高可行性、预测价值,以及观察者内和观察者间的低变异性。
在缺氧或易导致高碳酸血症的情况下,经常可以看到显著的肾血流量减少。SvO2与RRI之间呈负相关,因为肾脏对氧供需不匹配的高敏感性表明其导致了动脉血管收缩。RRI≥0.70在SvO2 < 60%中具有100%的特异性,可以预见的是,RRI在血流动力学和通气参数变化之前,识别出机械通气患者中与CAO2减少相关的低灌注。RRI值升高可能表明正常血容量患者以及在出现明显休克症状之前血容量相对较低的患者代谢需求增加。对于感染性休克患者,RRI 已用于评估通过血管活性药物滴定的方式确定最佳肾灌注压,比较明确的是RRI > 0.77可以预测脓毒症诱导的AKI,RRI>0.80预测了持续的AKI。
新的肾动脉测量,包括射血前期(PEP)、射血时间(ET)和PEP/ET可能表明心输出量不足,不足以满足肾脏的代谢需求,因此可能预测不良的心脏和肾脏预后。
中枢神经系统
经颅多普勒 (TCD)是评估大脑血流量的常规技术。 有四种标准 TCD 视图; 然而,经颞叶视图是 ICU最常用的视图。经颅多普勒历来用于监测影响中枢神经系统(CNS) 血流动力学的出血性或缺血性损伤的患者。
关于 TCD在休克患者中的应用和操作的文献很少。 大多数关于中枢神经系统血流超声检查的文献都是针对需要机械循环支持的患者。 对于由不同配置的 V-A ECMO 支持的心源性休克(CS) 患者,TCD已用于检查脑血流量,作为自身心输出量的替代。此外,对于由带IABP的V-A ECMO 支持的CS 患者 作为LV 通气口,TCD已被用来做为左室输出量的监测指标,用于证明支持过程中血流量增加。对于使用具有脉动血流的V-A ECMO 的患者,TCD已被用来证明患者是否已经出现脑死亡。
在感染性休克中,促炎细胞因子和内毒素激活内皮细胞,从而改变脑灌注,促进早期血管收缩反应,随后导致晚期血管舒张,脑血管流量增加。因此,可以检测到独特的TCD 模式,具体取决于 脓毒症的不同阶段,早期阶段平均速度和搏动指数普遍增加,而后期阶段则降低,同时脑自动调节受损。 因此,TCD被认为是评估感染性休克脑灌注的有价值的工具。虽然已经描述了一些基于当地经验的见解,但淤血与CBF 之间的关系尚未系统描述。
静脉淤血
淤血是指静脉过多的状态,观察到血液从心脏逆行,导致器官淤血引起毛细血管床灌注压力下降。为了充分了解静脉淤血的决定因素,必须首先了解静脉回流的生理学。静脉回流的生理决定因素是构成平均充盈压(MSFP)、RAP和静脉系统阻力(MSFP-RA/R)的成分。
由于静脉系统主要是容量系统,血管阻力很少在决定静脉回流中起主要作用。因此,静脉回流的主要决定因素是MSFP和RAP(MSFP-RA)。平均充盈压力是由任何给定时间静脉系统中的血液体积和血管的血管张力产生的。如果在同一压力时间绘制MSFP和RAP的图表,y轴上两条线之间的差异将说明整个心动周期中流向和流出心脏的血流方向。在右心房(RA)收缩期,RAP增加到MSFP以上,血液从心脏逆行进入静脉系统。一旦右心房(RA)放松,RA中的压力就会降低,血液开始流回心脏。右心室收缩导致RAP快速下降,因为右心室收缩从顶部拉动三尖瓣,这导致RAP突然下降,增加血液从静脉系统流向心脏。当血液充满RA时,压力升高,流向心脏的流量减少。右心室舒张开始于三尖瓣打开,血液从右心房流向右心室,这导致RAP再次降低,再次增加了流回心脏的血液流量。此时,RA再次收缩,开始另一个心动周期,这表示在标准心动周期期间的正常静脉回流。
随着患者RAP的增加,MSFP和RAP之间的关系发生了变化,右心房收缩期的逆向血流增加,相反通常在右心室收缩期发生的顺行血流降低到低于右心室舒张期发生的水平,这就是所谓的S到D反转。在严重病例中,RAP增加到其在心动周期的大部分时间都高于MSFP的水平,在这些情况下,在整个右心室收缩过程中都会出现逆行,使右心室舒张期成为唯一发生静脉回流的时期。
淤血评估
心
心力衰竭恶化的必要条件和指征是左心房高压和伴随的淤血。左心房高压导致压力传递到附近的血管系统,即肺静脉和肺毛细血管,导致肺水肿。慢性左心房高压导致肺动脉高压,肺动脉高压导致右心室扩张。
在收缩和舒张功能障碍的情况下传输速度和组织多普勒值都会异常虽然可以理解,但在危重患者中,正常舒张值并没有得到验证。此外,所有识别左心房压力的超声心动图模式只提供一系列值,而不是一个值本身。然而,对于感染性休克患者,平均E/E′≥14和E′≤8与肺毛细血管楔压(PCWP)>15 mmHg可靠相关,是住院死亡率的预测指标。在机械通气患者中,E/E’和彩色M模式传播速度的最佳表现是确定肺动脉楔压>18 mmHg。如果舒张功能不确定,许多临床医生使用左心房大小作为“关键点”来判断是否存在充盈压力升高。左心房增大表明左心房压力长期升高;然而,正常的左心房大小不应排除左心房高压,尤其是在急性疾病中。
静脉淤血最常用的指标是RAP或中心静脉压(CVP)。RAP升高通常通过评估自主和机械通气患者的下腔静脉(IVC)尺寸(>2.1cm)及其在呼吸周期中的变化来估计(预测液体反应性分别为>50%和>20%)。类似地,对感染性休克患者的颈内静脉(IJV)进行了研究,发现在容量改变前超过18%的扩张性对预测液体反应具有80%的敏感性和85%的特异性做为孤立判断RAP的值。
肺
肺部超声(LUS)包括对肺实质和胸膜的评估。肺部超声可以让我们看到静脉淤血对血管空间以外的影响。值得注意的是,这代表了肺静脉系统而不是全身静脉系统的淤血。Lichtenstein首次在普通重症监护室收治的急性呼吸衰竭患者中引入,自过去十年以来,越来越多的证据表明其作为诊断和预后工具的价值。LUS的解释基于两个主要的病理学发现:与正常肺部发现(A线)相比,实变影像(整合)和伪影(B线)。已发现B 线与血管外肺水的其他标志物(包括肺楔压和利尿钠肽)具有良好的相关性。 肺部超声已被证明是一种高度准确的诊断工具,适用于出现呼吸窘迫的患者,可区分心源性呼吸困难或非心源性呼吸困难。对于当前的讨论而言,更重要的是,LUS是去淤血治疗期间实质淤血的可靠动态标志物,可将其分层 并预测心力衰竭和急性心肌梗死 CS患者的预后。这使得临床医生能够在主动复苏期间实时识别静脉淤血的迹象,从而可能限制进一步液体复苏的危害。 超声心动图和 LUS 的结合在危重病人呼吸衰竭的诊断和起源方面具有更高的准确性。
腹部内脏
肝静脉多普勒
肝静脉血流可以用脉冲波多普勒检查。正常血流曲线反映了上一节讨论的静脉回流曲线理论。正常的波形是三相的,有一个逆行的A波(代表流出心脏的血液)、一个顺行的S波和一个顺行的D波。 随着RAP的增加,MSFP和RAP之间的平衡提前出现,观察到的S波逐渐变小。由于早期的循环平衡,在三尖瓣打开后出现更多的房颤,导致相对较大的D波,这就是所谓的S-to-D翻转。随着静脉淤血增加,收缩期血流变成逆行,S波将移至基线以上,并与A波连续,导致出现双向模式。
门静脉多普勒
正常门静脉(PV)血流是基线以上的有波动的连续单相血流(见在线补充资料,图S6)。随着静脉淤血的恶化,门静脉血流变得缓慢,右心室系统的血流量减少。在极端的情况下,由于往复运动的出现,血流可以被中断,甚至有一个倒退的部分,看起来像是逆行成分。门静脉搏动可以用门静脉搏动指数(PPI)来量化。门静脉搏动指数定义为(VMax -VMin/VMax) * 100%。这里,VMax是最大速度,VMin是心动周期中的最小速度。我们将PPI作为一个连续变量来评估门静脉血流改变是否是静脉淤血的一个重要标志。
肾静脉多普勒
正常情况下,肾静脉多普勒血流为基线以下的连续单相流,随后逐渐分为两个阶段,与肝静脉(HV)血流的S波和D波相类似。与HV模式相似,随着静脉淤血增加,S波变小,D波增大。最终,S波完全消失,只留下一个单相波。肾静脉(IRV)多普勒波形被认为是不连续的静脉血流异常,表现为双相或单相肾静脉血流,表现为收缩期/舒张期模式或单纯舒张期模式。
淤血的定量模型
静脉负荷超声
为了建立对肠系膜静脉系统淤血程度的全面评估,人们曾试图建立一个包含门静脉和上述门静脉、肝静脉和肾静脉的分流系统。当使用静脉淤血超声(VExUS)评分时,发现其与通过肾功能障碍测量的内脏器官衰竭有很强的相关性,并且该发现在随后的研究中是一致的。使用内脏静脉循环的几个优点是避免了任何单一测量多普勒模式可能出现的潜在假阳性或假阴性。
评估从发现IVC (>2 cm)、MSFP和RP增加开始,这是提示可能开始出现内脏静脉淤血,代表该相关部位发生了生理变化。为了确认并最终量化严重程度,对HVs、PVs和IRVs进行检查,随着多普勒环境形态异常的变化而评分随之升高。
在休克病人中,VExUS分数可以有许多潜在的有用的方面。首先,在最初的复苏阶段,它可以作为一个液体滴定点。VExUS评分可以在生理学上提示淤血程度,1、2分提示再多的液体可能影响器官功能,3分提示淤血已经到了可能影响器官功能的程度。第二,处于去复苏阶段,它可以再次指导临床医生,针对VExUS评分更高的应更积极的减轻液体负荷,特别是在急性肾损伤患者中,叠加的淤血损伤可能更为显著。
工作流程
虽然我们已经概述了一个彻底的基于系统的诊断策略来表型和量化休克,但我们并不打算在所有患者中全面遵循该方案并按精确的顺序进行。 相反,临床医生应该将其视为可用于协助诊断和治疗管理的工具集合。 话虽如此,我们建议所有休克患者接受心脏功能(右心室和左心室功能)评估以及外周灌注的整体评估,包括动脉供应充足性以及静脉淤血的存在和程度。进一步的研究可以 根据具体患者的临床表现进行。 图 3概述了我们推荐的超声检查工作流程。
结论
对于任何治疗休克患者的临床医生来说,床旁快速超声都是必不可少的工具。 对灌注和淤血的评估引导治疗团队进行定向治疗。 需要开展额外的工作来阐明哪些超声检查技术和临床方案对个体患者群体最有信息性。
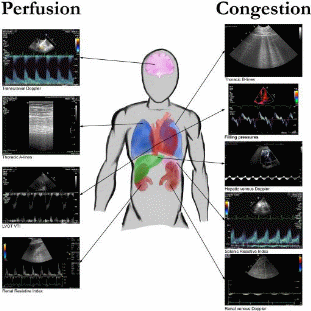
图1 使用文中讨论的相关参数评估淤血和灌注的多器官方法
表 1 评估灌注的超声参数
变量
异常cut-off值
传感器
指标意义
优点
局限性
观察者间一致性/变异性
LVEF
HFrEF <40%;
HFmrEF 41–
49%;
HFpEF >50%
相控阵 (2–12 MHz)
左心室收缩功能对 CHF 的预后意义
广泛使用;
径向/周向缩短的体积评估;
视觉评估;
局部室壁运动异常
心率、前负荷和后负荷;
负荷条件;
不同步/异步;
延迟收缩
严重二尖瓣关闭不全和主动脉瓣狭窄
严重肥大; 左室腔追踪的不一致
需要几何假设
Simpson’s:ICC 0.7 和 Bland-Altman 从 ± 7% 到 ± 25%
视觉:ICC 0.87
MAPSE
每个环形区域(前部、后部、侧面、下部)<10 mm
相控阵
(2–12 MHz)
长轴方向上左心室腔大小的整体变化;AF、MI后、HF的预后意义
具有次优窗口的高度可复制性;AS症状的预测
LBBB、矛盾性间隔运动和主动脉瓣置换术影响间隔MAPSE;二尖瓣钙化/假体。大量心包积液(心尖活动),严重肥大
方差9.36±6.9%
TAPSE
<17mm
右心室纵向功能
内在纵向收缩性;在广泛的患者类别中得到验证;可重复性强;不受脱落或小梁形成的影响
负荷相关,不反映RV三维收缩
ICC 0.83 (0.67–
0.91)
总等容时间(T-IVT)
≥ 14 s/
min
电机械效率,全机械不同步
可复制;早期的收缩期和舒张期评估;独立于形态和功能(瓣膜)改变;比MPI更明智
未在心律失常或严重肥大中得到验证
CoV 4.2–6.4%
心室-动脉耦联
>1.36
左心室和主动脉之间的相互作用
可行的、多参数的、心脏和血管组件之间的集成
成像方法依赖于LVEF,在心律失常和严重肥大中的有效性未知
未指定;然而与LVEF和时间间隔测量有关
左心室每搏功指数(LVSWI)
≥50 g × min/ m2
心室每搏功指数评估
结合左心室收缩和舒张功能,量化左心室产生正向血流和压力的能力;在CS患者中验证
依赖于用回声估计的LVEDP;未在治疗监测中验证
未验证
心功能指数
0.6–0.7 W/m2
心泵能力评价
反映用于生成每搏量容积的能量;在CS患者中验证
在CS中,未考虑队列描述的RAP
未指定
肾多普勒阻力指数(RDRI)
0.7
凸阵探头(3-6 MHz)
肾动脉灌注
高重复性;早期检测独立于角度和血管CSA的血流动力学异常
组织顺应性降低,间质纤维化,血管顺应性降低,取样不准确;心房颤动
ICC 0.96
脾脏多普勒阻力指数(SDRI)
>0.55
脾脏灌注
内脏隔室后压力;与多普勒角和血管CSA无关
慢性肝病,实质顺应性改变
重症监护中的数据不足
门脉流量脉动指数(PFPI)
>50%
肝灌注和全身静脉淤血
全身灌注、右心室和肺功能与静脉高压之间的相互作用
晚期肝脏原发性疾病;胸内高压,呼吸窘迫,门静脉分流术
ICC 0.82
注:射血分数降低心力衰竭,HFrEF、HFmrEF、射血分数中等心力衰竭,HFpEF、射血分数保留心力衰竭,CHF、慢性心力衰竭,post-MI、心肌梗死后、ICC、组内相关系数,AF、房颤,AS、主动脉狭窄,LBBB、左束支阻滞,CoV、变异系数,LVEDP、左室舒张末期压,CSA、横截面积
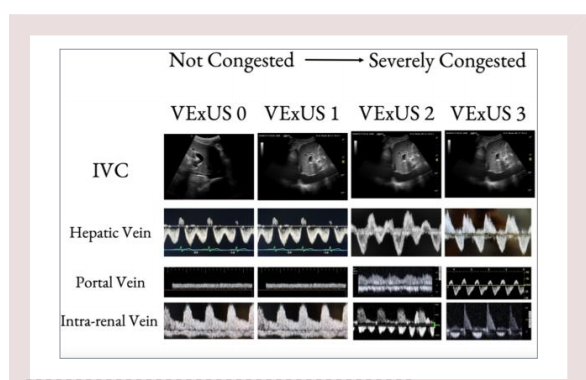
图2静脉淤血超声方案
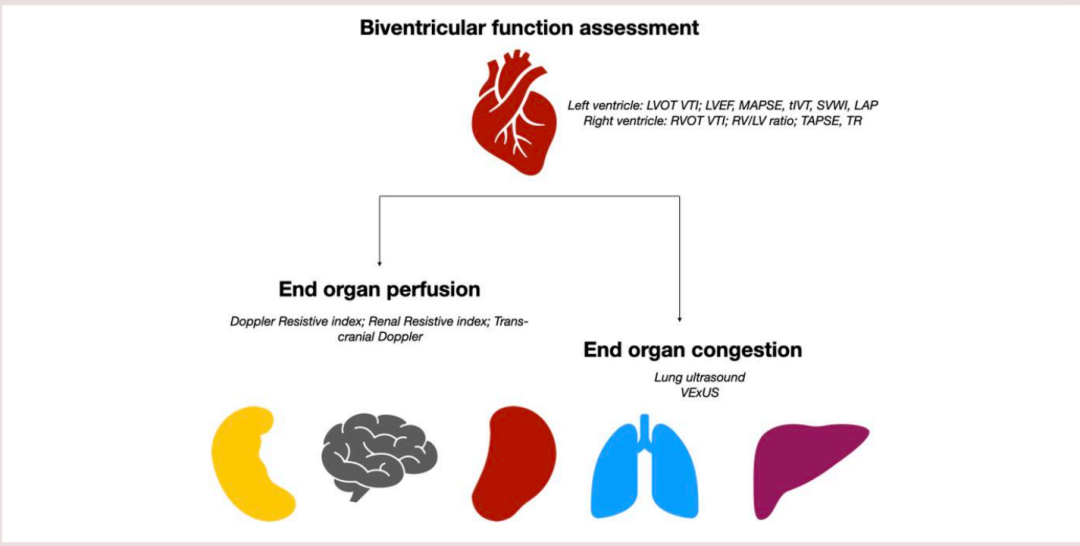
图3器官灌注和淤血评估的建议工作流程。LV-VTI,左心室速度-时间积分;LVEF,左心室射血分数;MAPSE/TAPSE、二尖瓣/三尖瓣环平面收缩偏移;LVSWI,左心室每搏功指数;t-IVT,总等容收缩时间


