J Ethnopharmacol:西黄丸通过改善粘膜屏障损伤,抑制炎症细胞滤过,改善小鼠结肠炎
时间:2023-11-23 07:26:26 热度:37.1℃ 作者:网络
结肠炎的患病率正在上升,目前缺乏有效的治疗方案。西黄丸(XHP)及其主要成分已被证明具有对抗结肠炎的抗炎特性,然而,XHP治疗结肠炎的具体作用和潜在机制尚不清楚。本研究旨在研究XHP对结肠炎的潜在影响,并揭示相关的潜在机制。我们在C57BL/6N小鼠中建立了急性结肠炎模型,研究了模型对结肠组织中体重减轻、结肠长度、结肠黏膜屏障通透性、Claudin-5和Occludin表达、浸润MPO阳性细胞和CD68阳性细胞数量以及促炎细胞因子(IL-6、IL-22、IL-1β和TNF-α)含量的影响。在两周内通过灌胃低、中、高剂量(0.45、0.9和1.8 g/kg/天)的XHP进行小鼠给药。此外,通过定量蛋白质组学技术分析了对照组、结肠炎组和XHP低剂量给药组小鼠结肠组织中的蛋白质表达水平。采用HPLC/Q-TOF-MS技术对小鼠口服XHP后血液中吸收成分进行了全面的分析和表征,并将入血成分与蛋白质组学相结合,揭示了XHP抑制肠炎的机制。我们的研究结果表明,XHP缓解了结肠炎小鼠的体重减轻和结肠缩短。此外,XHP降低了结肠粘膜屏障通透性的增加并降低了Claudin-5和Occludin的表达,同时显著减少结肠组织中浸润的MPO阳性细胞和CD68阳性细胞的数量。我们发现XHP降低了结肠组织中促炎细胞因子的产生,包括IL-6、IL-22、IL-1β和TNF-α。药代动力学分析表明,XHP含有24种进入血液的原型成分,这些成分通过调节与粘膜屏障损伤和炎症相关的各种蛋白质(如Ctsb、Sting1和Abat)来改善结肠炎。XHP通过多种靶点和途径改善了肠粘膜屏障损伤,减少了MPO阳性细胞和CD68阳性细胞的浸润,为XHP作为一种潜在结肠炎治疗方法提供了支持。
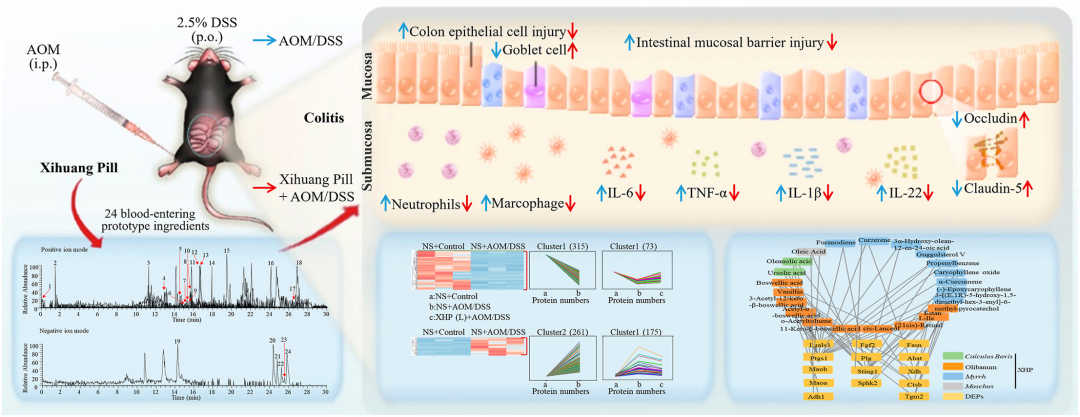



实验结果
1. XHP改善氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)诱导的结肠炎
为了确定XHP是否可以改善结肠炎,我们通过AOM/DSS诱导14天,然后连续14天给药XHP,在小鼠中建立了急性结肠炎模型(图1A)。在DSS诱导干预后7天,我们观察到体重减轻和DAI评分增加。结肠炎组(NS+AOM/DSS)小鼠在第8-14天的体重显著降低(图1B),其在第13-14天的中等剂量XHP处理时被显著抑制。在第14天,低剂量XHP显著抑制了体重的下降。我们发现,与对照组相比,DAI评分显著增加(图1C),从第10-14天开始,结肠炎组的DAI评分在低剂量XHP治疗后受到显著抑制。从第12-14天开始,中剂量和高剂量XHP治疗导致DAI评分显著降低(图1C)。
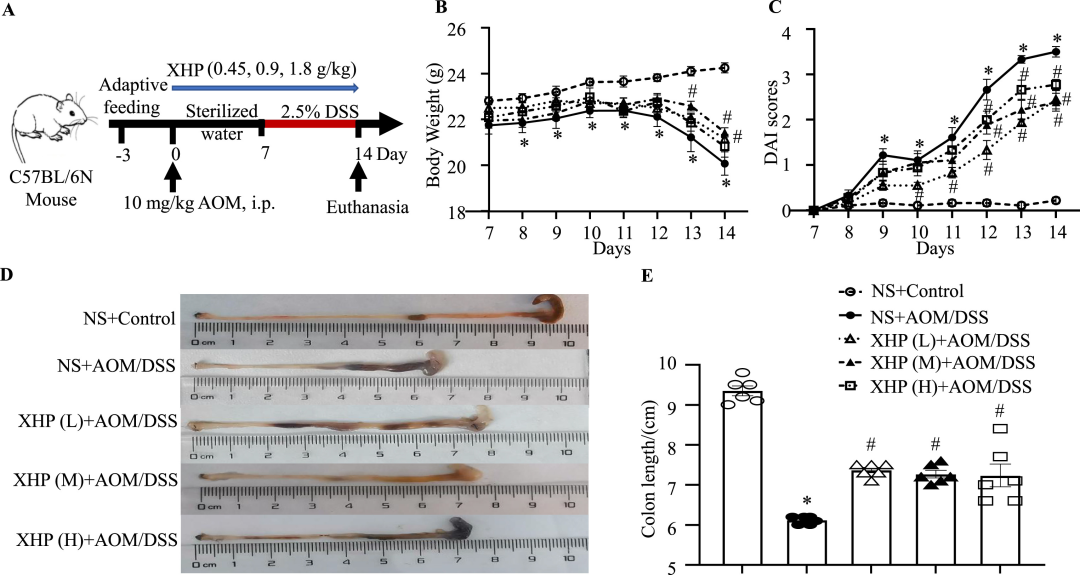
图1 XHP改善AOM/DSS诱导的结肠炎。(A)诱导结肠炎的AOM/DSS处理方案的示意图,随后使用指定剂量的XHP进行干预。(B–C)DSS干预7天后,指定处理组的体重变化和DAI评分。误差条表示平均值±SEM(n=6)。(D–E)来自指定处理组的结肠组织和结肠长度的代表性图像。误差条表示平均值±SEM(n=6)。与NS+Control组相比*p<0.05,与NS+AOM/DSS相比#p<0.05。与NS+Control组相比,*p<0.05表示任何组与NS+Control组之间的统计学差异;与NS+AOM/DSS组相比,#p<0.05表示任何组与NS+AOM/DSS组之间的统计学差异。
与对照组相比,结肠炎组小鼠的结肠长度显著降低。XHP的低剂量、中剂量和高剂量治疗显著导致结肠长度增加(图1D–E)。这些数据表明XHP改善了AOM/DSS诱导的结肠炎。
2. XHP抑制结肠炎中常见的结肠粘膜屏障通透性增加
肠粘膜屏障功能损伤通常导致灌胃FITC-葡聚糖(4 kDa)后血清中FITC-葡聚糖的增加。我们使用小动物PET成像检测FITC-葡聚糖。结果表明,与正常组相比,结肠炎组的血清FITC-右旋糖酐水平显著升高,而低、中、高剂量的XHP治疗明显抑制了观察到的FITC-葡聚糖水平的升高(图2A)。此外,结肠炎小鼠外周血中FITC葡聚糖的浓度显著增加,而低剂量或高剂量的XHP治疗显著抑制了外周血FITC葡聚糖含量的增加(图2B),表明XHP治疗明显抑制了结肠炎引起的结肠粘膜屏障通透性增加。接下来,我们检测Claudin-5和Occludin的表达水平,以确定所有组结肠组织紧密连接的状态。我们证明结肠炎组结肠组织中Claudin-5和Occludin的表达水平显著降低。XHP低剂量给药和中剂量给药显著抑制Occludin的减少,XHP低浓度给药显著阻止Claudin-5的减少(图2C)。

图2 XHP抑制结肠炎中常见的结肠粘膜屏障通透性增加。(A–B)4 kDa FITC葡聚糖灌胃后2小时通过小动物PET成像检测到的荧光强度的代表性图像,以及小鼠灌胃后4小时外周血中FITC葡聚糖(4 kDa)的定量。误差条表示平均值±SEM(n=6)。(C)指示处理组结肠组织蛋白质提取物中Occludin、Claudin-5和β-肌动蛋白表达的蛋白质印迹分析。显示了蛋白质印迹结果的定量。误差条表示平均值±SEM(n=5)。与NS+Control组相比*p<0.05,与NS+AOM/DSS组相比#p<0.05。
3. XHP抑制结肠炎小肠隐窝细胞和杯状细胞数量的减少
接下来,我们进行了H&E染色,以确定所有组结肠组织的病理和形态学变化。结肠炎组结肠上皮细胞排列紊乱,隐窝数量减少。令人惊讶的是,给予低剂量、中剂量和高剂量XHP治疗后,小鼠结肠上皮细胞的紊乱程度降低,隐窝数量增加(图3A–C)。PAS染色分析显示,结肠炎组小鼠结肠黏膜中杯状细胞的数量显著降低,低剂量XHP治疗显著抑制了结肠黏膜中杯状细胞的减少(图3D–E)。
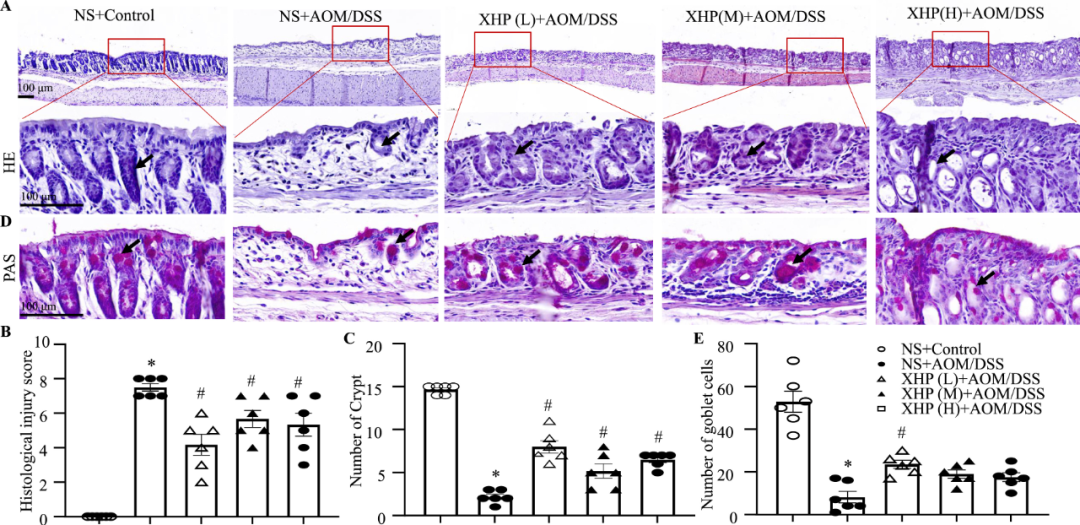
图3 XHP抑制结肠炎中肠隐窝和杯状细胞数量的减少。(A)指定处理组结肠组织H&E染色的代表性图像。比例尺,100μm。(B)指定处理组结肠组织PAS染色的代表性图像。比例尺,100μm。(C–D)指定处理组的组织学损伤评分和肠隐窝结肠组织数量的量化(n=6)。(E)来自指定处理组的结肠组织中杯状细胞数量的定量。误差条表示平均值±SEM(n=6)。与NS+Control组相比*p<0.05,与NS+AOM/DSS组相比,#p<0.05。
免疫组织化学染色显示,给予低剂量、中剂量和高剂量XHP治疗显著抑制了AOM/DSS诱导的结肠炎小鼠中浸润MPO阳性细胞的增加(图4A–C)和CD68阳性细胞(图4B–D)。

图4 XHP抑制结肠炎的肠道炎症细胞浸润。(A–B)用针对MPO或CD68的抗体对来自指定处理组的结肠组织中的MPO阳性细胞和CD68阳性细胞进行免疫组织化学染色。比例尺,100μm。(C–D)所示处理组结肠组织中MPO阳性细胞和CD68阳性细胞数量的量化。误差条表示平均值±SEM(n=6)。与NS+Control组相比*p<0.05,与NS+AOM/DSS组相比,#p<0.05。
结肠炎组结肠组织中通过ELISA检测到的IL-6、IL-22和TNF-α水平以及通过蛋白质印迹检测到的IL-1β水平显著增加(图5A–D),而低剂量和高剂量XHP治疗显著抑制了结肠组织中IL-6的增加(图5A)。此外,我们确定低剂量、中剂量和高剂量的XHP治疗显著抑制了从结肠组织中提取的蛋白质中IL-22、IL-1β和TNF-α的增加(图5B–D)。总之,这些结果支持XHP改善结肠炎期间的炎症细胞浸润和促炎细胞因子释放。
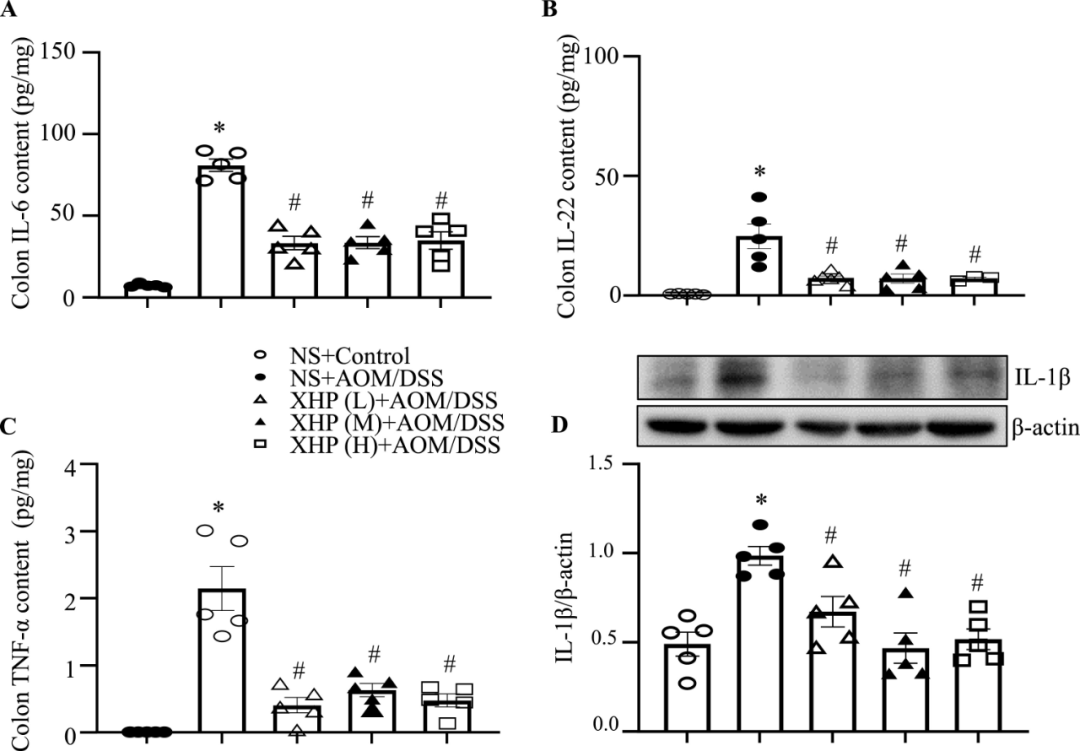
图5 XHP下调结肠组织中促炎细胞因子的产生。(A–C)通过ELISA检测指示处理组结肠组织中IL-6、TNF-α和IL-22的含量。误差条表示平均值±SEM(n=6)。(D)通过蛋白质印迹检测IL-1β的含量,并显示蛋白质印迹结果的定量。误差条表示平均值±SEM(n=5)。与NS+Control组相比*p<0.05,与NS+AOM/DSS组相比,#p<0.05。
我们进行非标记定量蛋白质组学技术,以揭示对照组、结肠炎组和XHP低剂量给药组结肠组织中蛋白质表达的变化。共有1153种蛋白质被成功鉴定,其中至少有一种独特的肽,错误发现率(FDR)低于1%。具有1.5倍变化和显著p值(p < 0.05)的蛋白质被鉴定为两组之间的差异表达蛋白质(DEP)。结肠炎组和对照组共鉴定出315个DEPs(图6A)。在这些下调的蛋白质中,与结肠炎组相比,XHP低剂量显著抑制了结肠炎小鼠中73种蛋白质的下调(图6B)。在这些蛋白质中,Claudin-7(Cldn7),Claudin蛋白家族的一员,作为紧密连接形成所必需的骨架蛋白发挥作用(图6C)。
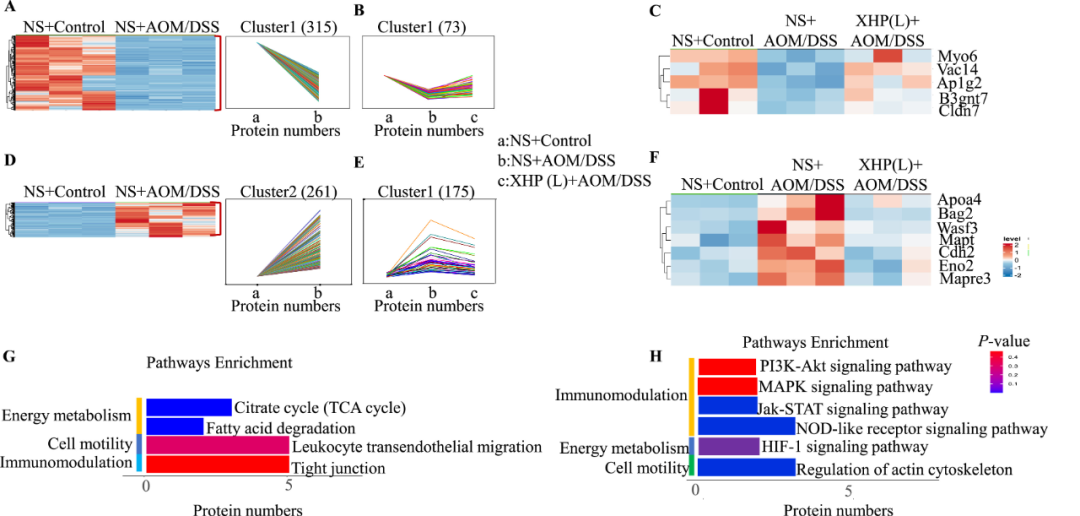
图6 蛋白质组学分析鉴定了差异表达的蛋白质。(A)与NS+AOM/DSS组相比,NS+Control组结肠组织下调差异蛋白的线图和热图。(B)与NS+AOM/DSS组相比,XHP预防性给药2周,发现其可抑制下调差异蛋白的线图。(C)与NS+AOM/DSS组相比,低剂量预防性给予XHP 2周可抑制下调的差异蛋白的热图。(D)与NS+Control组相比,NS+AOM/DSS组上调了差异蛋白的线图和热图。(E)与NS+AOM/DSS组相比,XHP预防性给药2周,抑制上调的差异蛋白的线图。(F)与NS+AOM/DSS组相比,XHP预防性给药2周,抑制上调的差异蛋白的热图。(G)XHP低剂量预防性给药2周抑制的下调差异蛋白的KEGG信号通路。(H)XHP低剂量预防性给药2周抑制的上调差异蛋白的KEGG信号通路。
我们发现261种蛋白质在结肠炎组和对照组之间显著上调(图6D),其中XHP处理后175种蛋白质(例如Bag2、Cdh2和Eno2)在结肠炎小鼠体内的表达水平下调(图6E和F)。此外,使用KOBAS(http://bioinfo.org/kobas)中的基因本体论将XHP治疗后结肠炎小鼠中上调和下调的差异蛋白分为不同的KEGG途径(图6G和H)。这些响应XHP治疗的上调KEGG途径包括柠檬酸盐循环、脂肪酸降解和紧密连接途径,这些途径与能量代谢和细胞运动密切相关(图第6G段)。XHP治疗下下调的KEGG通路包括PI3K-AKT、MAPK、JAK-STAT、NOD样受体和HIF通路,这些通路与炎症和肿瘤发生密切相关(图6H)。总之,这些发现支持了这样一种观点,即XHP通过上调紧密连接和能量代谢以及下调炎症来改善粘膜屏障损伤和炎症细胞浸润,从而改善结肠炎。
为了研究XHP进入血液后的成分和潜在作用,在灌胃前和灌胃后0.5 h、1 h、2 h和4 h采集1.8 g/kg XHP处理小鼠的血清。在正离子和负离子模式下采用四极杆飞行时间质谱法(HPLC/Q-TOF-MS)测定XHP的所有组分,保留时间为0-30 min(图7A)。
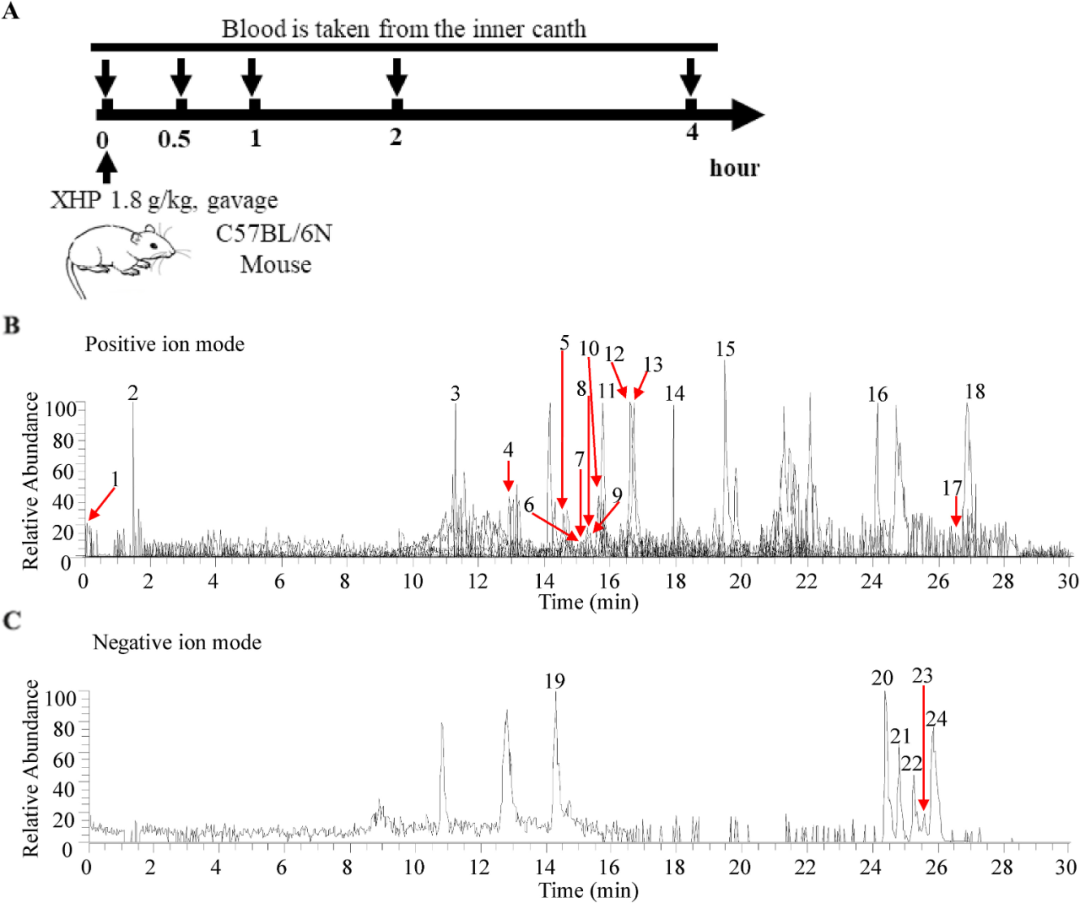
图7 XHP吸收到血液中的原型成分的鉴定。(A)XHP的原型成分被吸收到血液中的示意图。(B–C)HPLC/Q-TOF-MS在正离子和负离子模式下检测到的XHP原型成分吸收到血液中的基峰色谱图。
基于TCMSP(中药系统药理学数据库和分析平台)中总结的XHP主要成分和以前的文献,使用Xcalibur软件绘制了不同时间点与这些成分相关的色谱图和质谱图。结果表明,XHP的24个原型成分被吸收到血液中(图7B和C,补充图S1A–S1B和表1)。
8. XHP原型成分吸收到血液中的可能靶点以及改善AOM/DSS诱导结肠炎的靶点
根据化合物靶点的预测和以往的研究,根据概率>60%,对24种血液进入成分中的419个靶点进行了检查。我们将选定的XHP血液进入成分与XHP结肠炎改善靶点进行了比较,以揭示它们之间的联系。药物相关靶点分析表明,XHP入血成分的化合物结构模拟相互作用共鉴定出419个相关靶点。在接受XHP治疗的结肠炎小鼠中173种下调蛋白中,有7种蛋白被鉴定为XHP的候选靶点,即Ctsb、Fgf2、Plg和Sting1(图8A),它们与结肠炎进展过程中的紧密连接和巨噬细胞活化有关。我们还鉴定了XHP治疗后结肠炎小鼠中73种上调蛋白中的7种蛋白,包括Abat(图8B)。
进一步的DEPs与血中XHP主要成分的可能靶点对接表明,牛黄中的熊果酸可以抑制Fgf2和Sting1的上调,以及Lgals3的下调。此外,最初在乳香中鉴定的L-le可能阻碍Ctsb的上调和Abat的下调。没药和麝香中的油酸能抑制Plg的上调。这些结果表明,XHP中进入血液的牛黄、乳香、没药和麝香成分通过靶向各种蛋白质(包括Ctsb、Fgf2、Plg、Sting1和Lgals3)改善结肠炎(图8C)。
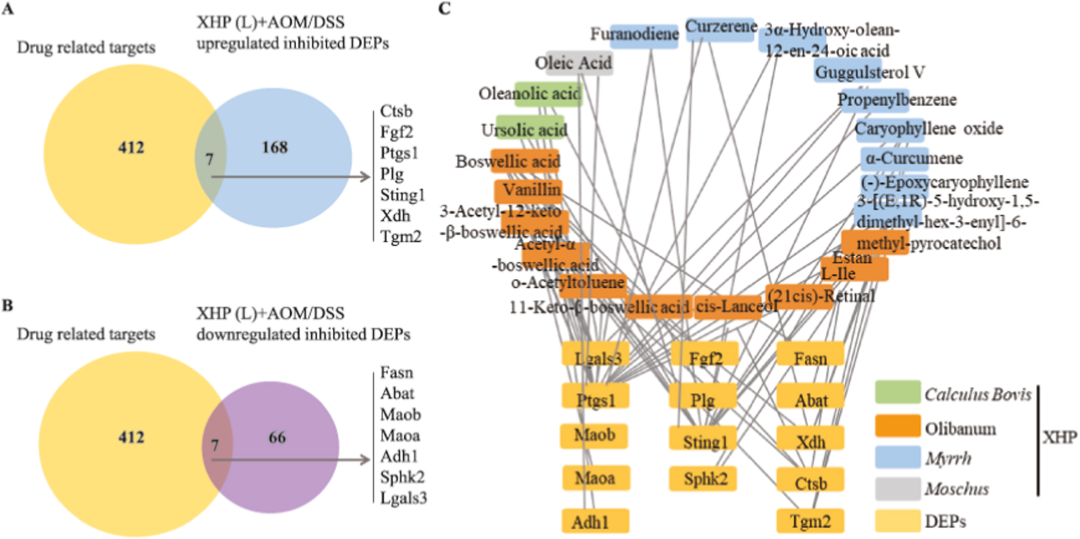
图8 XHP入血的原型成分的可能靶点鉴定,以及改善AOM/DSS诱导的结肠炎的靶点。(A–B)XHP原型成分的维恩图,以改善结肠炎的可能靶点。(C)可能的靶点与能够入血的XHP原型成分之间的相互作用。
在临床实践中,UC复发可显著增加结肠炎相关结肠癌的风险。为了真实地复制临床环境中UC的慢性性质,我们在研究中使用了AOM/DSS诱导的结肠炎模型。具体而言,我们选择了2周AOM/DSS小鼠模型,以与UC患者的生理状况非常相似。我们的研究结果表明,XHP有效地防止了结肠炎患者的体重减轻和结肠缩短,同时保持了紧密连接蛋白的表达并保持了结肠粘膜屏障的完整性。此外,XHP显著减少了MPO阳性和CD68阳性细胞在结肠炎小鼠结肠组织中的浸润,并抑制了结肠组织中IL-6、IL-22、IL-1β和TNF-α水平的升高。值得注意的是,我们的研究表明,XHP含有24种化合物,并通过调节与粘膜屏障损伤和炎症密切相关的多种蛋白质,如Ctsb、Sting1和Abat,在结肠炎中发挥其治疗作用。在我们的研究中,XHP在低剂量、中剂量和高剂量下的疗效通过以下实验指标来反映。我们发现,低剂量、中剂量和高剂量给药组表现出不同水平的疗效。低剂量给药导致结肠组织中Claudin-5表达水平和杯状细胞数量增加最明显。尽管我们目前缺乏足够的证据来支持低剂量XHP在改善结肠炎方面具有优越效果的观点,但我们的研究提供了有价值的见解,即在临床实践中减少XHP的剂量可能会改善治疗结果。
结肠炎的发病机制是一个复杂的过程,包含许多细胞类型、细胞因子和信号通路。我们确定XHP对结肠炎的负面影响与其对紧密连接介导的肠上皮细胞屏障、杯状细胞介导的肠道粘膜屏障、中性粒细胞和巨噬细胞浸润途径以及促炎细胞因子途径的调节有关。我们的研究表明,XHP能够抑制AOM/DSS诱导的结肠炎小鼠中紧密连接蛋白(包括Claudin-5和Occludin)的表达减少以及杯状细胞数量的减少。Claudin-5和Occludin是存在于肠上皮细胞之间的紧密连接蛋白,负责维持肠粘膜屏障和减少渗出。先前的研究已经确定,异常的能量代谢会导致细胞内ATP含量降低,从而促进F-肌动蛋白脱落为G-肌动蛋白,支持紧密连接蛋白。哨兵杯状细胞通过触发Muc-2分泌来保护结肠隐窝,据报道,这与能量代谢密切相关。此外,在HIF-1α表达和糖酵解的影响下,中性粒细胞通过结肠隐窝内的积聚和激活,在保持肠道稳态和促进粘膜愈合方面发挥着至关重要的作用。据记载,XHP可改善三羧酸循环和葡萄糖代谢,并增强能量代谢。一致地,我们的蛋白质组学分析表明,XHP可以抑制三羧酸循环和糖酵解中关键酶的异常表达,包括丙酮酸羧化酶(Pc)和ATP柠檬酸合成酶(Acly)。后续应该进一步探索XHP抑制结肠渗出和提高紧密连接蛋白表达的作用是否与其增强肠组织内的能量代谢有关。
在本研究中,非标记定量蛋白质组学分析在AOM/DSS诱导的结肠炎小鼠的结肠组织中发现了315个下调和261个上调的蛋白质。这些蛋白质被分为不同的KEGG途径,包括TLR4/NF-κB/IL-6途径、HIF-1途径、NOD样受体(NLR)激活、趋化因子释放和巨噬细胞募集。重要的是,蛋白质组学检测和分析表明,低剂量XHP可以抑制73种蛋白质如Pc、Acly和Claudin-7的下调,改善能量代谢以缓解结肠粘膜屏障损伤和结肠渗出。此外,我们确定,在结肠炎的发展过程中,低剂量的XHP可以通过多途径调节抑制175种蛋白质的上调,包括Bag2、Cdh2和Eno2。慢性炎症是肿瘤进展的催化剂,导致结肠各区域通过田状癌变出现发育异常的前体病变。先前的研究表明,c-MYC蛋白的下游靶点Bag2可以拮抗细胞凋亡,促进结直肠癌细胞增殖和化疗耐药性。Eno2催化2-磷酸甘油酸盐在糖酵解过程中转化为磷酸烯醇式丙酮酸盐,Eno2竞争性抑制YAP1的磷酸化,导致上皮-间质转化过程,并促进结直肠癌细胞迁移和侵袭。我们的研究结果表明,低剂量XHP可能抑制炎症性癌症从结肠炎转化为癌症。今后,研究人员应进一步研究XHP对大肠杆菌相关癌症发生发展的影响。
XHP及其主要成分已被证明对结肠炎具有抗炎作用,但进入血液的XHP成分和XHP对抗炎症的机制尚未揭示。HPLC/Q-TOF-MS分析表明,XHP含有24种进入血液的成分,包括牛黄中的熊果酸和齐墩果酸、乳香中的11-β-carbonyl-boswellic acid、l-lle和3-acetyl-12-keto-β-boswellic acid,没药中的α-姜黄烯,3-[(E,1R)-5-hydroxy-1,5-dimethyl-hex-3-enyl]-6-methyl-pyrocatechol和guggulsterol V。药物相关靶点分析表明,牛黄中的主要成分熊果酸可抑制Ctsb、Fgf2和Sting1的上调,并降低Lgals3的下调。同样,乳香中的L-lle可抑制Ctsb的上调和Abat的下调。Sting1已被证明可调节巨噬细胞的铁死亡和炎症反应,Abat参与保护细胞免受炎症反应过程中巨噬细胞引起的氧化损伤。我们的研究结果表明,XHP通过调节Sting1和Abat的表达水平,对结肠炎发展过程中的炎症反应发挥抑制作用。后续将进一步探索进XHP的入血成分对炎症反应的影响并确定其直接靶点。
我们证明XHP能够改善AOM/DSS诱导的结肠炎。我们发现XHP有助于抑制结肠炎小鼠的体重减轻和结肠缩短,降低结肠粘膜屏障的通透性,并提高Claudin-5和Occludin的表达水平。此外,XHP降低了结肠组织中浸润性MPO阳性细胞和CD68阳性细胞的数量,并增加了受损结肠组织中促炎细胞因子的数量,包括IL-6、IL-22、IL-1β和TNF-α。我们发现XHP由24种原型成分组成,这些成分进入血液,并通过调节各种蛋白质改善结肠炎,包括Ctsb、Sting1和Abat,这些蛋白质与粘膜屏障损伤和炎症有关。我们的研究为更好地理解XHP治疗结肠炎的有益作用的机制提供了新的见解。
https://www.sciencedirect.com/science/article/pii/S0378874123009662?via%3Dihub













