【论著】| 胃癌中FKBP1A高表达的预后价值及其靶向PI3K/AKT对糖代谢的调控作用
时间:2023-09-10 16:58:03 热度:37.1℃ 作者:网络
[摘要] 背景与目的:胃癌是常见的消化道恶性肿瘤之一,FKBP脯氨酸异构酶1A(FKBP prolyl isomerase 1A,FKBP1A)参与多种肿瘤的发生、发展,但在胃癌中的生物学作用及机制尚未明确。本研究旨在探讨FKBP1A在胃癌组织中的表达水平及预后价值,分析其调控胃癌进展的可能途径和机制。方法:免疫组织化学观察FKBP1A在胃癌中的表达情况并结合生物信息学与临床病理学参数分析其与预后不良的相关性;采用Kaplan-Meier生存曲线描述FKBP1A对胃癌患者术后5年生存率的影响,采用COX多因素回归分析探讨影响胃癌患者术后生存率的独立预后因素;通过受试者工作特征(receiver operating characteristic,ROC)曲线分析FKBP1A表达在胃癌患者中的诊断价值;基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析FKBP1A的生物学功能及可能参与的信号转导通路,体外构建慢病毒转染的MGC803细胞模型,探究FKBP1A对MGC803细胞糖代谢和恶性生物学行为的影响以及可能的分子机制,并构建裸鼠移植瘤模型加以验证。结果:免疫组织化学检测结果显示,FKBP1A在胃癌中呈高表达(P<0.01),生物信息学与临床参数分析结果显示,其与患者预后不良相关;Kaplan-Meier生存分析和COX回归分析显示,FKBP1A表达量与患者5年生存率呈负相关,且其与外周血癌胚抗原(carcinoembryonic antigen,CEA)≥5 μg/L、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)≥37 kU/L、T分期(T3~T4期)和N分期(N2~N3期)是影响胃癌患者术后5年生存率的独立预后因素(P<0.05);ROC曲线分析表明,FKBP1A高表达具有较好的预后诊断价值(P<0.01);GO和KEGG富集分析推测FKBP1A可能参与调节胃癌细胞糖代谢。体外实验显示,过表达FKBP1A促进MGC803细胞糖代谢、增殖、侵袭和迁移,沉默FKBP1A则相反(P<0.05)。在体实验显示,胃癌细胞过表达FKBP1A促进裸鼠移植瘤的生长,而沉默则抑制之(P <0.05)。机制分析表明,过表达FKBP1A上调胃癌细胞中磷酸化的磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)和磷酸化的蛋白激酶B(protein kinase B,AKT)的表达,而沉默则下调之 (P<0.05)。结论:FKBP1A在胃癌组织中高表达且与患者预后不良相关,可能是通过激活PI3K/AKT促进胃癌细胞的糖代谢和恶性生物学行为。
[关键词] 胃癌;FKBP脯氨酸异构酶1A;预后;糖代谢;磷酰脂肌醇3激酶/蛋白激酶B
[Abstract] Background and purpose: Gastric cancer is one of the common gastrointestinal malignancies. FKBP1A has been reported to be involved in the occurrence and development of various tumors, but the biological role and mechanism of it in gastric cancer remain unclear. This study aimed to investigate the expression level and prognostic value of FKBP1A in gastric cancer tissues, and to analyze the possible pathways and mechanisms of its regulation of gastric cancer progression. Methods: The expression of FKBP1A in gastric cancer was observed by immunohistochemistry, and its correlation with poor prognosis was analyzed by combining bioinformatics and clinicopathological parameters. Kaplan-Meier survival curve was used to analyze the effect of FKBP1A on the 5-year survival rate of patients with gastric cancer after surgery, and COX multivariate regression analysis was used to explore the independent prognostic factors affecting the 5-year survival rate of patients with gastric cancer after surgery. The diagnostic value of FKBP1A expression in patients with gastric cancer was analyzed using receiver operating characteristic (ROC) curve. Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) were used to enrich and analyze the biological function of FKBP1A and the possible signal pathways involved. We constructed the MGC803 cell model transfected with lentivirus in vitro, explored the influence of FKBP1A on the glucose metabolism and malignant biological behavior of MGC803 cells, and the possible molecular mechanism involved, and established a nude mouse transplantation tumor model in vitro to verify it. Results: Immunohistochemical results showed that FKBP1A was highly expressed in gastric cancer (P<0.01), and bioinformatics and clinical parameter analysis showed that FKBP1A was associated with poor prognosis. Kaplan-Meier survival analysis and COX regression analysis showed that the expression level of FKBP1A was negatively correlated with 5-year survival. And carcinoembryonic antigen (CEA)≥5 μg/L, carbohydrate antigen (CA) 19-9≥37 kU/L, T stage (T3-T4) and N stage (N2-N3) were independent prognostic factors affecting the 5-year survival rate of gastric cancer patients after surgery (P<0.05). ROC analysis showed that high expression of FKBP1A had good prognostic value (P<0.01). Enrichment of GO and KEGG suggested that FKBP1A was involved in regulating glucose metabolism in gastric cancer cells. In vitro experiments showed that overexpression of FKBP1A promoted glucose metabolism and proliferation, invasion and migration of MGC803 cells, while silencing of FKBP1A did the opposite (P<0.05). In vivo experiments showed that overexpression of FKBP1A in gastric cancer cells promoted the growth of transplanted tumor in nude mice, while silencing FKBP1A inhibited it (P<0.05). Mechanism analysis showed that overexpression of FKBP1A upregulated the expressions of phosphatidylinositol 3-kinase (PI3K) and protein kinase B (AKT) in gastric cancer cells, while silencing FKBP1A downregulated the expressions (P<0.05). Conclusion: FKBP1A is highly expressed in gastric cancer tissues, and is associated with poor prognosis, which may be due to the promotion of glucose metabolism and malignant biological behavior of gastric cancer cells by activating PI3K/AKT.
[Key words] Gastric cancer; FKBP prolyl isomerase 1A; Prognosis; Glucose metabolism; Phosphatidylinositol3-kinase/protein kinase B
胃癌是常见的胃肠道恶性肿瘤之一,具有高发病率和高死亡率[1]。随着医疗技术的日益精进,尽管分子靶向药物的应用使患者的预后得到明显的改善,但由于胃癌发病机制不明,导致胃癌患者的死亡率仍然居高不下。胃癌的病理学发展过程归因于癌基因的激活及抑癌基因的失活,可诱发多种恶性生物学行为变化,如瓦博格效应(Warburg effect)[2-3],该效应不仅为癌细胞提供三磷酸腺苷(adenosine triphosphate,ATP)和营养物质,还会形成酸性环境,破坏细胞外基质,促进癌细胞转移[4]。因此,识别调节糖酵解的关键分子可能有助于胃癌患者的预后评估。FKBP脯氨酸异构酶1A(FKBP prolyl isomerase 1A,FKBP1A)属于免疫亲和蛋白FKBP(FK506结合蛋白)家族,其参与多种肿瘤的发生、发展[5-7]。据报道FKBP1A参与调控前列腺癌细胞糖代谢[8],提示FKBP1A是一种潜在的治疗靶点并可能在代谢途径中发挥作用。本研究采用生物信息学结合本机构采集的临床资料分析进一步探讨FKBP1A在胃癌中的表达情况及其对患者预后的影响,并分析其在胃癌中的潜在生物学作用,旨在为临床上探寻新的肿瘤标志物及治疗靶点提供参考。
1 资料和方法
1.1 临床资料
所有标本取自2012年1月—2016年1月在蚌埠医学院第一附属医院胃肠外科行胃癌根治术的患者。所有患者经病理学检查证实为原发性胃癌,且在手术前均未接受过化疗或放疗。根据此标准筛选107例胃癌患者纳入研究。相关临床病理学资料包括年龄、性别、癌胚抗原(carcinoembryonic antigen,CEA)及糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平、肿瘤大小、组织学分型及分级、TNM分期均从蚌埠医学院第一附属医院永久保存的电子病例系统中收集并且通过随访了解患者术后5年的生存情况,随访时间截至2021年3月。
1.2 实验试剂
人胃癌细胞系MGC803细胞购自国家生物医学实验细胞资源库,BALB/c裸小鼠购自江苏集萃药康生物科技股份有限公司,一抗FKBP1A购自武汉三鹰生物技术有限公司,二氨基联苯胺(diaminobenzidine,DAB)和酶标山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)聚合物购自北京中杉金桥生物技术有限公司,苏木精和细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂购自北京索莱宝科技有限公司,胎牛血清(fetal bovine serum,FBS)、RPMI-1640培养基均购自美国Gibco公司,慢病毒购自上海吉凯基因医学科技股份有限公司,PI3K抑制剂LY294002购自美国MCE公司,放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer,RIPA)和二辛可宁酸(bicinchoninic acid,BCA)试剂盒购自上海碧云天生物技术有限公司,β-actin、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase)、蛋白激酶B(protein kinase B,AKT)、磷酸化的PI3K (phosphorylated PI3K,p-PI3K)、磷酸化的AKT(phosphorylated AKT,p-AKT)、己糖激酶(hexokinase 2,HK2)、葡萄糖转运蛋白1(glucose transporter type 1,GLUT1)和乳酸脱氢酶A(recombinant lactate dehydrogenase A,LDH-A)一抗以及葡萄糖测定试剂盒、乳酸测定试剂盒和丙酮酸测定试剂盒均购自英国Abcam公司,transwell小室购自美国Corning公司。
1.3 方法
1.3.1 生物信息学分析
胃癌阵列数据取自癌症基因组图谱(The Cancer Genome Atlas,TCGA)、基因表达综合数据库(Gene expression omnibus,GEO)和基于基因表达水平值的交互式分析平台(Gene Expression Profiling Interactive Analysis,GEPIA)。使用TIMER 2.0(https://cistrome. shinyapps.io/timer/)对不同肿瘤的癌组织和相应正常组织中的FKBP1A表达进行差异分析。Kaplan-Meier Plotter(http://kmplot.com/analysis/)用于评估FKBP1A与生存结局之间的关系。使用UALCAN(http://ualcan.path.uab.edu/index.html)研究FKBP1A表达与临床病理学特征(癌症分期、肿瘤分级、淋巴结转移、组织学分型)的相关性。GEPIA(http://gepia.cancer-pku. cn/)用于评估胃癌组织中FKBP1A与相关蛋白的关系。通过基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集来探讨FKBP1A作用的潜在机制。
1.3.2 免疫组织化学检测
从病理科调取纳入的107例患者胃癌及其邻近癌旁组织蜡块,制成4 μm的切片,经二甲苯脱蜡、乙醇梯度水合、柠檬酸钠缓冲液抗原修复、10%山羊血清封闭、温育一抗FKBP1A (1∶500)和二抗,DAB显色,苏木精复染和封片。利用Image-Pro Plus 6.0软件计算相对积分光密度(integral optical density value,IOD)值。
1.3.3 细胞培养和转染
MGC803细胞培养于含有10%FBS的RPMI-1640培养基中。采用慢病毒转染技术构建LV-FKBP1A组和Si-FKBP1A组(siRNA:UUUCUU UCCAUCUUCAAGCAUGCUUGAAGAUGGAA AGAAAUU),利用含嘌呤霉素的培养基培养1周后获得稳定的细胞系用于后续实验[9]。
利用PI3K抑制剂LY294002进行机制验证,将过表达FKBP1A的MGC803细胞接种到6孔板(2×105个/孔)种,待细胞稳定后换成无血清培养基培养24 h,再加入50 μmol/L的LY294002诱导6 h[10],设置成LY294002组。
1.3.4 构建裸小鼠移植瘤模型
动物实验选取4~6周龄雄性BALB/c裸小鼠。将所有裸小鼠随机分为control组、LV-FKBP1A组和Si-FKBP1A组,每组3只。收集LV-FKBP1A、Si-FKBP1A稳定表达的细胞株和control组细胞,使用完全培养基重悬细胞(1×107个),各取100 μL经皮下注射到裸小鼠背部。6 d后,通过游标卡尺测量异种移植瘤的宽度(W)和长度(L),每3 d记录1次,并使用公式V=(W2×L)/2计算肿瘤体积(V)。注射后3周,对裸小鼠实施安乐死,切除肿瘤匀浆后进行Western blot检测。
1.3.5 蛋白质印迹法(Western blot)检测
细胞和移植瘤在冰上经RIPA裂解液裂解30 min,离心收集总蛋白,依次经BCA试剂盒测定蛋白质浓度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离等量蛋白和转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。膜再经脱脂牛奶室温封闭、于4 ℃过夜温育一抗(β-actin、PI3K、AKT、p-PI3K、p-AKT、HK Ⅱ、GLUT1和LDH-A,1∶1 000)和洗涤后温育二抗。滴加电化学超敏发光液(electrochemical luminescence,ECL),经凝胶成像系统采集图片,最后经Image J软件分析目的条带的灰度值,并计算蛋白相对表达量。
1.3.6 葡萄糖摄取量、乳酸和丙酮酸生成量的检测
转染后的MGC803接种到6孔板中(2×105个/孔),于37 ℃温育24 h。收集上清液,根据制造商操作步骤,使用葡萄糖测定试剂盒、乳酸测定试剂盒和丙酮酸测定试剂盒测定葡萄糖摄取量以及乳酸和丙酮酸生成量。
1.3.7 Transwell实验检测MGC803细胞侵袭和迁移
24孔transwell小室(8.0 µm)上室滴加40 µL的基质胶,待其凝固后接种200 µL重悬于无血清培养中的各组MGC803细胞(4×104个/孔),下室加入1 mL含10%FBS的RPMI-1640培养基,培养48 h后,经4%的多聚甲醛溶液固定和0.2%的结晶紫染色后,用棉签去除聚碳酸酯膜内表面的细胞,并在显微镜下拍照计数,评估细胞侵袭能力;细胞迁移的检测,除transwell小室不加基质胶外,其余的操作步骤同上。
1.3.8 CCK-8实验检测MGC803细胞增殖
将各组MGC803细胞接种于96孔板中(5×103个/孔),待细胞贴壁并培养48 h后,每孔加入10 µL的CCK-8试剂,37 ℃温育2 h。随后利用酶标仪测量450 nm处的吸光度(D)值以计算细胞生长速率。
1.3.9 统计学处理
采用SPSS 22.0软件对数据进行分析。计量资料表示为x±s,两组间比较采用t检验,多组间比较采用单因素方差分析和Tukey多重检验法。通过χ2检验分析组间的计数资料差异。使用Kaplan-Meier法进行生存分析,并通过log-rank χ2检验比较曲线之间的差异。胃癌患者术后5年总生存(overall survival,OS)率的独立预后因素使用COX比例风险模型评估。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析FKBP1A的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 FKBP1A在胃癌组织中的表达情况及其与预后的相关性
TIMER 2.0数据库显示,FKBP1A在胃癌和食管癌等多数肿瘤组织中呈高表达(图1A)。免疫组织化学结果显示,胃癌中FKBP1A的表达高于癌旁组织,且主要表达于细胞质中(P<0.01,图1B、1C)。Kaplan-Meier Plotter数据库进一步分析表明,高表达FKBP1A显著缩短胃癌患者的OS、首次进展生存期(first progression survival,FPS)和复发后生存期(post-progression survival,PPS),提示FKBP1A的表达与胃癌患者预后不良相关(图1D)。
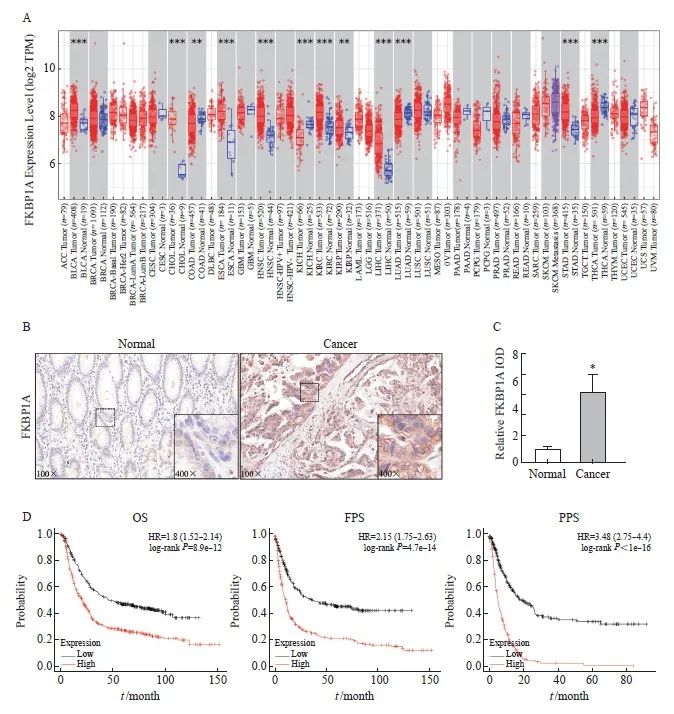
图1 FKBP1A在胃癌组织中高表达且与患者预后不良相关
Fig. 1 FKBP1A is highly expressed in gastric cancer and is associated with poor prognosis
A: TIMER 2.0 database analysis of FKBP1A expression difference between cancer tissue and normal tissue; B-C: Immunohistochemical staining of FKBP1A in gastric cancer tissue and the adjacent tissue (×100); D: Kaplan-Meier Plotter database analysis of the correlation between FKBP1A and total survival of gastric cancer patients. *: P<0.05, compared with normal tissues.
2.2 胃癌组织中FKBP1A的表达量与临床病理学参数间的关系
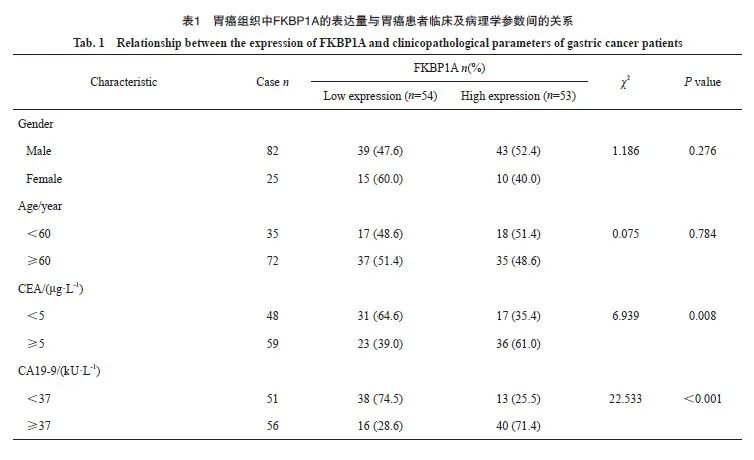
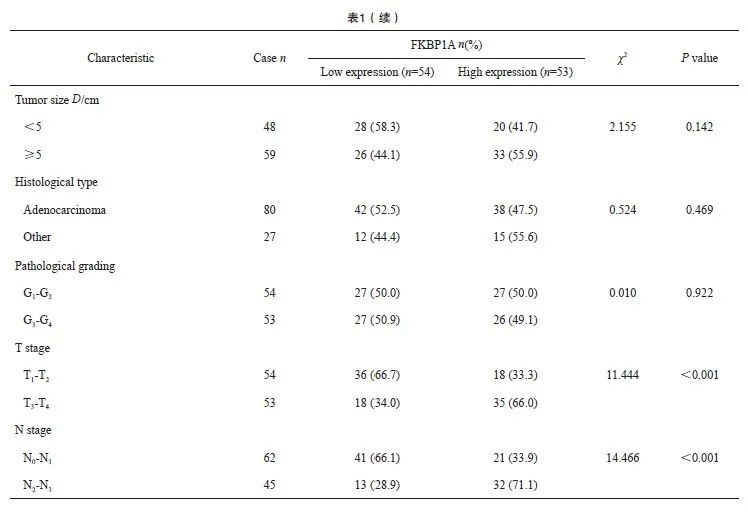
UALCAN数据库分析显示,FKBP1A的表达水平与胃癌患者临床病理学特征之间存在相关性(图2A~D)。以胃癌患者FKBP1A相对表达量IOD的中位数为界,将患者分为FKBP1A高表达组(>2.66)和FKBP1A低表达组(≤2.66)。FKBP1A的高表达与胃癌患者CEA≥5 μg/L、CA19-9≥37 kU/L、T分期(T3~T4期)和N分期(N2~N3期)显著相关(表1)。
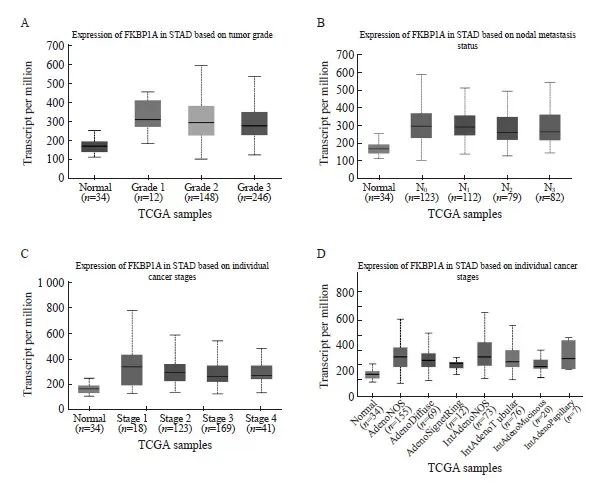
图2 胃癌组织中FKBP1A的表达量与临床病理学参数间的关系
Fig. 2 The relationship between FKBP1A expression and clinicopathologic parameters in gastric cancer
A-B: UALCAN database analysis showed that the expression level of FKBP1A was correlated with tumor grade and stage; C-D: Lymph node metastasis and histological type in patients with gastric cancer.
2.3 胃癌组织中FKBP1A的表达量对根治术后5年OS率的影响
Kaplan-Meier生存分析显示,FKBP1A高表达组的患者术后5年OS率低于FKBP1A低表达组(P<0.001,图3)。
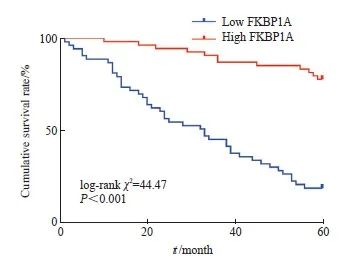
图3 胃癌组织中FKBP1A的表达量对患者根治术后5年OS率 的影响
Fig. 3 Effect of FKBP1A expression in gastric cancer tissue on 5-year OS rate after radical rep
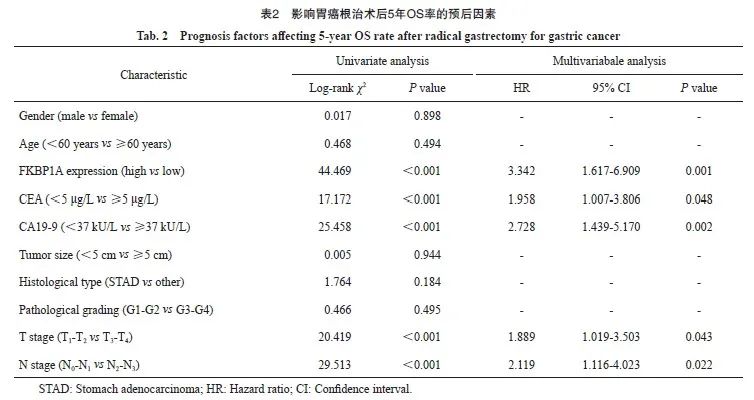
2.4 影响胃癌根治术后5年OS的单因素及多因素分析
单因素分析结果显示,FKBP1A高表达、CEA≥5 μg/L、CA19-9≥37 kU/L、T分期(T3~T4期)和N分期(N2~N3期)是影响胃癌患者术后5年OS率的预后因素。多因素Cox回归分析结果显示,以上变量均是是影响患者5年OS率的独立预后因素(表2)。
2.5 FKBP1A表达量对胃癌根治术后5年生存情况的预判价值
探究FKBP1A对患者的预后评估是否有参考价值,ROC曲线显示,以FKBP1A相对表达量2.680为截点值,曲线下面积(area under curve,AUC)为0.806(P<0.01),灵敏度为76.36%,特异度为82.69%(图4)。
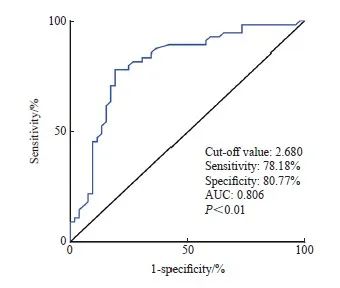
图4 FKBP1A表达量对患者胃癌根治术后5年生存情况的预判价值
Fig. 4 The predictive value of FKBP1A expression on 5-year survival after radical rep of gastric cancer
2.6 胃癌组织中FKBP1A与糖代谢的相关性
KEGG与GO预测分析表明,FKBP1A可能参与调控胃癌的代谢途径(图5A、B)。进一步利用GEPIA数据库预测发现,FKBP1A表达量与糖酵解3个关键限速酶(HK2、PFKFB3、PK)的mRNA水平呈正相关(P<0.01,图5C~E)。
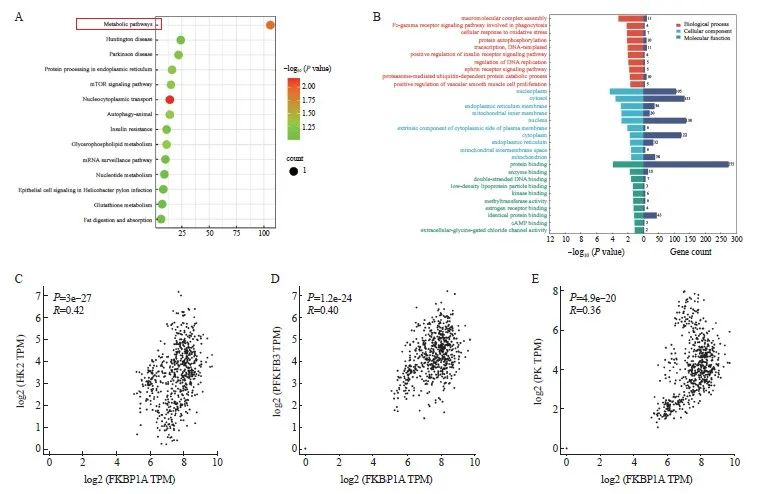
图5 胃癌组织中FKBP1A与糖代谢的相关性
Fig. 5 Correlation between FKBP1A and glucose metabolism in gastric cancer
A: KEGG enriched FKBP1A related signal pathway; B: GO enrichment predicted FKBP1A biological function; C-E: GEPIA database determined the correlation between the mRNA level of FKBP1A and HK2, PFKFB3 and PK.
2.7 FKBP1A对MGC803细胞糖代谢的影响
慢病毒转染干预MGC803细胞中FKBP1A的表达,并通过Western blot进行验证(P<0.05,图6A、B)。Si-FKBP1A组的葡萄糖消耗量、乳酸和丙酮酸生成量均显著低于对照组,而LV-FKBP1A组则相反(P<0.05,图6C~E)。Western blot结果显示,MGC803细胞中沉默FKBP1A可显著降低糖代谢相关蛋白水平,而过表达FKBP1A则相反(P<0.05,图6F~G)。
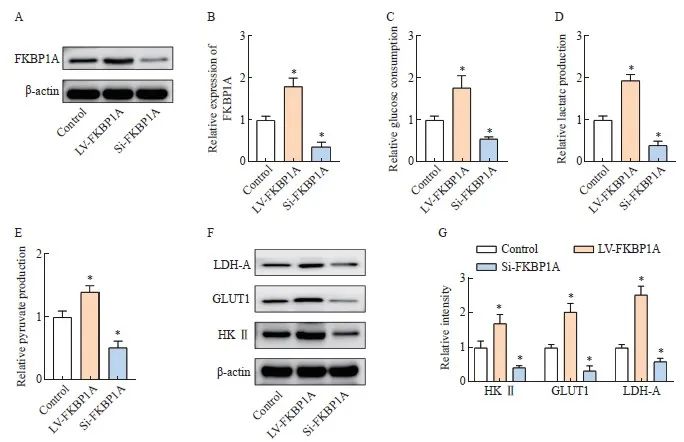
图6 FKBP1A促进胃癌细胞糖代谢
Fig. 6 FKBP1A promotes glucose metabolism in gastric cancer cells
A-B: Expression of FKBP1A after lentivirus transfection; C-E: Glucose consumption, lactic acid and pyruvate production of MGC803; F-G: Western blot detection of glucose metabolism related protein expression. *: P<0.05, compared with control group.
2.8 FKBP1A对MGC803细胞恶性生物学行为的影响
Transwell实验结果显示,si-FKBP1A组 MGC803细胞的侵袭和迁移的细胞数量降低(P <0.05),而LV-FKBP1A组则增加(P <0.05,图7A~C)。CCK-8结果显示,在FKBP1A沉默后,MGC803细胞的增殖能力下降(P<0.05),而过表达FKBP1A则促进MGC803细胞增殖(图7D)。裸鼠皮下成瘤结果表明,LV-FKBP1A组的肿瘤体积显著高于control组,而Si-FKBP1A组的肿瘤体积则减小(P<0.05,图7E~F)。
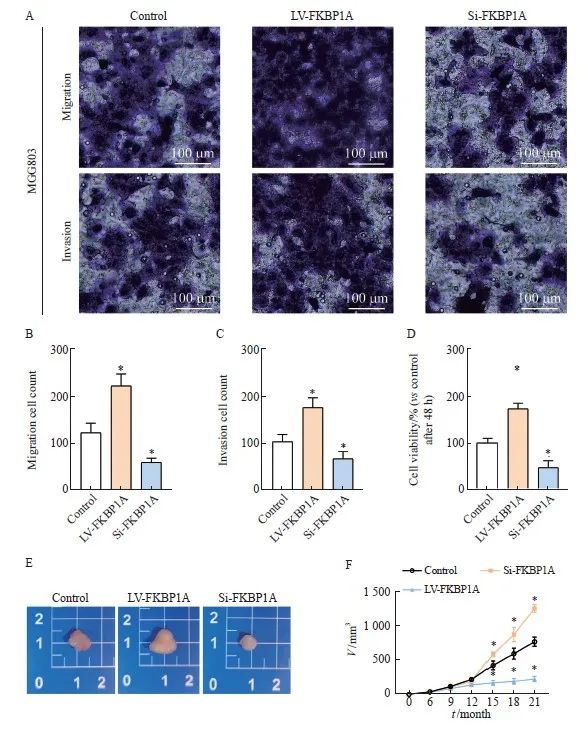
图7 FKBP1A促进MGC803细胞恶性生物学行为
Fig. 7 FKBP1A promotes malignant biological behavior of MGC803 cells
A-C: Transwell invasion assay was performed to determine the invasion and migration ability of each group for 48 h; D: Cell viability was assessed using a CCK-8 assay in MGC803 for 48 h; E-F: Detection of tumor volume size in each group. *: P<0.05, compared with control group.
2.9 FKBP1A激活PI3K/AKT信号转导通路促进糖代谢
PI3K/AKT信号转导通路是直接调控代谢酶或控制调控代谢途径关键成分表达的重要信号转导通路[11]。Western blot检测结果显示,si-FKBP1A组中p-PI3K、p-AKT的表达水平下降,而LV-FKBP1A组则相反(P<0.05,图8A、C)。此外,在移植瘤中,下调FKBP1A抑制p-PI3K、p-AKT表达,而上调则促进表达(P<0.05,图8B、D)。此外,过表达FKBP1A的MGC803细胞经LY294002干预后显著降低p-PI3K、p-AKT的表达水平(P<0.05,图8E~F)。同时葡萄糖消耗量、乳酸和丙酮酸生成量以及相关糖代谢蛋白水平均显著降低(P <0.05,图8G~K)。
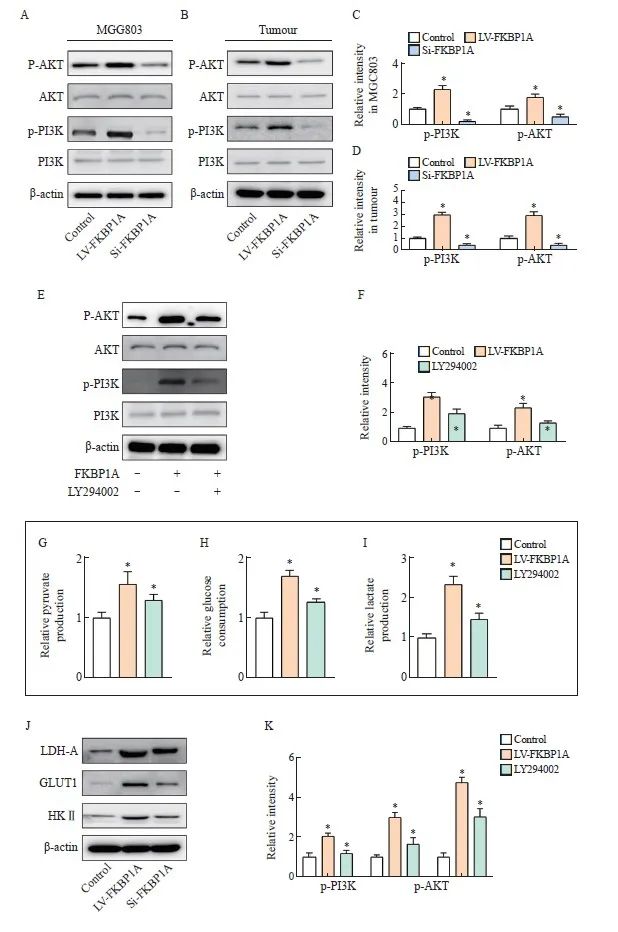
图8 FKBP1A激活PI3K/AKT信号转导通路促进糖代谢
Fig. 8 FKBP1A activated PI3K/AKT signal pathway to promote glucose metabolism
A-D: Detection of phosphorylation expression of PI3K and AKT by Western blot in vitro and in vivo; E-F: Western blot detection of the expression levels of AKT and PI3K after intervention with PI3K inhibitors; G-I: Glucose consumption, lactic acid and pyruvate production of MGC803; J-K: Western blot detection of glucose metabolism related protein expression. *: P<0.05, compared with control group.
2.10 FKBP1A通过激活PI3K/AKT信号转导通路促进MGC803细胞恶性生物学行为
Transwell实验显示,相对于LV-FKBP1A组, LY29400组MGC803细胞的侵袭和迁移能力显著降低(P<0.05,图9A~C)。同时,LY29400组细胞增殖能力也显著低于LV-F KBP1A组(P <0.05,图9D)。
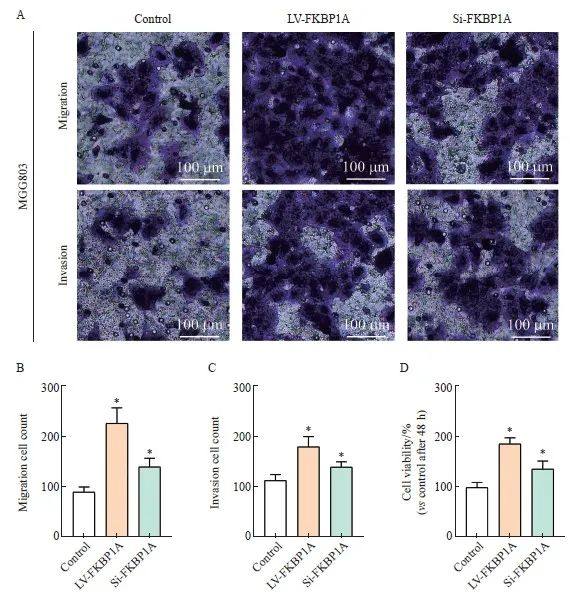
图9 FKBP1A激活PI3K/AKT信号转导通路促进MGC803细胞恶性生物学行为
Fig. 9 FKBP1A activates the PI3K/AKT signaling pathway to promote malignant biological behavior in MGC803 cells
A-C: Transwell invasion assay was performed to determine the invasion and migration ability of each group for 48 h; D: Cell viability was assessed using a CCK-8 assay in MGC803 for 48h. *: P<0.05, compared with control group.
3 讨 论
本研究结果显示,与癌旁组织相比,FKBP1A在胃癌组织中高表达并与患者预后不良相关,且通过激活PI3K/AKT信号转导通路促进胃癌细胞糖代谢及恶性生物学行为。提示FKBP1A可能是评估胃癌预后的潜在指标,同时有望成为胃癌治疗的临床靶点。
FKBP1A蛋白也称为FKBP12,具有与肿瘤相关的多种生物学功能[12]。既往研究表明, AFAP1-AS1可通过miR-195-5p/FKBP1A轴调节前列腺癌细胞对紫杉醇的抗性[13];FKBP1A在头颈部鳞状细胞癌中呈高表达,与淋巴结转移和患者预后不良密切相关[14]。尽管先前的研究表明FKBP1A具有促癌作用,但FKBP1A在胃癌中的作用和潜在机制仍然知之甚少。因此,有必要进一步研究FKBP1A在胃癌进展中的作用,探究其在预测胃癌患者预后中是否具有价值,并为胃癌诊疗提供新思路。
在本研究中,通过TIMER 2.0数据库分析发现,相较于正常组织,FKBP1A在包括胃癌在内的不同癌症组织中,如肾上腺皮质癌、胆管癌等均呈高表达。免疫组织化学检测也显示,胃癌组织中FKBP1A的表达量高于癌旁组织,表明FKBP1A可能是一种促癌基因,参与肿瘤的发生、发展。Kaplan-Meier Plotter数据库中分析胃癌队列FKBP1A表达与OS的关系,发现FKBP1A高表达胃癌患者的OS率、进展期及进展后生存率降低,提示FKBP1A与胃癌患者的预后不良相关。此外,基于UALCAN数据库预测FKBP1A与多种临床参数具有相关性,收集本机构临床资料纳入分析证实FKBP1A的表达水平与胃癌患者CEA≥5 μg/L、CA19-9≥37 kU/L、T分期(T3~T4)和N分期(N2~N3)显著相关。Kaplan-Meier生存分析和COX回归发现FKBP1A表达量与5年OS率呈负相关,且是影响胃癌患者OS率的独立不良预后因素之一。ROC曲线结果进一步表明FKBP1A对于判断胃癌患者预后具有很好的诊断效能,可作为潜在的预后标志物。
然而FKBP1A在胃癌中的相关机制仍不明确,本研究利用生物信息学富集分析发现FKBP1A可能参与胃癌代谢过程。随着对胃癌的深入研究,越来越多的证据表明癌症可以被定义为代谢性疾病[15]。癌细胞由于对营养和能量的过度需求使得体内代谢途径发生改变,也因而获得异常增殖的能力[16]。癌细胞通过糖酵解消耗葡萄糖,而正常细胞则依赖于氧化磷酸化[17]。其中参与糖酵解途径的酶在癌细胞生长和肿瘤发生过程中起着关键作用。我们利用GEPIA数据库测定FKBP1A与糖酵解三个关键限速酶的相关性,发现FKBP1A与HK2、PFKFB3、PK呈正相关,因此我们推测FKBP1A通过调控胃癌细胞糖代谢发挥其生物学作用。体外实验证明沉默FKBP1A基因,MGC803细胞葡萄糖消耗量、乳酸和丙酮酸生成量、糖代谢相关蛋白水平显著降低。并且针对癌细胞的恶性生物学行为,沉默FKBP1A基因可抑制MGC803细胞增殖、侵袭和迁移,体内裸鼠移植瘤实验也验证了可抑制肿瘤生长。
PI3K/AKT信号转导通路是癌症环境中最常被激活的一条通路[11],该通路调节关键代谢过程,包括葡萄糖代谢[18]、大分子生物合成[19]等。已有研究证实,PI3K/AKT信号转导通路参与糖酵解中的多个过程,其可通过磷酸化和激活糖酵解相关酶直接调控代谢过程,或通过控制各种转录因子间接调控代谢过程[20-21]。Ye等[22]研究证实,在裸鼠异种移植模型中,FKBP1A的缺失可显著抑制HCC肿瘤细胞的生长且通过PI3K/AKT/mTOR途径诱导体外和体内自噬,改变肝癌细胞的生物学行为。本研究推测FKBP1A靶向PI3K/AKT信号转导通路参与疾病进展。Western blot检测结果显示,沉默FKBP1A可显著降低p-PI3K、p-AKT的磷酸化水平。此外,在过表达FKBP1A的MGC803细胞中,阻断PI3K/AKT信号转导通路可抑制糖酵解,进一步证实了FKBP1A参与PI3K/AKT信号转导通路,扩展了其调控肿瘤细胞恶性生物学行为的途径。
同时本研究也存在一定的不足。首先,本研究的临床部分结果是通过公共癌症数据库结合本机构纳入的胃癌患者组织标本共同证实的,但是其属于回顾性研究,由于样本量的限制,仍需要收集大量样本进行前瞻性验证,以确定FKBP1A作为胃癌预后预测价值的灵敏度和特异度。其次,胃癌受到多方面因素的影响,如肿瘤细胞的恶性增殖、转移和侵袭等[23],本研究证实FKBP1A促进胃癌细胞的糖代谢,但由于FKBP1A生物学功能的多样性,是否可能通过其他途径或机制参与胃癌进展有待进一步探究。
本研究基于生物信息学分析证实了FKBP1A在胃癌组织中呈高表达且与患者预后不良相关,通过激活PI3K/AKT信号转导通路调控胃癌细胞糖代谢参与恶性生物学行为。本研究揭示了FKBP1A在胃癌中作为新的预后指标的潜力,可望成为胃癌患者临床治疗的潜在靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] RIZZO A, RACCA M, GARROU F, et al. Diagnostic performance of positron emission tomography with fibroblastactivating protein inhibitors in gastric cancer: a systematic review and meta-analysis[J]. Int J Mol Sci, 2023, 24(12): 10136.
[2] YU H, ZHAO K, ZENG H, et al. N6-methyladenosine (m6A) methyltransferase WTAP accelerates the Warburg effect of gastric cancer through regulating HK2 stability[J]. Biomed Pharmacother, 2021, 133: 111075.
[3] ZHAO M Y, WEI F, SUN G W, et al. Natural compounds targeting glycolysis as promising therapeutics for gastric cancer: a review[J]. Front Pharmacol, 2022, 13: 1004383.
[4] ZHONG X Y, HE X F, WANG Y X, et al. Warburg effect in colorectal cancer: the emerging roles in tumor microenvironment and therapeutic implications[J]. J Hematol Oncol, 2022, 15(1): 160.
[5] HOU H, LYU Y L, JIANG J, et al. Peripheral blood transcriptome identifies high-risk benign and malignant breast lesions[J]. PLoS One, 2020, 15(6): e0233713.
[6] LIU Z, ZHANG K, ZHAO Z, et al. Prognosis-related autophagy genes in female lung adenocarcinoma[J]. Medicine (Baltimore), 2022, 101(1): e28500.
[7] ZHANG Y, ZHANG D, LV J, et al. LncRNA SNHG15 acts as an oncogene in prostate cancer by regulating miR-338-3p/FKBP1A axis[J]. Gene, 2019, 705: 44-50.
[8] WANG G, ZHAO H, DUAN X, et al. CircRNA pappalysin 1 facilitates prostate cancer development through miR-515-5p/FKBP1A axis[J]. Andrologia, 2021, 53(11): e14227.
[9] FU L S, WANG X Y, YANG Y, et al. Septin11 promotes hepatocellular carcinoma cell motility by activating RhoA to regulate cytoskeleton and cell adhesion[J]. Cell Death Dis, 2023, 14(4): 280.
[10] BIE Q L, SUN C X, GONG A H, et al. Non-tumor tissue derived interleukin-17B activates IL 17RB/AKT/β-catenin pathway to enhance the stemness of gastric cancer[J]. Sci Rep, 2016, 6: 25447.
[11] HOXHAJ G, MANNING B D. The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism[J]. Nat Rev Cancer, 2020, 20(2): 74-88.
[12] LI Z G, CUI Y, DUAN Q C, et al. The prognostic significance of FKBP1A and its related immune infiltration in liver hepatocellular carcinoma[J]. Int J Mol Sci, 2022, 23(21): 12797.
[13] LENG W, LIU Q, ZHANG S, et al. LncRNA AFAP1-AS1 modulates the sensitivity of paclitaxel-resistant prostate cancer cells to paclitaxel via miR-195-5p/FKBP1A axis[J]. Cancer Biol Ther, 2020, 21(11): 1072-1080.
[14] PATEL D, DABHI A M, DMELLO C, et al. FKBP1A upregulation correlates with poor prognosis and increased metastatic potential of HNSCC[J]. Cell Biol Int, 2022, 46(3): 443-453.
[15] DARANG E, PEZESHKIAN Z, MIRHOSEINI S Z, et al. Bioinformatics and pathway enrichment analysis identified hub genes and potential biomarker for gastric cancer prognosis[J]. Front Oncol, 2023, 13: 1187521.
[16] TANG J, ZHANG C, LIN J, et al. ALOX5-5-HETE promotes gastric cancer growth and alleviates chemotherapy toxicity via MEK/ERK activation[J]. Cancer Med, 2021, 10(15): 5246-5255.
[17] XU T P, YU T, XIE M Y, et al. LOC101929709 promotes gastric cancer progression by aiding LIN28B to stabilize c-MYC mRNA[J]. Gastric Cancer, 2023, 26(2): 169-186.
[18] ZHOU Y, GU H J, SHAO B F, et al. Glycolysis-related gene dihydrolipoamide acetyltransferase promotes poor prognosis in hepatocellular carcinoma through the Wnt/β-catenin and PI3K/ Akt signaling pathways[J]. Ann Transl Med, 2022, 10(22): 1240.
[19] CHENG J, HUANG Y, ZHANG X H, et al. TRIM21 and PHLDA3 negatively regulate the crosstalk between the PI3K/AKT pathway and PPP metabolism[J]. Nat Commun, 2020, 11(1): 1880.
[20] LI Z, JIANG Y, LIU J, et al. Exosomes from PYCR1 knockdown bone marrow mesenchymal stem inhibits aerobic glycolysis and the growth of bladder cancer cells via regulation of the EGFR/ PI3K/AKT pathway[J]. Int J Oncol, 2023, 63(1): 84.
[21] WANG Y Y, ZHOU Y Q, XIE J X, et al. MAOA suppresses the growth of gastric cancer by interacting with NDRG1 and regulating the Warburg effect through the PI3K/AKT/mTOR pathway[J]. Cell Oncol (Dordr), 2023. Online ahead of print.
[22] YE W, SHI Z H, ZHOU Y L, et al. Autophagy-related signatures as prognostic indicators for hepatocellular carcinoma [J]. Front Oncol, 2022, 12: 654449.
[23] JIN G, LV J, YANG M, et al. Genetic risk, incident gastric cancer, and healthy lifestyle: a meta-analysis of genome-wide association studies and prospective cohort study[J]. Lancet Oncol, 2020, 21(10): 1378-1386.


