Cell:跨越10种癌症类型!泛癌蛋白质基因组学分析揭示致癌驱动因素与功能状态的关联
时间:2023-08-31 13:52:06 热度:37.1℃ 作者:网络
肿瘤主要由抑癌基因(TSGs)和原癌基因的基因驱动突变引起,但这些癌症基因突变如何在机制上“驱动”肿瘤发生仍不完全清楚。
临床蛋白质组肿瘤分析联盟(CPTAC)通过整合蛋白质基因组数据,加速了对癌症基本分子机制的理解。迄今为止,该联盟已经获得了10种癌症类型的1000多例广泛的组学数据:结直肠腺癌(COAD)、卵巢高级别浆液性癌(HGSC)、透明细胞肾细胞癌(ccRCC)、头颈部鳞状细胞癌(HNSCC)、肺鳞状细胞癌(LSCC)、子宫内膜癌(UCEC)、肺腺癌(LUAD)、胰导管腺癌(PDAC)、胶质母细胞瘤(GBM)、乳腺癌(BRCA)。因此,通过对不同组学层次的探索,体细胞驱动突变的影响可以追踪到生物结构和功能的单位——蛋白质。
近日,美国圣路易斯华盛顿大学联合CPTAC研究团队在Cell发表了题为“Pan-cancer proteogenomics connects oncogenic drivers to functional states”的文章。该研究扩展了之前以基因组学为中心的泛癌研究,通过识别在RNA、蛋白质和磷蛋白水平上量化的显著顺式效应和远端反式效应,在多个维度揭示了癌症驱动因子的影响。该研究还表明了全面的蛋白质基因组学在理解致癌驱动因子的功能状态及其与癌症发展联系方面的价值。

文章发表在Cell
主要研究内容
基于多组学的泛癌蛋白基因组图谱
该研究处理和分析了来自10种癌症类型的1064个前瞻性病例的蛋白质基因组数据,包括DNA甲基化、转录组、整体蛋白质组和磷酸化蛋白质组等。其中,基于质谱的蛋白质组和磷蛋白质组数据的纳入,将定量特征的数量指数级地扩展到15699个蛋白质和110274个磷酸位点。
为了揭示肿瘤在转录组、蛋白质组和磷酸化蛋白质组中的异质性,研究团队对肿瘤样本进行聚类,共得到四个主要的多组学亚群(亚群A-亚群D),并鉴定了差异表达蛋白(DEPs)和差异磷酸位点(DEPPs)。在功能上,亚群A相关的DEPs在雌激素依赖的基因表达中富集,在DNA修复中富集;亚群B中的DEPs和DEPPs在DNA复制、先天免疫系统和细胞周期中富集,与大量CDKN2A改变一致;亚群C相关的DEPs和DEPPs与细胞外基质(ECM)组织和VEGFA-VEGFR2中的信号通路有关;最后,亚群D在酪氨酸代谢和MAPK1/MAPK3信号通路中富集。
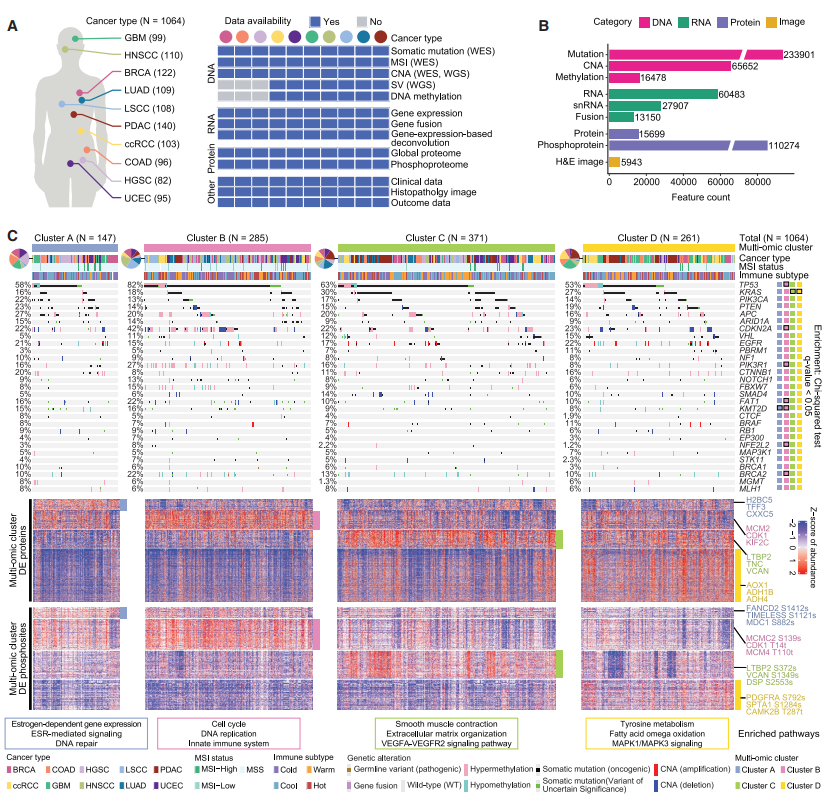
图1. 泛癌多组学分析得出四个亚群。
蛋白质基因组分析揭示癌症突变顺式效应的异质性
基因突变可以广泛地影响蛋白质组,最直接的影响是突变基因本身的转录、翻译和翻译后产物。为了探究这种顺式效应,研究人员用线性回归模型评估了推定的癌症驱动基因突变与RNA、蛋白或磷蛋白水平变化之间的关系,在59个癌症基因的泛癌水平上发现了265个显著的顺式事件。
虽然某些类型的突变会对蛋白质水平产生特定的顺式影响,但其他突变(如错义突变)的易感性可能差异很大。为了评估错义突变是否影响癌症基因中的蛋白质稳定性,研究团队首先通过回归RNA表达的影响将蛋白质丰度归一化。对推定的致癌错义突变进行顺式效应的重复分析后,研究发现了11例泛癌和15例队列特异性显著事件。与预期一致,37个TP53错义突变与较高的蛋白丰度相关,移码Indel和无义突变与较低的蛋白丰度相关。
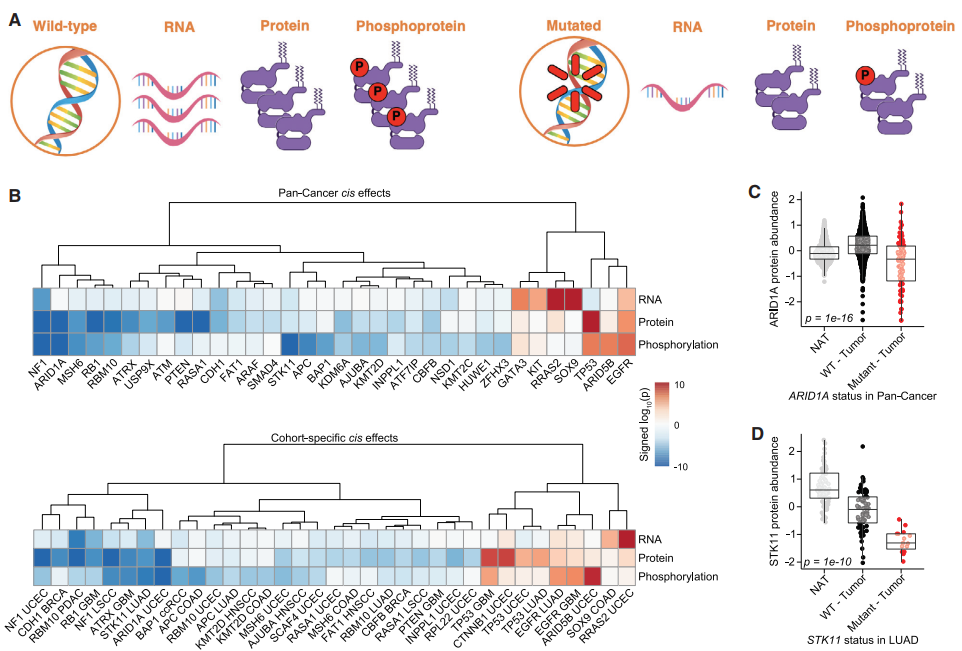
图2. CPTAC队列中癌症基因突变中的顺式效应。
CPTAC队列中癌症基因体细胞突变的反式效应
体细胞突变的影响可能超出其自身蛋白质产物的顺式效应或直接相互作用,还有些更遥远的反式效应阐明了可能带来的影响。癌症基因所有反式效应的集合可以被认为是它的“分子指纹”。研究人员假设这些分子指纹可以评估不同突变癌症基因对之间的相似性,并推断功能关系。
为了识别这些基因对,研究人员计算了每个驱动基因的蛋白质组和磷酸化蛋白质组反式效应特征之间的相关性。突变反式效应最相似的两个癌症基因是KEAP1和NFE2L2。对应蛋白的所有反式效应之间具有高度的全局相关性,表明这些基因突变的整体细胞效应是相同的。
接下来,研究团队在泛癌水平上分析了突变对细胞磷酸化状态的反式影响,比较了所有癌症类型突变和对照样本之间预测的激酶活性。例如,ACVR2A和TP53的突变都表现出细胞周期和剪接激酶的激活。
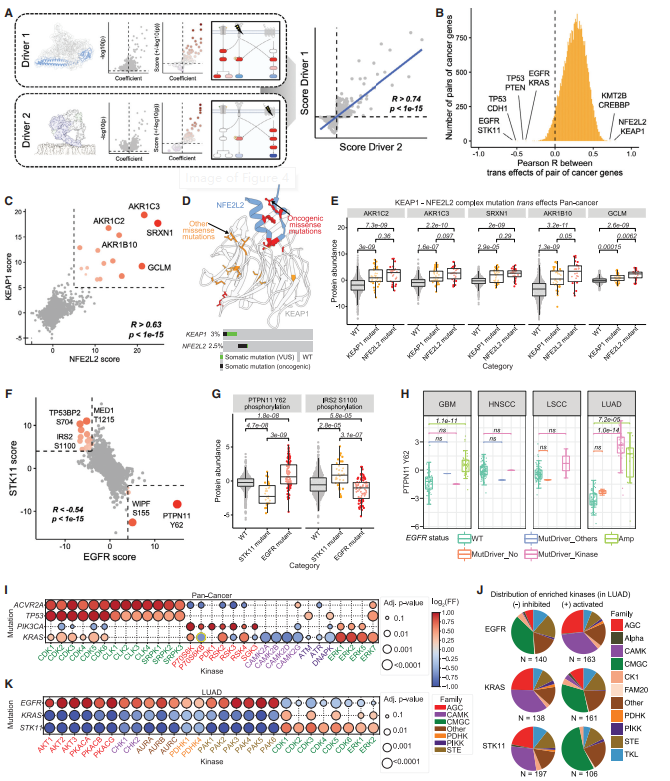
图3. CPTAC队列中癌症基因变异中的反式效应。
体细胞突变如何改变癌症特征的证据
研究团队希望探索所有体细胞突变对癌症类型的总体蛋白变异性的全局影响,并为此构建了一种整合的肿瘤多基因蛋白丰度预测算法,称为C3PO。该工具应用多基因组学来描述蛋白质的可变性,而不是疾病状态。C3PO结果表明,在这10种癌症类型中,仅体细胞突变和拷贝数事件平均占蛋白质丰度变化率的7.2%-27.5%。
除了C3PO产生的标记分数外,研究人员还使用了途径富集工具ssGSEA,直接从蛋白质丰度中鉴别富集,在每个样本的最显著标记中观察更高的通路可变性。C3PO和ssGSEA的DNA修复、细胞周期和凋亡、染色质修饰和癌症驱动因子特征聚集在一起,而ssGSEA的其余特征则更加多样化。针对从ssGSEA进行的蛋白质分析结果来看,肿瘤内的蛋白质变异可以反映DNA、RNA和蛋白质水平上不同改变的聚集。这些变化可以产生类似的下游效应,并独立于体细胞突变。以上发现补充了基因组学,并突出了蛋白质组学对肿瘤表型特征的贡献。
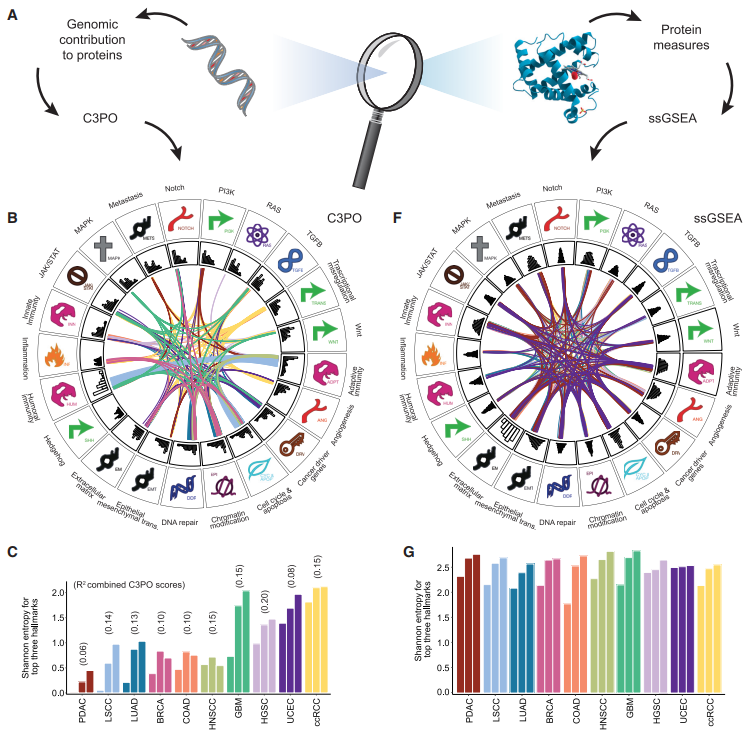
图4. 利用C3PO研究多组学对癌症内在表型的影响。
结 语
综上所述,研究团队使用10种癌症类型的蛋白质组和磷酸化蛋白质组数据,结合基因组和转录组数据,评估了CPTAC队列中5443个推定的驱动因子突变的泛癌后果。蛋白质基因组分析为致癌突变的分子机制提供了新的见解,从单个蛋白质到癌症特征,揭示了潜在的新的治疗途径。
该研究突出了癌症蛋白质组学研究的重要性,有助于系统评估致癌驱动因子对癌症功能状态的后果。未来,对蛋白翻译后修饰和代谢组更广泛的表征可以进一步揭示驱动改变如何扰乱蛋白质的活性。最后,将蛋白质组学与治疗前和治疗后样本相结合的临床试验可以揭示治疗反应和抵抗的决定因素,并在与药物作用更直接相关的水平上为联合治疗提供信息。
参考资料:
Yize Li, Eduard Porta-Pardo, Collin Tokheim, et al. Pan-cancer proteogenomics connects oncogenic drivers to functional states. Cell (2023).DOI:https://doi.org/10.1016/j.cell.2023.07.014


