【JHO】CAR‑HEMATOTOX评分可预测CAR-T治疗RRMM的毒性和缓解率
时间:2023-08-10 17:42:03 热度:37.1℃ 作者:网络
CAR‑HEMATOTOX评分
BCMA CAR-T是复发/难治性多发性骨髓瘤(RRMM)患者改变实践的免疫治疗平台,但也具有独特的毒性特征,包括细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。真实世界证据进一步强调了血液学毒性的重要性,即重度和/或长期血细胞减少症,其在清淋化疗和临床CRS消退后可持续很长时间。血液学毒性不仅是CAR-T最常见的≥3级毒性,也在很大程度上引起多模式免疫抑制,从而驱动感染性并发症。
随着CRS和ICANS毒性管理的进展,致死性感染目前是CAR-T治疗后非复发死亡(NRM)的最常见原因。
CAR-HEMATOTOX评分(HT评分,在线网址https://www.german-lymphoma-alliance.de/Scores.html,界面如下图)在预处理前计算分数,可模拟R/R大B细胞淋巴瘤(LBCL)患者队列中CAR-T相关的血液毒性,包含了CAR-T前造血储备(例如血红蛋白、中性粒细胞绝对计数[ANC]、血小板计数)和炎症状态(例如CRP、铁蛋白)相关的因素。
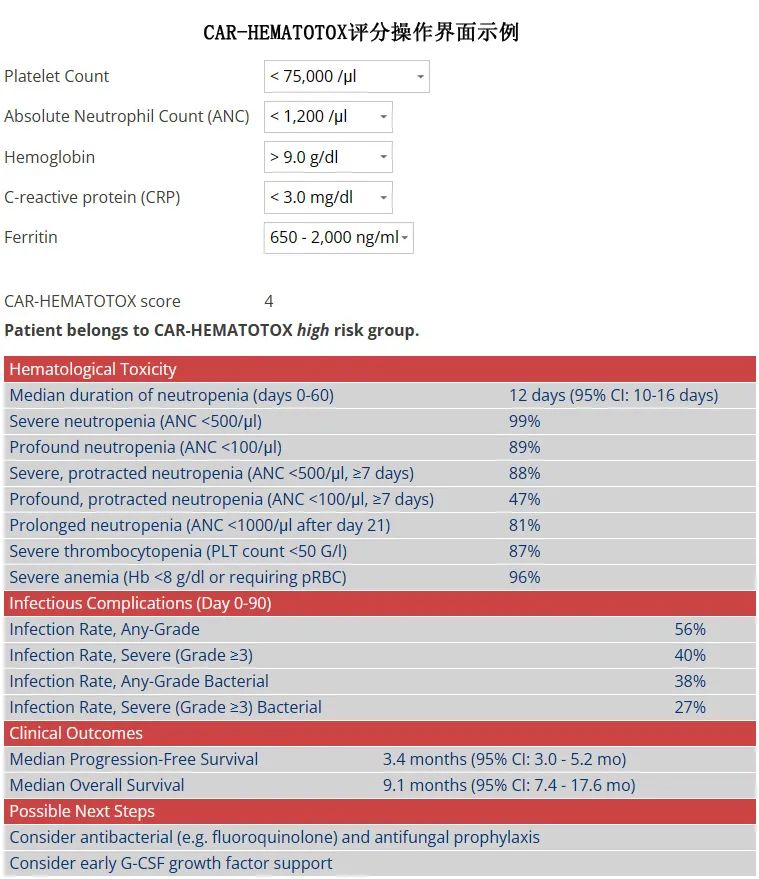
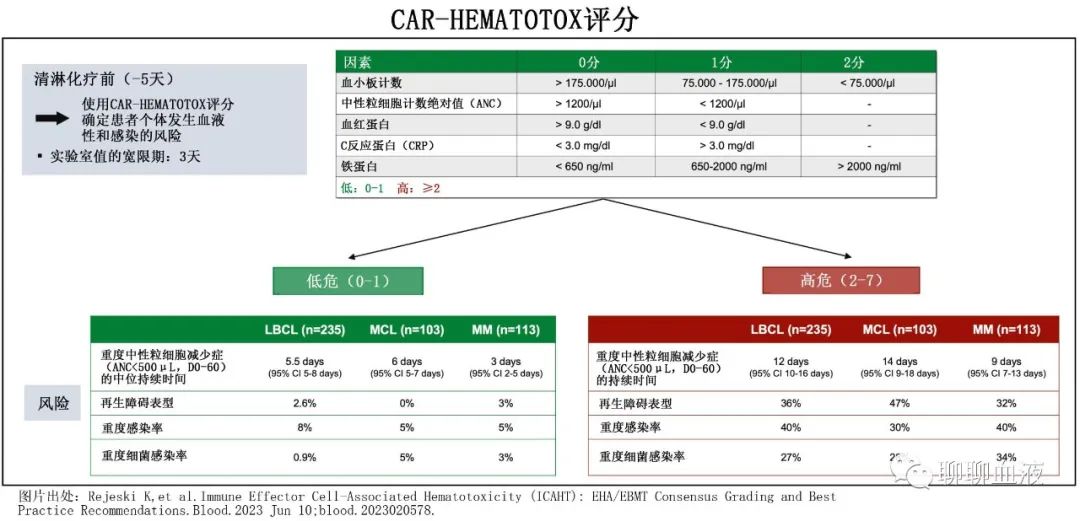
对于在三线治疗中接受市售CD19 CAR-T的LBCL患者,该评分与重度感染(尤其是细菌感染)发生率增加和治疗结局较差相关,但尚不清楚该评分是否也可对接受idecabtagene vicleucel (ide-cel)或ciltacabtagene autoleuce l(cilta-cel)的RRMM患者的毒性事件和临床结局进行风险分层。此外,BCMA CAR-T治疗后血细胞减少症和感染发生率的详细真实世界报告仍很少。
德国LMU大学医院Kai Rejeski教授牵头一项回顾性研究,纳入接受BCMA CAR-T治疗的RRMM患者共113例,旨在验证CAR-HEMATOTOX评分在接受BCMA CAR-T治疗的RRMM中的毒性和缓解情况。研究结果近日发表于《Journal of Hematology & Oncology》。

研究结果
该回顾性多中心观察性研究纳入6家国际CAR-T中心所有给予标准疗法BCMA CAR-T治疗RRMM的患者共113例,包括cel(n=106)和cilta-cel(n=7),旨在评估毒性和生存结局。
患者基线特征
113例患者的特征见表1。中位年龄为65岁,中位ECOG为1,30%的患者有高危细胞遗传学异常(del17p,t(4;14),t(14;16))。患者既往接受过中位6线治疗,包括88%既往接受过自体干细胞移植(ASCT),反映了该患者队列的多线治疗性质。值得注意的是,42.5%的患者患有五类难治性疾病,在CAR-T前3个月内37%的患者暴露于烷化剂化疗。在CAR-T输注前的末次骨髓(BM)评估中,分别在46%和25%的患者中检测到≥5%和≥50%的克隆浆细胞。大多数接受CAR-T治疗的患者为疾病稳定或进展。
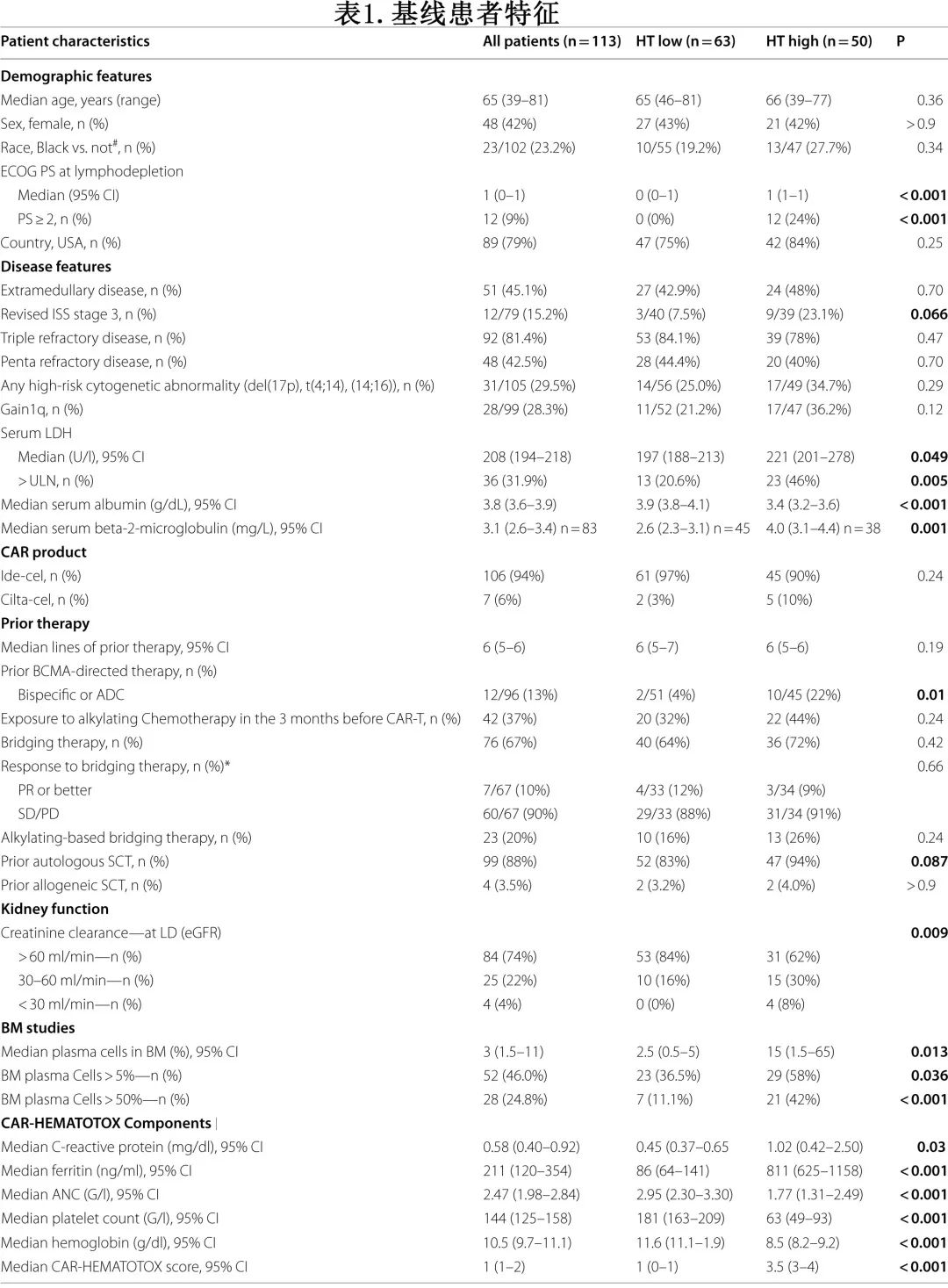
在清淋预处理前计算CAR-HEMATOTOX评分评分,符合以下标准得1分:ANC≤1200/μl、血红蛋白≤9.0 g/dL、血小板计数76-175 g/L、CRP≥3.0 mg/dL和铁蛋白650-2000 ng/ml;血小板计数≤75g/L和铁蛋白≥2000 ng/mL得2分。总分≥2分为高危(HThigh),评分0-1分为低危(HTlow)。
共包括63例HTlow和50例HThigh患者;两组之间未观察到年龄、性别、人种、国家、疾病难治性、桥接治疗的使用或基于烷化剂的桥接治疗暴露存在差异(表1),但HThigh患者更多存在ECOG PS≥2 (24% vs 0%,P<0.001)和R-ISS分期更高(23.1% vs 7.5%,P=0.066)。与HTlow组相比,HThigh组患者更多既往接受过BCMA治疗(22% vs 4%,p=0.01)并发生肾功能受损,表现为清淋时肌酐清除率(CrCl)降低(<60mL/min:38% vs. 16%)。且与HTlow患者相比,HThigh患者更常显示BM浸润(浆细胞≥50%:42% vs. 11%,p<0.001;表1),既往更常接受ASCT(94% vs. 83%,p=0.087),提供了广泛性基线血细胞减少的相关性;例如HThigh组的中位血红蛋白为8.5 g/dL,中位血小板计数为63g/L,中位ANC为1.77g/L,而HTlow组对应的数字为11.6 g/dL、181g/L、2.95 g/L。此外正如预期,HThigh患者的全身炎症标志物升高,包括清淋时的中位血清CRP为1.02mg/dL,中位血清铁蛋白为811ng/mL;而HTlow组对应的数字为0.45mg/dL和86ng/mL。
CAR-HEMATOTOX评分对血液学毒性的影响
HThigh组存在再生障碍性中性粒细胞恢复的患者比例明显增加(32% vs. 3%,p<0.0001;图1A),且校正其他基线风险因素后HT评分仍是再生障碍性表型的独立风险因素(校正OR[aOR]=10.8,p=0.003)。此外骨髓浆细胞浸润≥50%也独立增加再生障碍性中性粒细胞恢复的概率(aOR=6.6,p=0.007)。与HTlow相比,HThigh患者重度中性粒细胞减少(ANC<500/μL)的中位持续时间显著延长(9 vs. 3天,p<0.0001;图1B)。
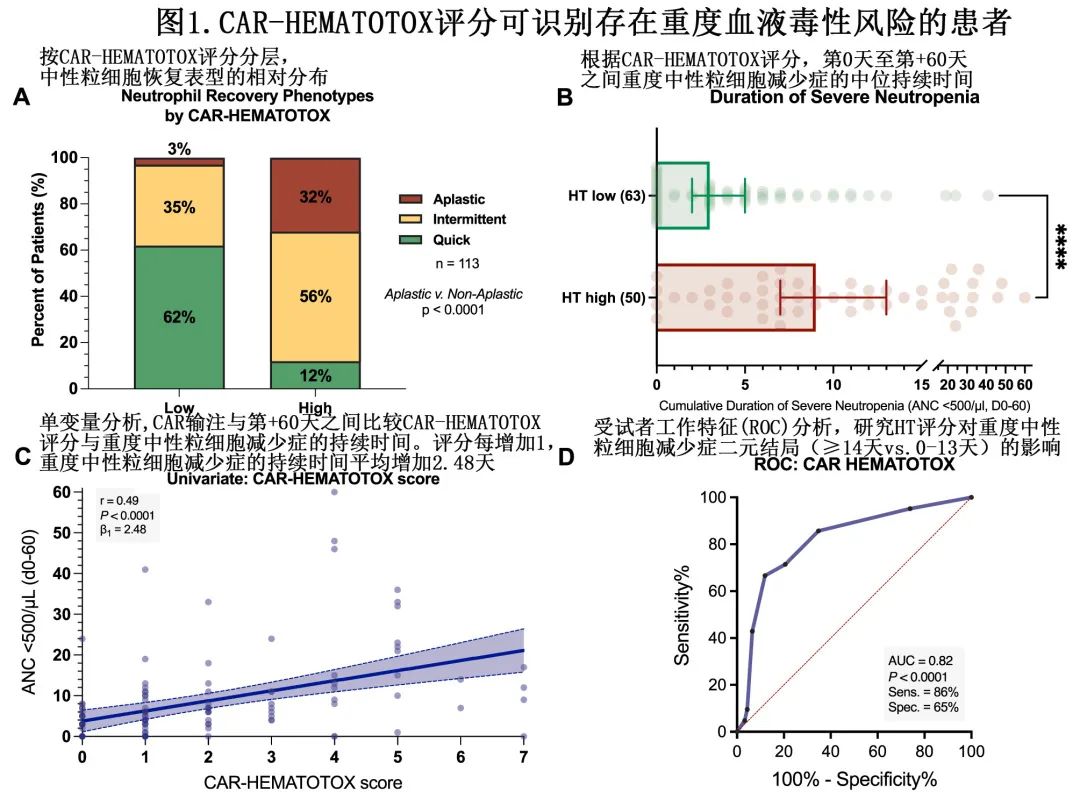
在单变量分析中发现,HT评分与重度中性粒细胞减少持续时间呈显著正相关(r=+0.49,p<0.0001,β1=2.48;图1C)。ROC分析进一步证实了HT评分对重度中性粒细胞减少≥14天这一终点的区分能力(AUC=0.82,p<0.0001,敏感性=86%,特异性=65%;图1D)。
BCMA CAR T细胞治疗后30天和100天内,HThigh患者的重度血小板减少(78% vs.27%,p<0.0001和56% vs. 6.3%,p<0.0001)、贫血(84% vs. 22.2%,p<0.0001和48% vs. 9.5%,p<0.0001)和中性粒细胞减少(84% vs. 63.5%,p=0.02和36% vs. 6.3%,p<0.0001)均高于HTlow患者(表2)。重度长期(ANC<500/μL持续≥7天:46% vs. 7.9%,p < 0.0001)、严重(ANC<100/μL:42% vs. 19%,p=0.01)、严重长期(ANC<100/μL持续≥7天:14% vs. 0%,p=0.003)和长期中性粒细胞减少症(第+21天后ANC<1000/μL:72% vs. 33.3%,p<0.0001)同样是HThigh患者显著高于HTlow患者。BCMA CAR-T后30天和100天内,HThigh患者更常需要输注血小板(58% vs. 6.3%,p<0.0001和22% vs. 3.2%,p=0.002)和浓缩红细胞(pRBC:78% vs. 20.6%,p<0.0001和38% vs. 6.3%,p<0.0001)。HThigh与HTlow患者相比,粒细胞集落刺激因子(G-CSF)使用有增加的趋势(62% vs. 44.4%,p=0.087)。此外,血小板生成素(TPO)激动剂在HThigh队列中更常用(14% vs. 4.8%,p=0.01), CD34+干细胞增强(stem cell boost)的使用增加具有相似的趋势(6% s. 2.7%,p=0.084)。
CAR‑HEMATOTOX评分可识别存在ICANS、早期感染和非复发死亡风险的患者
虽然HThigh患者的重度CRS发生率(≥3级)在数值上高于HTlow患者(10% vs 2%,p=0.14),但无统计学显著差异。HThigh患者的轻-度ICANS 18% vs. 9%)和重度ICANS(16% vs. 0%,p<0.001)的发生率均较高,可能导致糖皮质激素的使用率增加(52% vs. 29%,p=0.01)。另一方面,抗IL-6受体拮抗剂托珠单抗和抗IL-1受体拮抗剂anakinra在两个风险组中的使用率相似。与HTlow患者相比,HThigh患者入住重症监护室(ICU)的频率有更高的趋势(10% vs 1.6%,p=0.086)。总体而言,HThigh队列毒性负荷的加转化为更长的中位住院时间(13天vs. 8天,p<0.0001)。
在BCMA CAR T细胞治疗后的前90天内, 44例患者(39%)发生总计51起感染事件;血流感染最常见 (28%),其次是上/下呼吸道(分别为17%)和胃肠道感染(14%)(图2A)。任何级别的感染在HThigh队列中更常见(58% vs. 23%,p=0.0002;图2B),且在重度感染中尤其明显(40% vs. 5%,p<0.0001),包括HThigh患者中1例致死性真菌感染(第+65天死亡)和2例致死性细菌感染(第+6天和第+26天)。HThigh队列重度细菌感染也明显更频繁(34% vs. 3%,p<0.0001;2C)。与之相反,HTlow组未观察到危及 生命(IV级)或致死性(V级)感染。同时,HThigh患者任何级别和重度感染的累积90天发生率也更高(图2D、E)。HThigh队列的细菌感染累积发生率也高于HTlow队列(40% vs. 13%,p=0.0015),但累积病毒(12% vs. 7.9%,p=0.46)和真菌(4.0% vs. 0%,p=0.11)感染率未见显著差异(图2F–H)。多变量分析确定HT评分是发生严重感染的独立预测因素(aOR=4.9;p=0.03)。
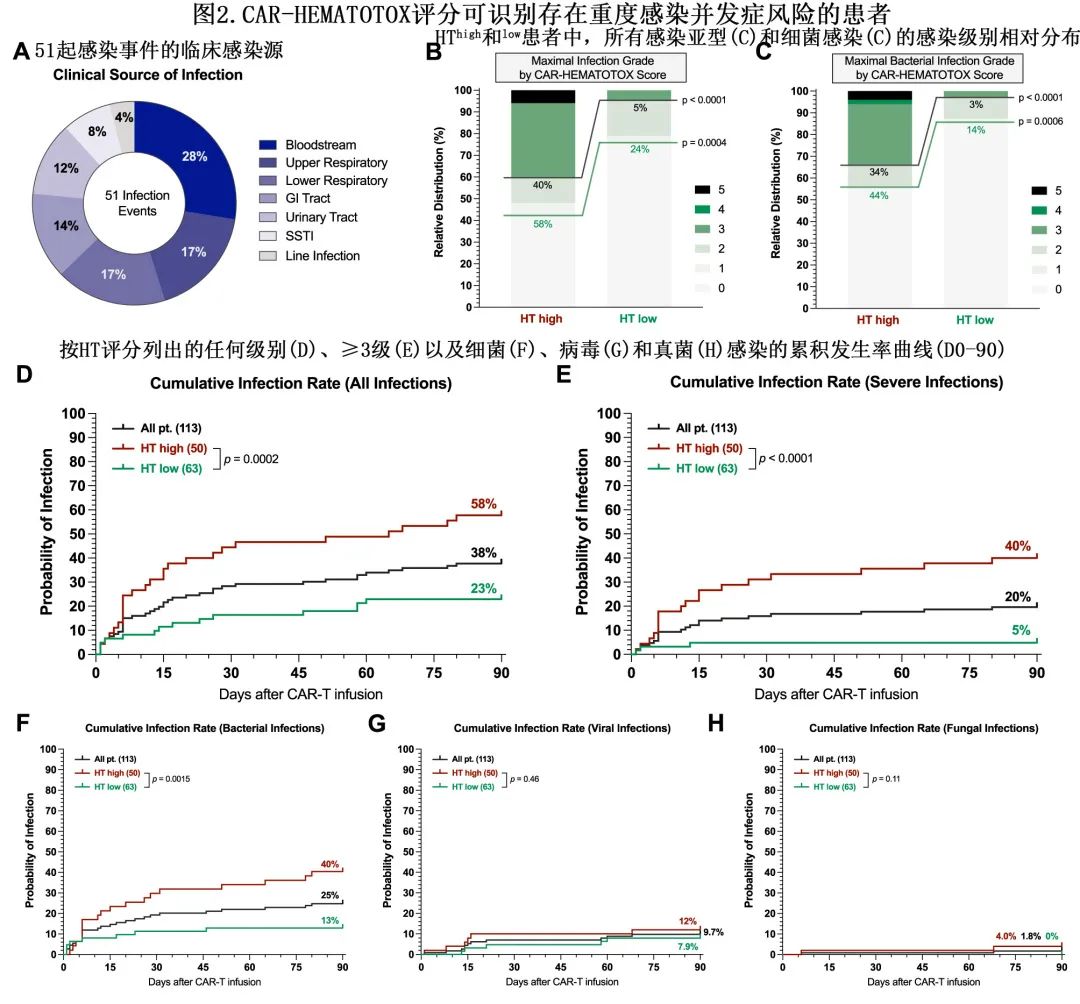
接受BCMA CAR T细胞治疗的患者中7例(6.2%)末次随访时死于非复发死亡(NRM):5例死亡(71.4%)归因于感染,1例(14.3%)归因于5级CRS,1例(14.3%)归因于心脏毒性(心肌病)。另一方面,20例患者在CAR-T输注后的第一年期间死于多发性骨髓瘤进展。整个队列的一年NRM为6.9%,且HThigh较HTlow患者显著增加(12.7% vs. 2.1%,p=0.019)。
CAR-HEMATOTOX评分对治疗反应和生存期的预后影响
在108例患者中评估了截至第90天的最佳总缓解率(ORR),因为5例接受主动随访的患者未达到该时间点和/或无法评估。HThigh与较差的ORR (72.9% vs. 88.3%,p=0.048)和较差的VGPR率(43.8% vs. 70.0%,p=0.01)相关,但与CR或sCR率(33.3% vs. 45.0%,p=0.24)无关(图3A)。中位随访7.9个月,整个队列的中位PFS为11.2个月,中位OS未达到;可评估患者中1年PFS为47%,1年OS为71%。
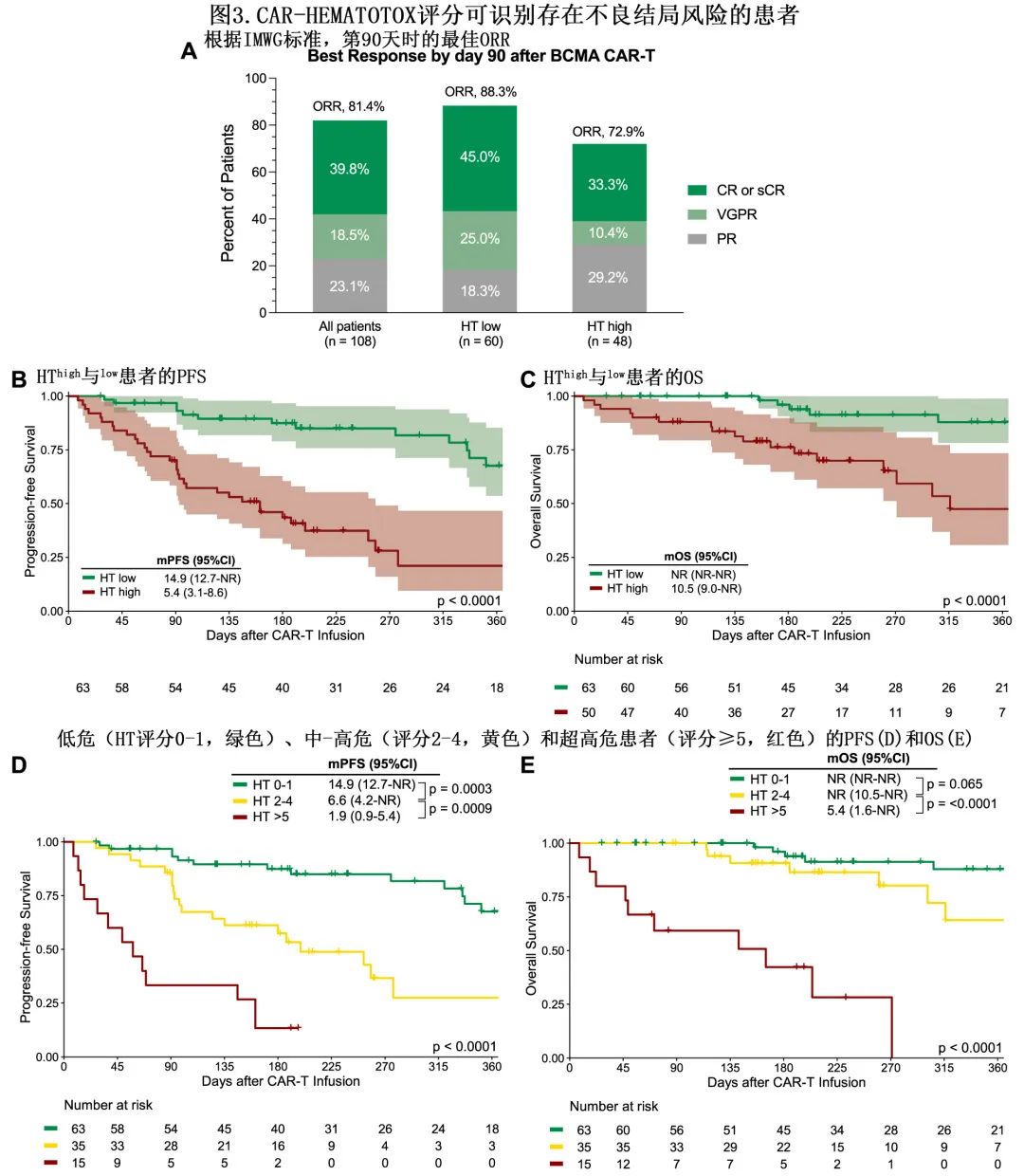
与HTlow相比,HThigh患者的PFS(中位PFS分别为5.4个月vs.14.9个月;p<0.0001;图3B)和OS(中位OS分别为10.5个月vs.未达到;p<0.0001;图3C)均较差。此外在HThigh队列中,相对于HT评分为2-4的患者,HT评分≥5分患者的PFS(中位数分别为1.9 vs. 6.6个月;p=0.0009;3D)和OS(分别为5.4 vs未达到;p<0.0001;图3E)特别差。
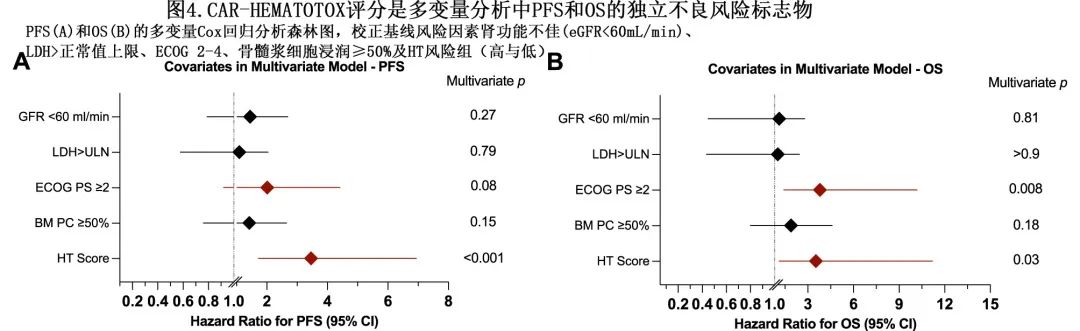
多变量Cox比例风险模型校正其他不良风险因素,显示高HT评分是PFS(aHR=3.5,p<0.001;4A)和OS(aHR=3.5,p=0.03;图4B)的独立不良风险标志物。此外,ECOG PS较差是OS较差的独立风险因素(P=0.008),对于PFS则具有较差的趋势(P=0.08)。
总结
该研究共纳入113例患者,清淋预处理时63例患者为HTlow(评分0-1)、50例患者为HThigh(评分≥2)。与HTlow患者相比,HThigh患者呈现出重度中性粒细胞减少症延长(中位9天vs. 3天,p<0.001)、重度感染率增加(40% vs. 5%,p<0.001)和ICANS更严重(≥3级:16% vs. 0%,p<0.001)。HThigh组的1年非复发死亡率较高(13% vs. 2%,p=0.019),主要归因于致死性感染。根据IMWG标准,HTlow患者的缓解率较高(≥VGPR:70% vs. 44%,p=0.01);HThigh患者的无进展生存期(中位数5 vs. 15个月,p<0.001)和总生存期(中位数10.5个月vs.未达到,p<0.001)较差。
该研究数据强调了CAR-HEMATOTOX评分对接受BCMA CAR-T的多发性骨髓瘤患者的毒性和治疗反应的预后效用,是清淋预处理前重度毒性和临床结局的强效风险分层因素,可指导毒性管理(例如抗感染预防、早期g-CSF、干细胞增强),并有助于确定合适的CAR-T候选者,总的来说值得进一步前瞻性验证。
参考文献
Rejeski K,et al. The CAR‑HEMATOTOX score as a prognostic model of toxicity and response in patients receiving BCMA‑directed CAR‑T for relapsed/ refractory multiple myeloma.J Hematol Oncol . 2023 Jul 31;16(1):88. doi: 10.1186/s13045-023-01465-x.

