Cell Research:中国科学院彭珂等团队合作发现新冠病毒感染诱导过度炎症反应的潜在分子机制
时间:2023-01-22 15:01:22 热度:37.1℃ 作者:网络
SARS-CoV-2感染可引发强烈炎症反应,对COVID-19危重患者造成严重肺损伤。然而,感染诱导过度炎症反应的分子机制还不完全清楚。
2023年1月17日,中国科学院武汉病毒研究所彭珂、中南大学吕奔、广州实验室周鹏共同通讯在Cell Research在线发表题为“SARS-CoV-2 Z-RNA activates the ZBP1-RIPK3 pathway to promote virus-induced inflammatory responses”的研究论文,该研究表明SARS-CoV-2 Z-RNA激活ZBP1-RIPK3通路,促进病毒诱导的炎症反应。该研究报道了SARS-CoV-2感染导致病毒Z-RNA在被感染细胞的细胞质中形成,从而激活ZBP1-RIPK3通路。GSK872对RIPK3的药理抑制或MLKL的基因缺失减少了SARS-CoV-2诱导的IL-1β的释放。
在体外和体内SARS-CoV-2感染期间,ZBP1或RIPK3缺陷导致炎症细胞因子和趋化因子的产生减少。此外,缺失ZBP1或RIPK3可减轻感染小鼠模型中SARS-CoV-2感染诱导的免疫细胞浸润和肺损伤。这些结果表明,ZBP1-RIPK3通路在SARS-CoV-2诱导的炎症反应和肺损伤中起着关键作用。总之,该研究为SARS-CoV-2感染如何引发炎症反应和肺部病理提供了新的见解,并揭示了靶向ZBP1-RIPK3轴在治疗COVID-19中的治疗潜力。

截至2022年12月13日,严重急性呼吸综合征冠状病毒2 (SARS-CoV-2),已感染超过6.45亿人,导致全球超过663万人死亡。其中,约5%的COVID-19患者病情危重,肺损伤严重。免疫抑制治疗COVID-19患者的高度炎症状态已被提出,并进行了大量临床试验来评估该策略在COVID-19治疗中的疗效。然而,正在进行的常规免疫抑制药物的进展,如地塞米松、氢化可的松、皮质类固醇,已报告没有或有限改善患者的结局。了解SARS-CoV-2引发有害炎症反应的机制对于制定针对COVID-19的具体有效治疗对策至关重要。
坏死是一种溶解性和促炎性的细胞死亡形式,可由各种类型的病毒触发。过度坏死可导致严重的免疫病理。坏死的一个关键介质是受体相互作用蛋白激酶(RIPK) 3,它含有一个C端RIP同型相互作用基序(RHIM)。为了启动坏死,RIPK3首先通过RIPK1、含有TIR结构域的转接器诱导干扰素(IFN) b (TRIF)或Z-核酸(NA)结合蛋白1 (ZBP1)的RHIM依赖性相互作用被募集,导致混合谱系激酶结构域样蛋白(MLKL)依赖RIPK3磷酸化。
磷酸化的MLKL通过寡聚转移到质膜并形成通道,导致细胞溶解死亡。除了引发坏死外,RIPK3还被报道促进炎症信号传导。最近的一项研究报告称,RIPK3通过其支架而不是激酶活性介导炎症信号。在病毒感染的背景下,RIPK3的激酶活性和脚手架功能如何调节炎症反应仍有待研究。
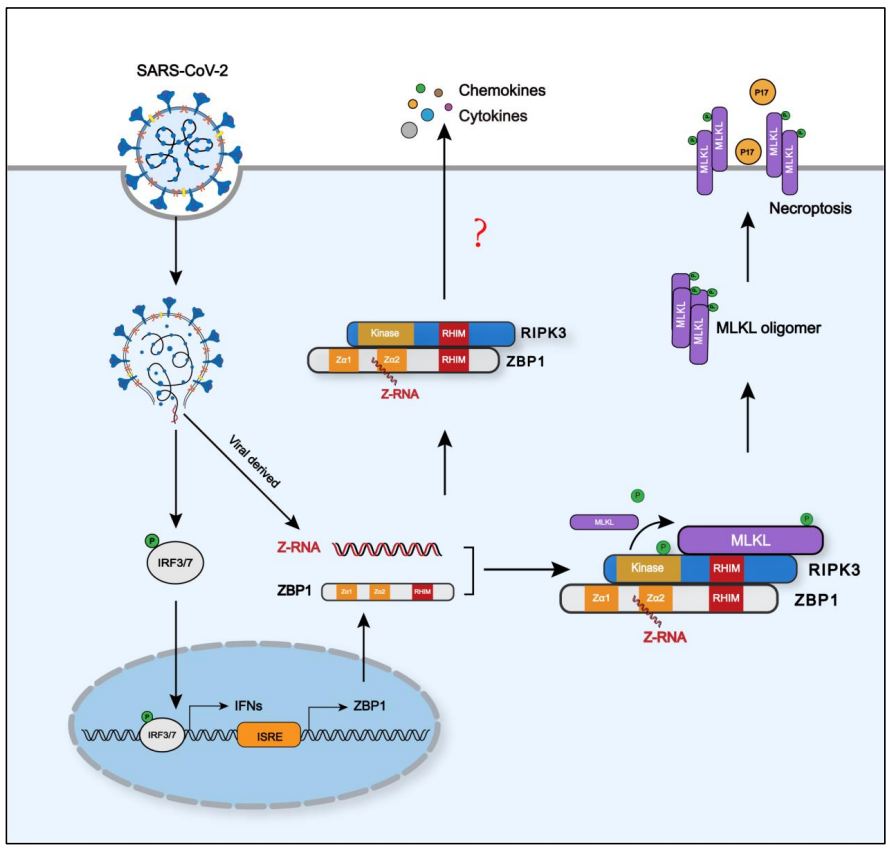
SARS-CoV-2感染引发炎症反应的假设模型(图源自Cell Research )
ZBP1,也被称为DNA依赖性干扰素调节因子激活因子(DAI),是一种新兴的先天性传感器,可以感知DNA和RNA病毒的感染,并触发多种程序性细胞死亡途径,包括焦亡、凋亡和坏死。对RNA和DNA病毒的研究表明,ZBP1的天然配体是左旋双螺旋“z型”RNA (Z-RNA)结构。病毒Z-RNA通过不同的机制形成。痘苗病毒(VACV) E3蛋白dsRBD结构域与病毒dsRNA基因组结合,促进Z-RNA的形成或稳定。或者,当病毒dsRNA采用Z构象时,病毒Z-RNA可以形成,就像在甲型流感病毒(IAV)缺陷病毒基因组的情况下一样。据报道,SARS-CoV-2复制导致dsRNA形成,但病毒dsRNA是否能采用Z-RNA构象和/或在触发病毒发病机制中发挥作用目前尚不清楚。
在本研究中,作者发现SARS-CoV-2感染导致Z-RNA形成,触发ZBP1-RIPK3-MLKL坏死通路,并导致炎症细胞因子分泌。这表明,ZBP1-RIPK3轴在SARS-CoV-2诱导的炎症反应中起着关键作用,ZBP1-RIPK3通路可能是COVID-19抗炎治疗的新靶点。
原文链接:
https://www.nature.com/articles/s41422-022-00775-y

