JMC:发现第一个乳酸脱氢酶 PROTAC 降解剂有望用于胰腺癌治疗
时间:2022-12-28 15:00:05 热度:37.1℃ 作者:网络
肿瘤细胞具有快速分裂增殖、高度侵袭转移的能力,这就要求其具有较高的物质及能量供应能力。细胞的能量代谢主要以糖代谢为核心,是一个从能量物质的摄取到 ATP 产生的过程,并产生其他代谢中间产物,包括糖酵解和三羧酸循环两个重要的过程。肿瘤的能量代谢不仅为肿瘤的快速生长提供了能量需求,也为肿瘤的生长提供了大量的物质原料,如磷酸核糖,非必需氨基酸,脂质合成前体等。因此阻断肿瘤的能量代谢可以导致肿瘤细胞的死亡。
在糖酵解的过程中,乳酸脱氢酶(LDH)发挥着重要的作用,是关键的合成限速酶之一。乳酸脱氢酶广泛存在于人体细胞和组织中,包括两个亚基,LDH-A 和 LDH-B,它可以催化丙酮酸转变成乳,同时伴有 NADH 到 NAD+ 的转换。
一般来说,在细胞通过葡萄糖转运蛋白吸收葡萄糖并通过糖酵解产生丙酮酸后,根据氧供应有两种可能的代谢途径。当氧气供应充足时,丙酮酸进入线粒体,进行有氧氧化,转化为 CO2 和 H2O,并产生大量的三磷酸腺苷(ATP)。另一方面,当氧气供应不足或不能被充分利用时,丙酮酸不会进入线粒体,而是被细胞质中的 LDHA 利用,还原为乳酸,同时产生少量ATP。 即使在氧气充足的情况下,肿瘤细胞通常也依赖于后一种途径,并且葡萄糖摄取水平增加,这被称为经典的 “Warburg 效应”。LDHA 和 LDHB 的表达水平在多种癌症类型中升高,例如胃癌、肺癌、乳腺癌、结直肠癌、子宫内膜癌和胰腺癌。也有报道称,升高的 LDHA 和 LDHB 水平与癌症患者的不良预后有关。因此,LDH(以下简称 LDHA 和 LDHB)已被公认为一种有前途的抗癌药物靶点。
医药公司和研究院所已经开发了许多有效的 LDHA/B 抑制剂,一些 LDH 抑制剂已经取得了良好的细胞抗肿瘤作用和体内 LDH 抑制作用。然而,迄今为止还没有有效的 LDH 抑制剂进入临床。因此,仍然需要开发一种针对 LDH 的治疗策略来治疗癌症。
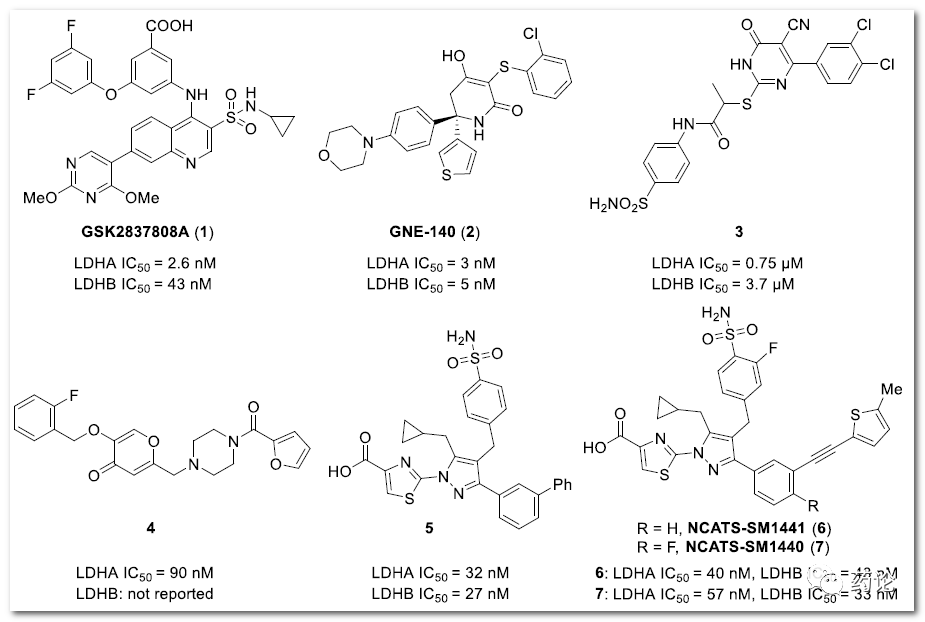
图表1:代表性LDH抑制剂的结构(来源:文献1)
这里不得不提到当下火爆的 PROTAC。
PROTAC是一种杂合双功能小分子化合物,结构中含有两种不同配体,一个是E3 泛素连接酶的配体,另一个是与细胞中目标靶蛋白结合的配体,两个配体之间通过 Linker 相连,从而形成“三体”聚合物--靶蛋白配体-Linker-E3 配体。

图表2:PROTAC 作用模式(来源:文献3)
PROTAC 可以在细胞中与 E3 泛素连接酶和靶蛋白结合,并形成三元复合物:靶蛋白-PROTAC-E3泛素连接酶,从而导致靶蛋白的多聚泛素化并随后被 26S 蛋白酶体识别并降解。在引发靶蛋白泛素化之后,PROTAC 可从复合物中解离,并参与下一轮的催化循环。与传统的占位驱动小分子抑制剂不同,事件驱动的蛋白水解靶向嵌合体 (PROTAC) 可去除靶蛋白及其所有功能,而不仅仅是其抑制作用。因此PROTAC 可能会提高蛋白质降解的选择性并逃避耐药机制,如获得性耐药突变和靶蛋白过度表达。
基于上述原因,美国西奈山伊坎医学院 H. Ümit Kaniskan、Jian Jin等致力于发现新型乳酸脱氢酶 PROTAC 降解剂,以期用于癌症治疗。
以吡唑为基础的 LDH 抑制剂化合物 5 ~ 7(见图表1) 在抑制 LDHA 和 LDHB 方面表现出高效能,并可有效减少癌细胞中的乳酸生成。化合物 6 和 7 在体内也能有效抑制LDH。研究人员以化合物 5 ~ 7 作为 LDH 结合片断设计 PROTAC 降解剂。LDHA 与化合物 6 的晶体结构表明,6 的噻吩基是暴露在溶剂中的(黑色虚圈表示),是连接子对接的合适部分。通过用带有末端胺基的四碳链取代噻吩部分来设计 precursor 8,作为连接子安装的 handle,因为噻唑羧酸部分和 6(和 5)的 4-苄基磺酰胺基团与 LDHA 形成关键的氢键相互作用(品红色虚线),在 precursor 8 中保留了这些部分。为了简化化学合成,同时基于抑制剂 5 的结构分析,去除磺酰胺基团邻位的氟原子。
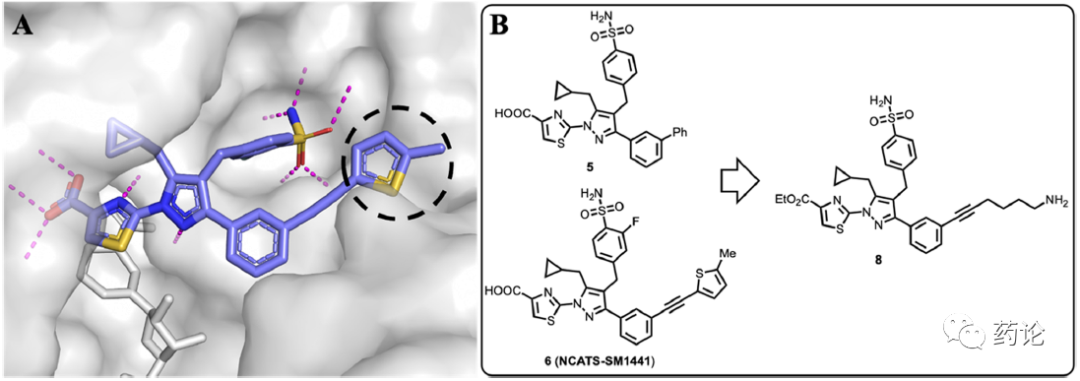
LDH PROTAC 降解剂的设计.(A)LDHA(灰色)与NADH(灰色棒)和化合物6(蓝色棒)(PDB: 6Q13)的复合物的晶体结构显示噻吩基团暴露于溶剂中(由黑色虚线圆圈表示)。LDHA(灰色)与NADH(灰色棒)和化合物6(蓝色棒)(PDB: 6Q13)的复合物的晶体结构显示噻吩基团是暴露于溶剂的(由黑色虚线圆圈表示)。关键的氢键相互作用用品红色虚线表示.源自LDH抑制剂5和6的 precursor 8的设计。(来源:文献1)
选择 VHL hijack(劫持)E3连接酶,而不是 cereblon (CRBN),主要是为了避免 CRBN 新底物降解引起的潜在并发症。
鉴于接头在 PROTAC 的发展中起着至关重要的作用,研究人员设计了一些推定的 VHL 招募的 LDH PROTAC 降解剂,具有各种亚烷基和聚乙二醇 (PEG) 接头,它们被连接 一种经典的 VHL 配体 VHL-1。
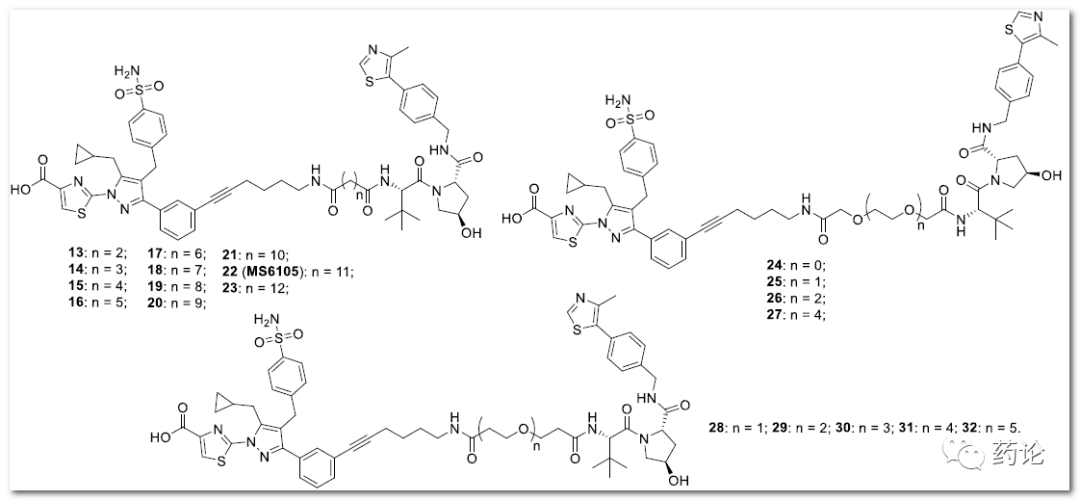 设计的 putative VHL 招募 LDH PROTAC 降解剂的化学结构(来源:文献1)
设计的 putative VHL 招募 LDH PROTAC 降解剂的化学结构(来源:文献1)
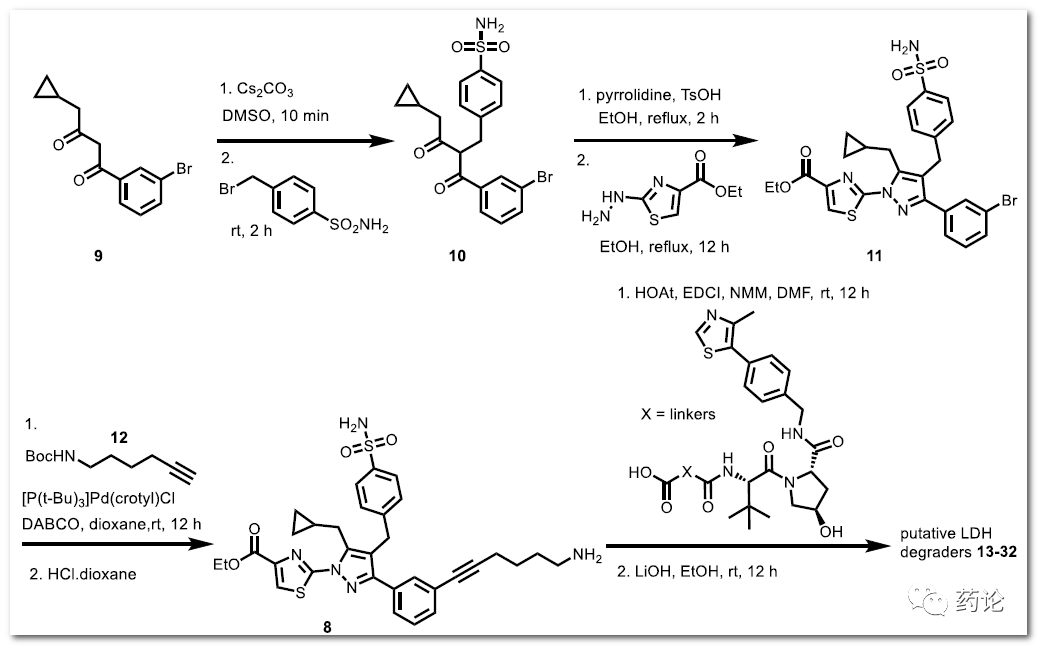 设计的 LDH 降解剂的合成 13−32(来源:文献1)
设计的 LDH 降解剂的合成 13−32(来源:文献1)
构效关系研究,优选出化合物22, 22 以时间和泛素蛋白酶体系统依赖方式有效降解 LDHA。
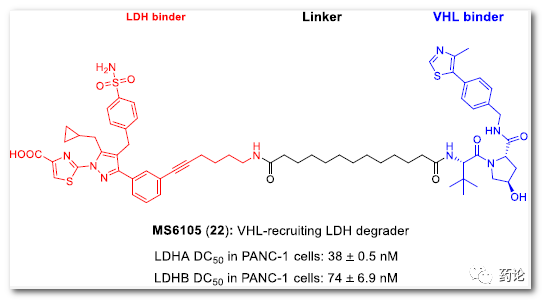
22结构式和靶蛋白抑制活性(来源:文献1)
使用 unbiased global 的全球蛋白质组学研究,确认了 22 显着降低 LDHA 和 LDHB,22 在抑制准间质状态和上皮状态胰腺癌细胞系的生长方面明显比亲本 LDH 抑制剂更有效。此外,22在小鼠体内通过腹腔注射具有良好的生物利用度。

LDH 降解剂 22 在多种胰腺癌细胞系中的抗增殖活性
总体而言,化合物 22 可能是研究界评估靶向 LDHA 和 LDHB 在胰腺癌和其他 LDH 依赖性癌症中的治疗潜力的有用化学工具,并为发现和开发改进的 LDH 靶向药物铺平道路。
参考:
1.https://doi.org/10.1021/acs.jmedchem.2c01505
2.翟小明. 草氨酸钠抑制乳酸脱氢酶对鼻咽癌生长及放射敏感性的影响. 苏州大学, 2014.
3.曾申昕,黄文海,沈正荣. 蛋白降解靶向嵌合体在小分子药物研发中的机遇与挑战[J]. 药学进展,2020,44(11):801-816.


