STTT | 中国科学院季红斌/陈洛南合作揭示氧化应激触发的Wnt信号对肺腺向鳞状细胞转分化的调控机制
时间:2023-01-12 12:01:47 热度:37.1℃ 作者:网络
肺癌是一种死亡率高的毁灭性疾病,其异质性极高,可塑性强。非小细胞肺癌(non-small-cell lung carcinoma, NSCLC,约占肺癌的86%)的两种主要组织学类型,腺癌(adenocarcinoma, ADC)和鳞状细胞癌(squamous cell carcinoma, SCC),以其各自的谱系转录因子(transcription factors, TFs)为特征:ADC为NKX2-1, SCC为TP63。这些谱系特异性TFs的扰动可能导致相应细胞特性的不稳定和丧失。一些重要的临床现象,如肺腺鳞混合性癌的发生和复发相关的腺到鳞状细胞转分化(adeno-to-squamous transdifferentiation,AST),一直被检测到,但仍然知之甚少。Lkb1缺失使Kras突变型肺癌具有较强的可塑性和AST的潜力。然而,目前尚不清楚Lkb1缺失如何动态调节AST。
2023年1月10日,中国科学院分子细胞科学卓越创新中心季红斌团队与陈洛南团队合作在Signal Transduction and Targeted Therapy 杂志在线发表题为“Oxidative stress-triggered Wnt signaling perturbation characterizes the tipping point of lung adeno-to-squamous transdifferentiation”的研究论文,这项研究利用KL小鼠模型进行AST研究,我们系统地描述了肺肿瘤的时间转录组动力学,描绘了非线性的动力学过程,并进一步确定了氧化应激引发的Wnt失活是AST过程中的转折点调节因子。
总之,这项研究确定了AST的临界点,并强调了ROS-Wnt轴在动态协调AST临界点上腺特异性和鳞状特异性TF网络之间的稳态中的重要作用。

临床中存在肺腺鳞混合性癌(adenosquamous, AdSCC)组织学,这两个组织学部分之间大量共享的遗传改变表明潜在的表型转变,这被称为腺鳞转分化(AST)。在最初成功的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗后,最近在复发的EGFR突变肺ADC患者中观察到鳞状转化。此外,最近的一项研究表明,在第三代TKI药物奥西替尼(Osimertinib)治疗后复发的EGFR突变肺ADC患者中,鳞状转化变得普遍。2/9例肺ADC患者在获得KRASG12C抑制剂耐药后也观察到类似的现象。这些研究强调了AST在肺癌临床获得分子靶向治疗耐药方面的重要贡献。
LKB1(也称为丝氨酸苏氨酸激酶11,STK11)在~17%的人肺ADC20中发生突变,而其突变率在肺AdSCC中富集,平均为39.66%(多项研究从22 - 66%不等)。最近的一项研究分析了LKB1突变在可能发生腺到鳞状细胞转分化的复发患者中的发生,其发生率相对较低,为14.3% (1 / 7),研究人员认为LKB1突变率如此之低可能归因于LKB1和EGFR突变之间的互排性,因为大多数患者都有EGFR基因改变,例如4/7有EGFR突变,1/7有EGFR扩增排除这些EGFR改变的患者,LKB1突变率为33%至50%,与之前的报道相似。这些临床观察共同表明LKB1突变在驱动AST方面的潜在作用。之前在基于KrasG12D的基因工程小鼠模型(GEMM)中一致发现LKB1失活能够驱动肺癌AST。这些病理转移的小鼠肿瘤也表现出对最初在肺ADC中有效的多种抑制剂的治疗耐药性与临床观察相似。
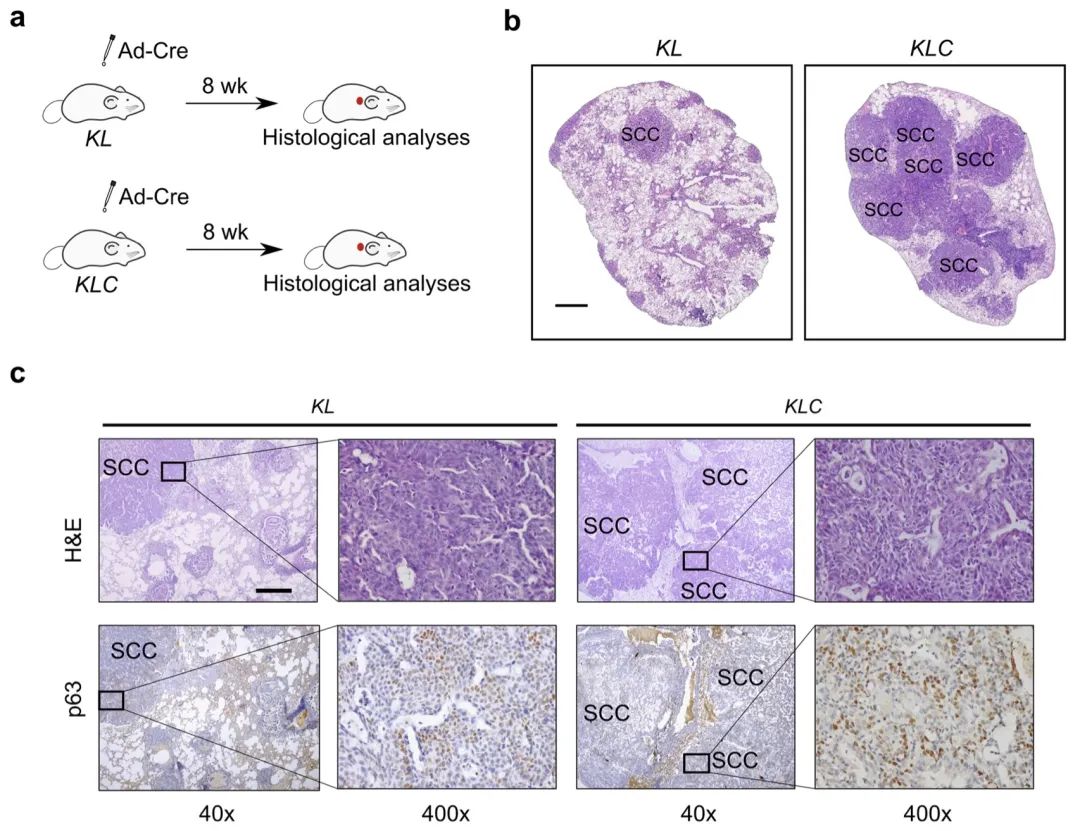
在KL小鼠模型中,30例ADC通常在鼻吸入Adeno-Cre (Ad-Cre) 6周后出现,随后在8周时转分化为SCC。LKB1缺乏可引发强烈的代谢失衡和活性氧(ROS)的过度积累这种不受控制的氧化应激随后促进了从腺瘤病理向鳞状病理的转分化。然而,潜在的机制在很大程度上仍然未知。此外,LKB1缺失驱动的AST过程的转录组学和分子动力学对于揭示这种机制至关重要,但尚未被描述。
从系统动力学的角度看,AST是一类被称为临界转变的非线性过程,广泛存在于生理系统、生态系统、气候系统和社会系统中。一般来说,这种转变包括系统状态的剧烈转换,因为它接近称为临界点(TP)的临界阈值在经过临界点之前,系统状态逐渐发生变化,但仍保持原有状态。当它接近临界点时,一个微小的增量变化,甚至一些随机噪声都可能导致灾难性的位移,最终将状态带入另一种状态,使其难以回到原始状态。
这项研究利用经典AST小鼠模型(Kras LSL-G12D/+;Lkb1flox/flox, KL),通过动态网络生物标志物(dynamic network biomarker,DNB)全面分析不同阶段肺肿瘤的转录组动态,并通过其下游效应子FOXO3A确定Wnt信号突然被活性氧(reactive oxygen species,ROS)过度积累抑制的转折点。使用两种不同的Ctnnb1条件敲除小鼠品系对Wnt通路进行双向遗传扰动,证实了其在AST负调控中的重要作用。重要的是,在引爆点之前而不是引爆点之后激活Wnt通路的药理学作用会抑制鳞状细胞转分化,突出了跨越引爆点后AST的不可逆性。
图1. 在KL小鼠模型中,Wnt通路的失活促进了AST过程(图源自Signal Transduction and Targeted Therapy )
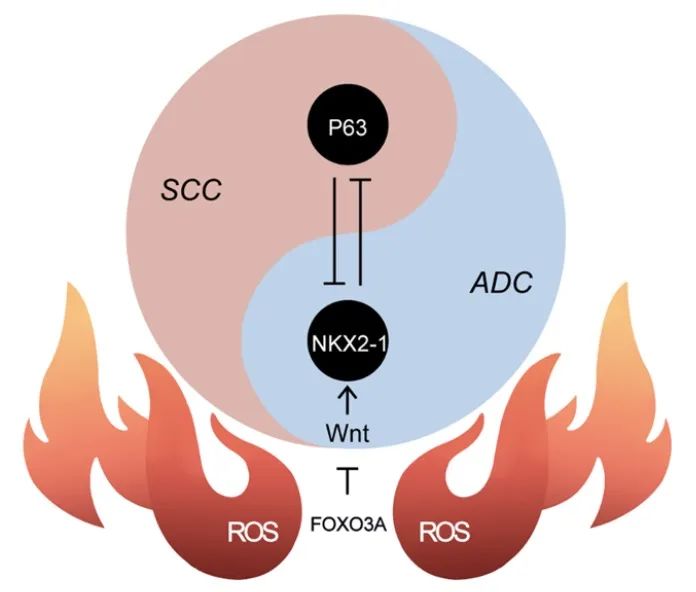
进一步通过对小鼠和人类肿瘤的比较转录组分析,研究发现腺癌和鳞状细胞癌的谱系特异性TFs形成了一个“阴阳”抵消网络。有趣的是,Wnt通路失活优先抑制腺瘤谱系TFs网络,从而破坏“阴阳”内稳态,使其倾向于鳞状谱系,而腺瘤谱系TF NKX2-1的异位表达显著抑制了Wnt通路失活加速的这种表型转变。Wnt通路与AST之间的负相关进一步在人肺腺鳞癌的大队列中观察到。
图2. Wnt-NKX2-1轴在临界点调控AST过程(图源自Signal Transduction and Targeted Therapy )
总的来说,这项研究从网络的角度广泛地描述了肺肿瘤在AST过程中的时间转录组动力学,并揭示了临界点。进一步确定Wnt信号是引爆点的关键调控因子,并提出了ADC和SCC谱系特异性TFs相互抑制模型。此外,过多的ROS确实导致Wnt信号突然失活,进而通过下调NKX2-1水平,破坏ADC和SCC谱系特异性TFs网络之间相互抑制的稳态,最终促进鳞状细胞转分化。
原文链接:
https://www.nature.com/articles/s41392-022-01227-0