肿瘤合并房颤如何抗凝治疗?怎样平衡利弊?
时间:2023-07-19 21:25:43 热度:37.1℃ 作者:网络
随着人口老龄化的进展,肿瘤合并房颤患者的人数也在逐年增加。2021年的发表于Cancer的流行病学调查显示,在2435541例肿瘤患者中,有399344人并发房颤,其中转移癌,前列腺癌,结直肠癌和肺癌患者合并房颤的人数较多[1]。肿瘤患者易发房颤可能与老龄化、抗肿瘤治疗、手术、肿瘤入侵、心血管和代谢综合征、炎症、缺氧、副肿瘤综合征等有关;从机制角度说,肿瘤本身引发的系统性炎症反应,自主神经功能障碍,机械刺激和氧化应激反应也是其中的重要环节[2]。
与普通患者相比,肿瘤患者并发房颤往往伴随着一系列不良的结局,例如两倍的血栓栓塞或卒中风险及六倍的心衰风险,此外,癌症与房颤的共同作用会导致患者死亡率,大出血,颅内出血的概率大大增加[3],所以掌握其抗凝治疗的指征和策略至关重要。
肿瘤合并房颤患者在开启抗凝治疗之前,首先要进行TBIP的评估[4]。
TBIP评估
T 栓塞风险
T代表thrombotic risk,即栓塞风险,主要采用CHA2DS2-VASc评估。男性大于等于2分或女性大于等于3分应立即开始抗凝治疗,男性大于等于1分或女性大于等于2分应该考虑抗凝治疗。男性大于等于0分或女性大于等于1分可以考虑抗凝治疗。在应用该评价体系时需要注意若干问题,例如目前该评分还未在肿瘤患者中广泛验证;该模型在不同癌症中预测价值不同,在乳腺肿瘤,子宫肿瘤,转移肿瘤表现更好;可能会低估患者栓塞的风险[1]。
B 出血风险
B代表bleeding risk,即出血风险,需要综合以下情况综合考虑:是否合并血小板减少症;特定类型的肿瘤;是否是进展中的颅内病变;是否有活动性出血或近期大出血;是否合并严重肾功能不全[eGFR<30 ml/(min·1.73 m2)]及HAS-BLED评分(高血压、肾和肝功能异常、卒中、出血史、国际标准化比率、老年、药物或酒精)。膀胱癌,胃癌,肝癌,前列腺癌,白血病等合并出血的风险较大,需要特别注意[1,4]。
I 药物相互作用
I代表drug interaction,即药物相互作用。在肿瘤心脏病患者中,由于药物复杂的药理作用,狭窄的治疗窗口及多药联合使用的需求,掌握药物相互作用非常重要。
药物相互作用包括三种类型:药剂学,药代动力学和药效动力学。药剂学是两种药物直接相互作用;药代动力学是由于两种药物共用一条通路导致药物吸收,分布,代谢,排泄等改变;药效动力学则是某种药物的存在增强了另一种药物的作用[5]。
临床上常用的抗凝药物主要有三种:维生素K拮抗剂(VKA),低分子量肝素(LWMH)和新型口服抗凝剂(NOAC)。VKA可以和包括化疗药,抗生素在内的多种药物发生药物相互作用,药物相互作用发生的可能性显著高于LMWH和NOAC;LWMH不经过肝药酶CYP450代谢,所以极少与其他药物产生药代动力学的相互作用;NOAC均需要经过P-gp代谢,其中利伐沙班和阿哌沙班还需要依赖CYP3A4途径,显著抑制或诱导P-gp或CYP3A4的药物均可能导致NOAC浓度的改变[6]。
P 患者
P代表patients,在进行详尽的栓塞、出血和药物相互作用的评估后,还需要结合患者的经济状况和意愿进行最终的决定。
抗凝治疗
在进行TBIP评估后,才可进行后续的抗凝治疗。如之前所述,维生素K拮抗剂,低分子量肝素和新型口服抗凝剂是目前临床常用的抗凝药物,掌握其适应证和不良反应至关重要。
维生素K拮抗剂(VKA)
维生素K拮抗剂(VKA)具有廉价,经肾脏独立代谢等一系列优点,在瓣膜病或置换机械瓣膜的病人中,华法林仍然是唯一指定用药。然而一系列大型临床研究证实,华法林的安全性和有效性低于直接口服抗凝剂和低分子量肝素,且会增加出血和深静脉血栓形成的风险[7]。此外,经过一年的抗凝治疗后,使用华法林的患者与其他使用抗凝剂的组别相比具有更高的全因死亡风险[8]。所以在非瓣膜病的肿瘤合并房颤的患者中,VKA不做常规使用。
低分子量肝素(LMWH)
低分子量肝素(LMWH)为患者提供了一个短期抗凝的选择,对于新发肿瘤或处于进展期的肿瘤患者较为适用,此外,所有指南均推荐用低分子量肝素治疗癌症相关静脉血栓栓塞至少3到6个月。LMWH是除NOAC以外的第二选择[9]。
新型口服抗凝剂(NOAC)
新型口服抗凝剂(NOAC)是目前肿瘤合并房颤患者使用最多的药物,与VKA和LMWH相比,其具有更好的安全性和有效性。临床试验表明,NOAC在系统性栓塞和死亡的预防作用大于LMWH[10]。但是在应用NOAC时需要注意以下问题:考虑到药物相互作用,不推荐与具有P-gp诱导或抑制作用的抗肿瘤药物合用,若抗肿瘤治疗药物会影响CYP3A4的活性,则尽量选择达比加群或依多沙班;肿瘤患者具有更高的概率罹患肾脏疾病,同时抗肿瘤药物也可能具有肾毒性,肾功能不全会影响所有NOAC药物在体内的代谢(肾脏清除率:达比加群80%,依多沙班50%,利伐沙班33%,阿哌沙班27%),适当的剂量调整对肾功能障碍患者至关重要。
对于肌酐清除率<15 ml/min或终末期肾病患者则不推荐使用NOAC;由于肿瘤入侵骨髓或二次免疫介导现象的发生,肿瘤患者可能患有血小板减少症。根据个体血栓形成风险,当血小板计数降至50000至70000/ml以下时,应避免抗凝。在这个范围以下,可以考虑输注血小板或使用减少剂量的抗凝策略,以进行不间断抗凝治疗[11]。
综合以上内容,我们对肿瘤患者抗凝治疗进行总结(图1)。首先需要根据TBIP评估患者的栓塞,出血的风险,继而考虑药物相互作用和患者及家属的意愿决定是否进行抗凝治疗以及抗凝的方案。在药物选择方面,若患者合并瓣膜病或者已经进行过机械瓣膜置换术,则需要使用VKA抗凝,除此之外不推荐使用VKA。对于LMWH和NOAC的选择,若没有NOAC的禁忌证(药物相互作用或终末期肾病)均应使用NOAC,否则选择LMWH[12]。不推荐使用抗血小板治疗及预防性LMWH用药。
虽然近年来对于肿瘤合并房颤患者抗凝的评估和治疗进行了许多临床研究,但是依然有一些问题尚未得到解决。需要进行多学科交叉,建立更有效的栓塞/出血评估系统,综合患者自身情况和意愿决定抗凝方案的选择,还需要进行详细的随访和监测,以期得到更好的治疗效果。
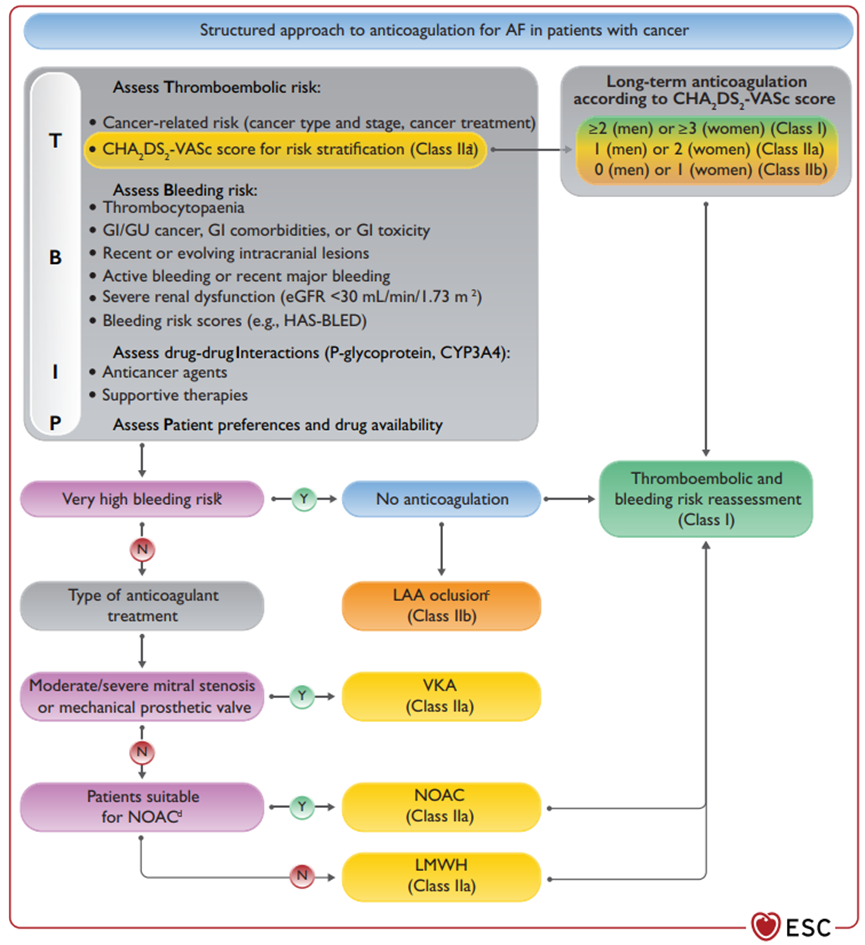
图1 肿瘤患者心房颤动抗凝的结构化方法。a 在特定病人中应考虑与血栓栓塞风险增加相关的影像学参数;b 出血风险极高:活动性或近期大出血;近期/进展中的颅内病变;血小板计数<25000/µL;c 经皮左心耳封堵术可考虑用于预期寿命大于1年,血栓栓塞和出血风险高且抗凝禁忌的患者;d 低分子量肝素的适用情况:未手术的胃肠道/泌尿道肿瘤;胃肠道合并症或毒性;严重肾功能障碍;引起严重后果的NOAC相关药物相互作用;血小板计数<50000/µL. 来源于2022ESC肿瘤心脏病指南[4]。
参考文献:



