Nature Communications:牙膏中的这种抑菌成分,会引发肠道炎症
时间:2022-01-18 14:04:22 热度:37.1℃ 作者:网络
说起三氯生(triclosan,TCS)这个化学名词,对于大多数中国消费者来说还非常陌生。普通人很少知道,三氯生是一种广谱抗菌剂,广泛被添加在牙膏、肥皂、除臭剂、漱口水、剃须膏等日化用品中。其中,牙膏更是三氯生的添加「大户」。
在 2016 年,美国食品和药物管理局(FDA)下令将三氯生从家庭和医院环境中使用的洗手产品中移除,主要原因是考虑到三氯生会导致更多的耐药细菌。事实上,有关三氯生安全性的争论一直存在,早在 2005 年就曾有过关于三氯生牙膏安全性存疑的新闻。
2021 年 1 月 10 日,由北卡罗来纳大学教堂山分校、马萨诸塞大学阿默斯特分校和香港浸会大学领导的一个国际研究小组,在 Nature Communications 上发表了题为 :Microbial enzymes induce colitis by reactivating triclosan in the mouse gastrointestinal tract 的研究论文,这项在小鼠上进行的研究证明了三氯生如何引发肠道炎症。

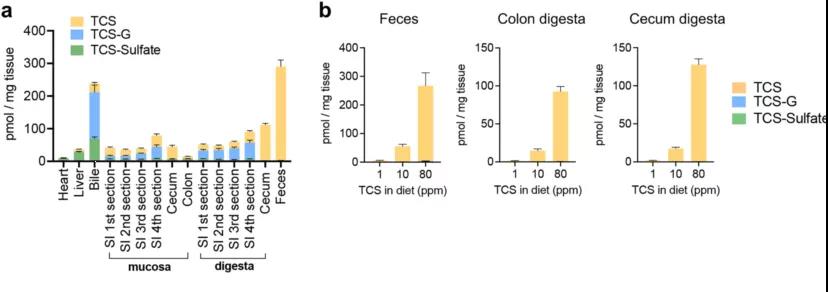
小鼠肠道中独特的三氯生代谢谱
研究者首先试图确定肠道是否表现出与其他组织不同的三氯生代谢特征。通过食用 80 ppm 三氯生(triclosan,TCS)处理小鼠 4 周,然后使用 LC-MS/MS 分析一系列小鼠各组织中 TCS 及其代谢物的浓度。结果显示在 TCS 暴露后,在肝脏、胆汁、心脏和小肠中发现的主要 TCS 相关化合物是代谢物 TCS-G。相比之下,小鼠盲肠和结肠以游离 TCS 为主。
在小鼠小肠第 4 段食糜中发现的 TCS 代谢物为 36.9% 的游离 TCS、55.4% TCS-G 和 7.7% TCS-sulfate(TCS 硫酸结合型代谢产物);而粪便含量显示出 99.1% 的游离 TCS,只有 0.7% TCS-G 和 0.2% TCS-sulfate。这些结果表明,与其他组织相比,结肠具有明显的 TCS 代谢特征,并且独特地含有几乎普遍的游离 TCS。
人体肠道中独特的三氯生代谢谱
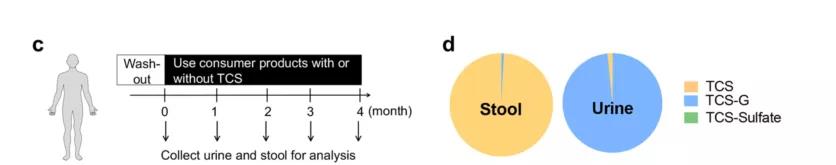
为了拓宽对肠道中 TCS 代谢谱的理解,接下来分析了人类受试者的 TCS 代谢。研究者使用了此前一项研究的尿液和粪便样本,其中招募的人类受试者首先经历了一个冲洗期(不使用含有 TCS 的产品),然后被随机分配到使用含有或不含有 TCS 的牙膏组,使用时间长达四个月。
研究者分析了暴露于 TCS 的人类受试者中 TCS 的代谢特征。LC-MS/MS 显示,在所有测试 TCS 暴露的受试者中,粪便样本中的主要化合物是游离 TCS,而尿液样本中的主要化合物是 TCS-G。人粪便中 TCS、TCS-G 和 TCS-sulfate 的平均摩尔浓度比为 99.2%:0.8%:0.0%,而尿液中为 1.6%:98.4%:0.0%。总之,这些结果表明人类肠道表现出独特的 TCS 代谢特征,并且含有高丰度的游离 TCS。
肠道微生物群将结肠中的 TCS-G 转化为 TCS
实验数据显示,从肠道的近端到远端区域,TCS 的浓度增加,而 TCS-G 的浓度降低。因此,研究者假设肠道微生物群参与 TCS-G 向 TCS 的转化,导致 TCS 在下消化道中的积累。
为了验证这一假设,研究使用了多种方法,包括肠道细菌的体外培养、抗生素介导的体内肠道细菌抑制和无菌小鼠模型的使用,以检查肠道微生物群在 TCS 结肠代谢中的作用。
首先,研究者在厌氧条件下培养肠道细菌,并检测培养的细菌是否可以在体外将 TCS-G 转化为 TCS,发现来自小鼠和人类的粪便细菌能够以显着高于对照的水平催化 TCS-G 向 TCS 的转化。这些结果支持了厌氧培养的肠道细菌可以催化 TCS-G 去葡萄糖醛酸化以产生 TCS 的结论。
为了进一步检查肠道细菌在 TCS 结肠代谢中的作用,检测了抗生素作用的时间依赖性,用或不用抗生素混合物对小鼠进行预处理,然后通过一次性口服管饲法接受 TCS,然后在处理后 4、8、12 和 24 小时检查 TCS 的代谢特征。发现肠道细菌的抗生素抑制以时间依赖性方式降低了小鼠结肠食糜中的 TCS 并增加了 TCS-G。这一发现进一步支持肠道细菌有助于结肠中 TCS-G 转化为 TCS 的结论。
最后,研究者使用无菌小鼠模型进一步检查肠道微生物群在 TCS 结肠代谢中的作用。通过 TCS 处理普通小鼠或无菌小鼠,然后在 4 和 8 小时分析结肠 TCS 代谢谱。结果显示与普通小鼠相比,无菌小鼠在其结肠食糜中表现出 TCS 减少和 TCS-G 增加,这与抗生素实验的结果一致。这些结果支持了共生微生物在结肠中将 TCS-G 转化为 TCS 的结论。

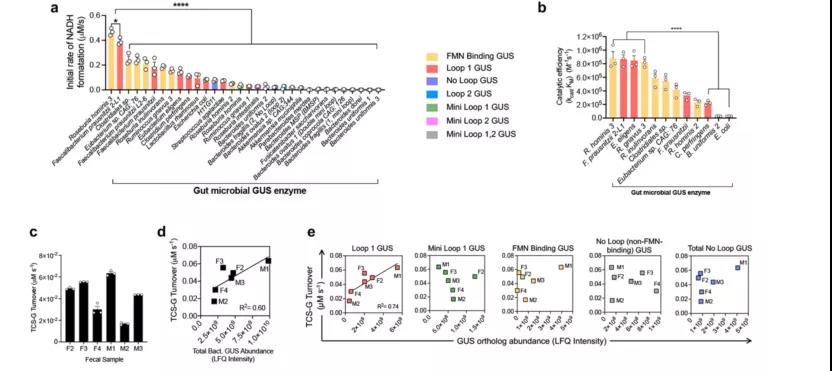
β-葡萄糖醛酸酶(GUS)直系同源物将 TCS-G 转化为 TCS
接下来,研究者试图寻找将 TCS-G 转化为 TCS 的特定的肠道微生物酶。由于肠道 β-葡萄糖醛酸酶(GUS)能够将多种葡萄糖醛酸化代谢产物转化为相应的糖基,因此假设肠道微生物 GUS 同源物能够催化 TSC-G 转化为 TCS。
人类和小鼠的肠道微生物群已被证明含有数百种独特的肠道微生物 GUS 酶,这些酶对不同的葡萄糖醛酸酯表现出不同的底物特异性。先前的研究表明,微生物的 GUS 酶可以根据活性位点结构和/或辅助因子结合分为 7 个不同的分支。研究人员创建了 32 个纯化的肠道微生物 GUS 酶,代表 7 个分支,用于体外酶学筛选。
研究者首先通过偶联实验筛选了 TCS-G 的裂解活性,发现 Loop 1 和黄素单核苷酸(FMN)结合的 GUS 同源物在利用底物 TCS-G 时的效率最高。通过在人类粪便中对不同 GUS 酶催化 TCS-G 向 TCS 转化效率的检测和比较,同样支持 Loop 1 肠道微生物 GUS 酶似乎是 TCS-G 转化的重要驱动因素这一结论。
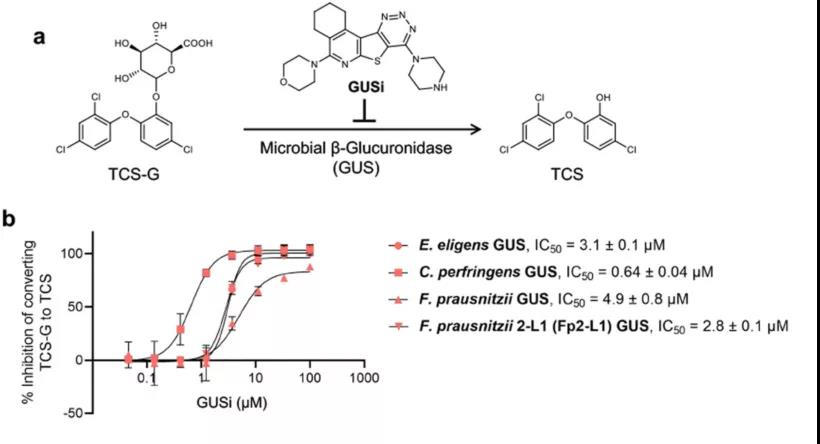
GUS 酶的靶向抑制消除了 TCS 在体内的结肠炎促进作用
首先,研究人员在体外测试了 GUS 抑制剂(UNC1020165224,37; GUSi)对 TCS-G 加工的影响,发现它通过纯化的 Fp2-L1 GUS 酶以及其他几种 Loop 1 GUS 酶以剂量依赖方式抑制了 TCS-G 向 TCS 的转化。更令人惊讶的是,GUSi 还抑制了 TCS-G 通过 FMN 结合 GUS 酶的加工。
接下来,研究者通过体外粪便酶混合物测试了 GUSi 对 TCS-G 加工的影响。虽然这里只对两位男性和两位女性粪便样本进行了测试,但发现 GUSi 抑制 TCS-G 加工的方式反映了每个检查样本中存在的 GUS 水平。特别是 GUSi 对含有较高水平 Loop 1 GUS 酶的离体样品表现出更有效的抑制作用。这些数据证实 GUSi 在体外人类粪便提取物中阻断 TCS-G 加工。
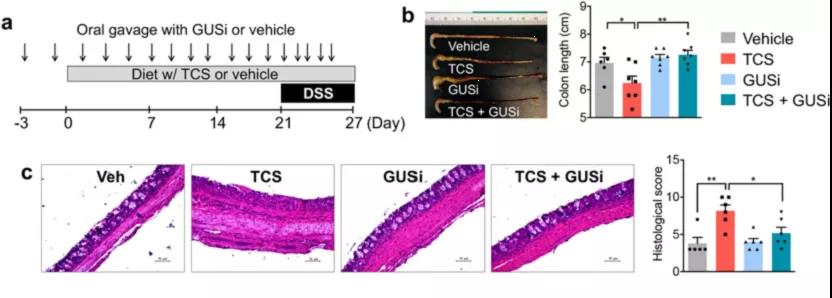
最后,研究者使用 GUSi 来确定肠道微生物 GUS 酶在 TCS 促进结肠炎中的作用。研究者用 TCS 处理小鼠,通过口服管饲法联合或不联合给予 1 mg/kg GUSi,并检查了葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎的发展。结果显示,与对照组相比,TCS 暴露增加了 DSS 诱导的小鼠结肠炎的严重程度。然而,这种效果被 GUSi 消除。
在没有 GUSi 的情况下,暴露于 TCS 会加剧 DSS 诱导的结肠炎:与对照组相比,TCS 处理减少了结肠长度,导致更严重的隐窝损伤,增强了免疫细胞的结肠浸润,包括 CD45+ 白细胞、CD45+F4/80+ 巨噬细胞和 CD45+Gr1+ 中性粒细胞,以及结肠中促炎基因(Tnf-a、Mcp-1、Il-6、Il-17 和 Il-23)的表达增加。然而,通过 GUSi 的共同给药,TCS 的结肠炎增强作用在所有测量中都被消除。因此,抑制肠道微生物 GUS 酶消除了 TCS 的结肠炎增强作用,支持了肠道细菌产生的 GUS 酶是 TCS 肠道毒性所必需的结论。
本研究表明肠道共生微生物介导结肠中三氯生的代谢活化并驱动其肠道毒理学。使用一系列体外和体内实验,确定了所涉及的特定酶——β-葡萄糖醛酸(GUS)酶。并且,对 GUS 酶进行靶向抑制后可消除三氯生的结肠炎促进作用。总之,该研究结果揭示了肠道微生物酶对三氯生的代谢激活和其肠道毒性的机制,将有助于更好地评估三氯生在不同人群中的个体效应。
目前,为减少细菌污染,三氯生作为抑菌剂仍广泛添加到化妆品、瑜伽垫和其他运动服装和装备中。由于三氯生可以预防牙龈炎,因此在许多牙膏中添加使用。此前已有研究证实了三氯生的毒性,而这项新研究提供了三氯生对肠道微生物变化的更仔细的研究。
研究作者 Matthew Redinbo 表示:「通过确定罪魁祸首细菌,可以开发新的方法来诊断,预防和治疗炎症性肠病」。这些研究结果共同表明,考虑到三氯生和相关化合物对肠道的潜在危害,应当重新评估三氯生对人体健康的影响。
原始出处:
Zhang, J., Walker, M.E., Sanidad, K.Z. et al. Microbial enzymes induce colitis by reactivating triclosan in the mouse gastrointestinal tract. Nat Commun 13, 136 (2022).


