Cardiovasc Res:C-C 基序趋化因子受体 2 阻断剂可改善大鼠肺动脉高压并与肺血管扩张剂产生协同作用
时间:2024-11-21 19:00:16 热度:37.1℃ 作者:网络

研究目的
肺动脉高压(PAH)是一种以肺血管重塑、血管阻力增加和右心功能衰竭为特点的严重疾病。尽管现有治疗方法如肺血管扩张剂能够缓解症状,但许多患者对治疗反应有限,特别是伴有显著炎症的患者。本研究旨在探讨C-C基序趋化因子受体(CCR2)的破坏是否能够通过逆转相关的促炎状态和血管功能障碍来减轻PAH的发展,并验证其是否能与传统的肺血管扩张剂协同发挥作用。
方法与结果
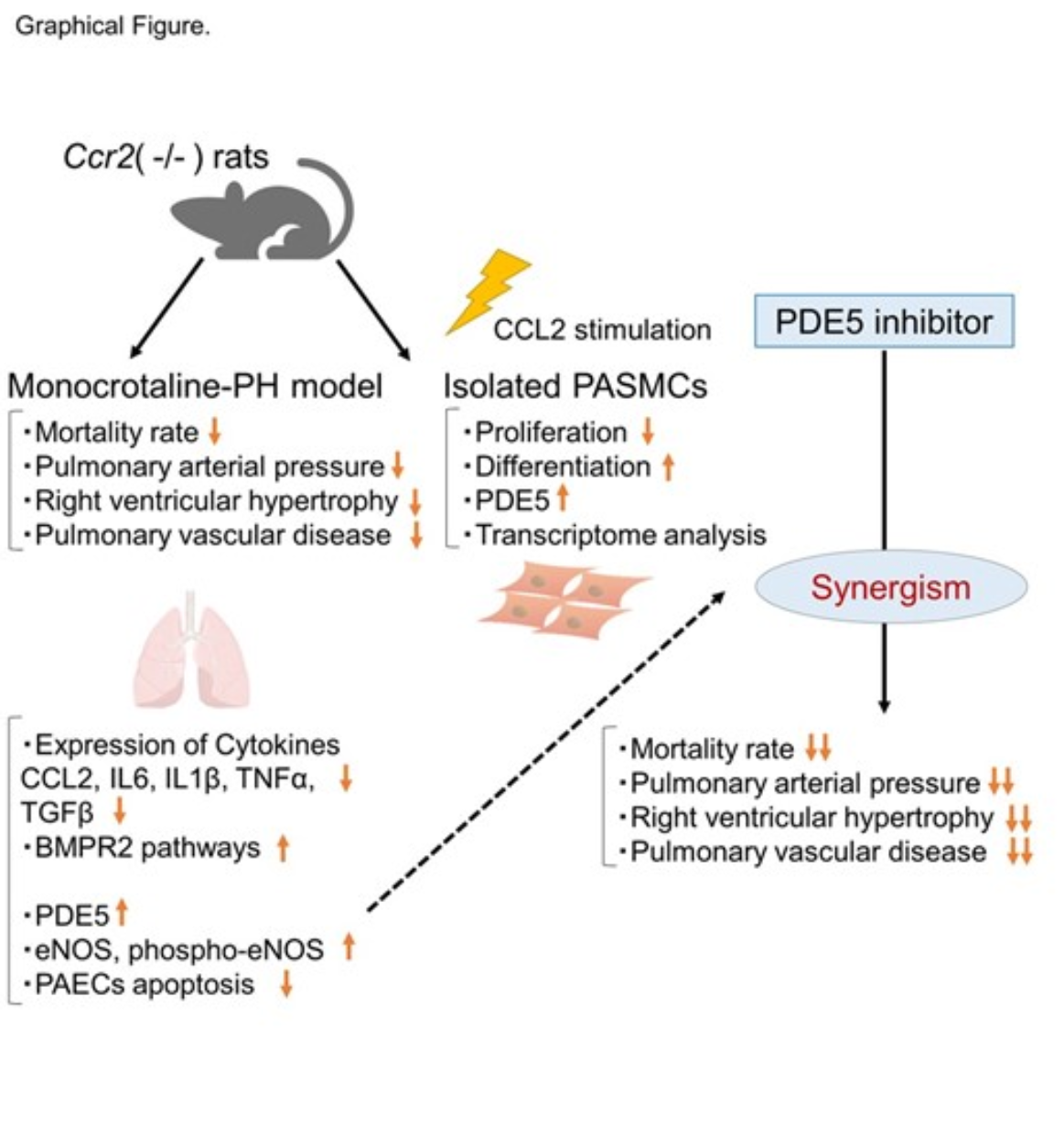
我们采用CRISPR/Cas9技术生成了Ccr2基因敲除(Ccr2(-/-))大鼠,以研究Ccr2(+/+)和Ccr2(-/-)大鼠在单纯红霉素(MCT)、SU5416/低氧(SuHx)和慢性低氧(CH)处理下的肺动脉高压(PH)表现。在MCT诱导的模型中,Ccr2(-/-)显著降低了右心室收缩压(RVSP,右心室肥厚的重要指标)和死亡率。同时,Ccr2(-/-)逆转了MCT注射3周后大鼠肺中多种促炎性细胞因子和趋化因子(如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C-C基序趋化因子受体(CCL)-2、白细胞介素-1β(IL-1β)和转化生长因子-β(TGF-β))的表达增加。然而,这种保护作用在SuHx和CH模型中未观察到,表明CCR2的作用可能依赖于特定的病理机制。
进一步研究显示,在MCT处理的Ccr2(-/-)大鼠中,肺血管疾病(PVD)的病理特征显著减轻,血管周围巨噬细胞浸润减少。此外,Ccr2(-/-)逆转了骨形态发生蛋白受体2型(BMPR2)信号的损伤、内皮细胞凋亡增加和一氧化氮(NO)信号通路的受损情况,同时降低了肺中磷酸二酯酶-5(PDE5)的表达。尽管Ccr2(-/-)对MCT大鼠肺中前列腺素I2(PGI2)和内皮素(ET)受体的基因表达无明显影响,但其作用通过其他分子机制改善了肺血管和心脏的病理状态。
在体外研究中,培养的肺动脉平滑肌细胞(PASMCs)进一步揭示了CCR2的关键作用。Ccr2(-/-)抑制了由CCL2诱导的PASMCs过度增殖和去分化,同时逆转了CCL2诱导的PDE5表达降低。此外,通过全基因组RNA测序分析,我们发现CCL2刺激的Ccr2(-/-) PASMCs中,与细胞分化和收缩调节相关的基因表达显著变化,表明CCR2对血管平滑肌细胞表型和功能的调控作用。
基于这些发现,我们进一步探讨了CCR2破坏是否能与PDE5抑制剂他达拉非(tadalafil)协同作用。在MCT处理的Ccr2(-/-)大鼠中,他达拉非显著改善了PH和PVD的症状,但在Ccr2(+/+)大鼠中无效。此外,他达拉非进一步提高了MCT处理的Ccr2(-/-)大鼠的生存率,表明CCR2破坏与PDE5抑制剂之间存在协同作用。
结论
本研究首次系统性地证明了CCR2的破坏能够减轻MCT诱导的大鼠PAH。这一效应与炎症通路的调控和血管功能障碍的逆转密切相关,具体表现为减少促炎因子表达、抑制血管平滑肌细胞病理性增殖和恢复内皮功能。此外,CCR2破坏与PDE5抑制剂他达拉非协同作用进一步改善了大鼠的病理表现和生存率。这些结果表明,CCR2可能成为具有特定炎症表型且对传统肺血管扩张剂耐药的难治性PAH患者的潜在治疗靶点。
本研究为深入理解PAH的炎症机制提供了新视角,并提出了靶向CCR2的精准治疗策略。这一策略结合传统治疗方法,可能为难治性PAH患者带来更佳的治疗效果,未来需要进一步在人类研究中验证其临床价值。
参考文献:
Tsuboya N, Sawada H, Mitani Y, Oshita H, Ohya K, Takeoka M, Kabwe JC, Miyasaka Y, Ito H, Yodoya N, Ohashi H, Maruyama J, Okamoto R, Mashimo T, Dohi K, Nishimura Y, Maruyama K, Hirayama M. C-C motif chemokine receptor-2 blockade ameliorates pulmonary hypertension in rats and synergizes with a pulmonary vasodilator. Cardiovasc Res. 2024 Nov 18:cvae244. doi: 10.1093/cvr/cvae244. Epub ahead of print. PMID: 39556088.


