读书报告 | 淋巴细胞浸润预测免疫检查点抑制剂治疗晚期结直肠癌的优势人群
时间:2023-10-20 00:32:54 热度:37.1℃ 作者:网络
导读
90%以上结直肠癌属于pMMR/MSS肿瘤,此类患者从免疫检查点抑制剂治疗受益可能性极低。但是,早期结直肠癌中肿瘤浸润淋巴细胞(TILs)和免疫评分(Immunoscore)对于预后有良好的预测作用,且预测能力不受肿瘤分期、阳性淋巴结个数、MMR状态、RAS/BRAF状态影响。根据Atezo TRIBE II期研究的亚组分析,Immunoscore是ICIs潜在的疗效预测因素,高Immunoscore的患者更有可能从免疫治疗中获得更长的PFS,与MMR状态和TMB无关。CheckMate 9×8研究提示pMMR/MSS mCRC患者中,CD8+ T细胞水平≥2%可以作为从免疫治疗中获益的预测指标。PD-L1的表达是ICIs疗效的预测标志物,可作为部分实体瘤患者接受免疫治疗的适应症,但是在dMMR/MSI-H mCRC中,ICIs的疗效与PD-L1的表达无关。
本文作者对Atezo TRIBE II期研究中患者的TILs和PD-L1表达进行检测,目的在于评估TILs、Immunoscore、Immunoscore-IC、PD-L1和TMB,并探索它们对于免疫治疗疗效预测的临床相关性,其中,Immunoscore-IC是一种数字化综合评估肿瘤组织CD8+T细胞浸润和PDL1表达的方法,观察到Immunoscore-IC评分有助于识别pMMR结直肠癌的免疫检查点抑制剂受益患者(J Immunother Cancer.2023 Apr;11(4):e006633. doi: 10.1136/jitc-2022-006633)。
前言
近年,随着越来越多的免疫治疗药物问世,针对肿瘤免疫微环境的研究受到广泛重视,通过寻找肿瘤免疫原性标志物,能够预测免疫检查点抑制剂(ICIs)的疗效。
在早期结肠癌,肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes;TILs)和免疫评分(Immunoscore)对于预后有良好的预测作用,且预测能力不受肿瘤分期、阳性淋巴结个数、MMR状态、RAS/BRAF状态影响。在mCRC中,TILs的预后预测价值已经明确,但细胞毒治疗和靶向治疗联合或不联合ICIs的疗效预测因素仍有待探索。
根据Atezo TRIBE II期研究的亚组分析,Immunoscore是ICIs潜在的疗效预测因素,高Immunoscore的患者更有可能从免疫治疗中获得更长的PFS,与MMR状态和TMB无关。
CheckMate 9×8研究提示pMMR/MSS mCRC患者中,CD8+ T细胞水平≥2%可以作为从免疫治疗中获益的预测指标。
PD-L1的表达是ICIs疗效的预测标志物,可作为部分实体瘤患者接受免疫治疗的适应症。但是在dMMR/MSI-H mCRC中,ICIs的疗效与PD-L1的表达无关。从CheckMate9×8研究的亚组分析得出,95%的pMMR/MSS肿瘤患者的PD-L1表达不影响ICIs联合化疗的疗效。
基于以上考虑,作者对Atezo TRIBE II期研究中患者的TILs和PD-L1表达进行检测,目的在于评估TILs和Immunoscore之间的一致性,并探索它们对于免疫治疗疗效预测的临床相关性。
研究方法
研究人群:来源于Atezo TRIBE(NCT03721653)II期研究的218例患者。
研究特征:
-
II期,开放,多中心
-
初始不可切除mCRC,18-70岁且ECOG 0-2分或者71-75岁且ECOG-PS 0分
-
1:2入组FOLFOXIRI/Bev或者FOLFOXIRI/Bev+Atezo
-
治疗8个周期后采用5-Fu/Bev或者5-Fu/Bev+Atezo维持
-
研究终点:疾病进展或不耐受
研究组:收集Atezo TRIBE研究患者治疗前肿瘤样本进行TILs的评估。
对照组:来自TRIBE2研究;
研究特点:
-
III期、开放、多中心,679例
-
初始无法切除mCRC
-
18-70岁且ECOG-PS 0-2或者71-75岁且ECOG-PS 0
-
1:1的比例接受FOLFIRI/Bev进展后FOLFOX/Bev或者FOLFOXIRI/Bev进展
-
后使用原方案
研究终点:疾病进展或不耐受
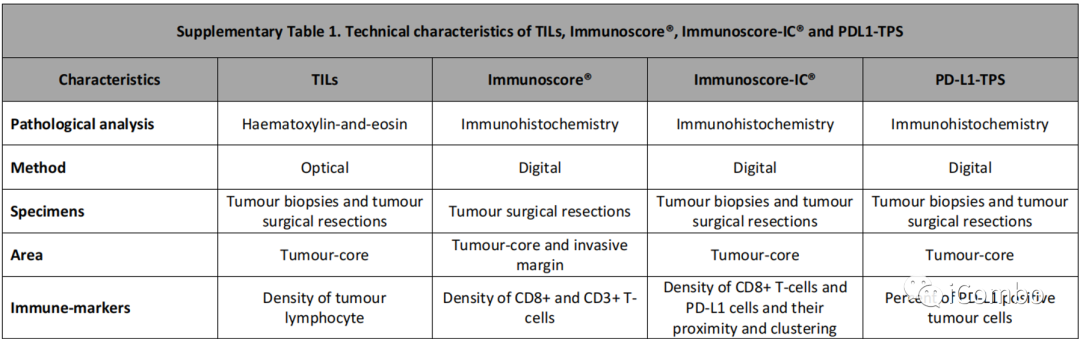
TILs、Immunoscore、Immunoscore-IC、PD-L1和TMB的评估
TILs由Pisa大学外科、医学和分子病理学和重症医学系进行中心评估。组织样本由两名病理学家独立评估,不考虑临床信息、治疗方案和疗效等信息。
TILs的密度定义为在HE染色切片上,40倍视野下,5次随机观察,由>60%的肿瘤细胞组成的肿瘤富集区域计数的平均值。在少细胞肿瘤中,如粘液腺癌,分析是在肿瘤细胞密度最高的区域内进行的。TILs<2.0的肿瘤被定义为低TILs,而TILs≥2.0的肿瘤被定义为高TILs。
Immunoscore、Immunoscore-IC、PD-L1在Veracyte实验室进行独立评估,不考虑患者的临床数据、治疗方案和疗效。
评估Immunoscore时,只有手术切除的原发肿瘤或肝转移瘤的标本被认为符合条件,而活检样本被排除。
每个患者的Immunoscore评估由4个密度百分位数(两个标记物和2个区域)的平均值计算,然后根据预先设定的cut-off值,密度评分为0-25%为低,25-100%为高。
对于Immunoscore-IC检测,从原发肿瘤或转移部位进行的手术切除标本或活检标本均被认为符合条件。
五个参数以线性值测量被选择纳入Immunoscore-IC评分:
-
总CD8密度:density of total CD8
-
CD8-的密度:density of CD8-free (without PD-L1+ cell in proximity)
-
CD8簇密度:density of CD8-cluster(CD8 cells in proximity of less than 20 micrometers of another CD8)
-
PD-L1细胞密度:density of PD-L1 cells
-
CD8阳性细胞和PD-L1阳性细胞之间的距离:distance between CD8-positive and PD-L1-positive cells。
参考翻译:无PD-L1+细胞的CD8,CD8簇集,靠近PD-L1细胞的CD8细胞,CD8密度,靠近CD8细胞的PD-L1细胞
根据这5个参数分为两类:低危组且Immunoscore-IC标记物高定义为高Immunoscore-IC;而高危组且Immunoscore-IC标记物低定义为低Immunoscore-IC。
PD-L1免疫组化检测采用手术切除的标本或原发肿瘤或转移部位的活检标本。使用HALO平台,通过数字化病理来定量PD-L1+肿瘤细胞的密度。采用1%的cut-off值来区分PD-L1的高低表达,检测TPS。
TMB采用FoundationOne CDx assay(Foundation Medi_x0002_cine, Cambridge, Massachusetts, USA)进行评估,采用10Mut/MB的cut-off值来区分高TMB和低TMB。
研究对象特征
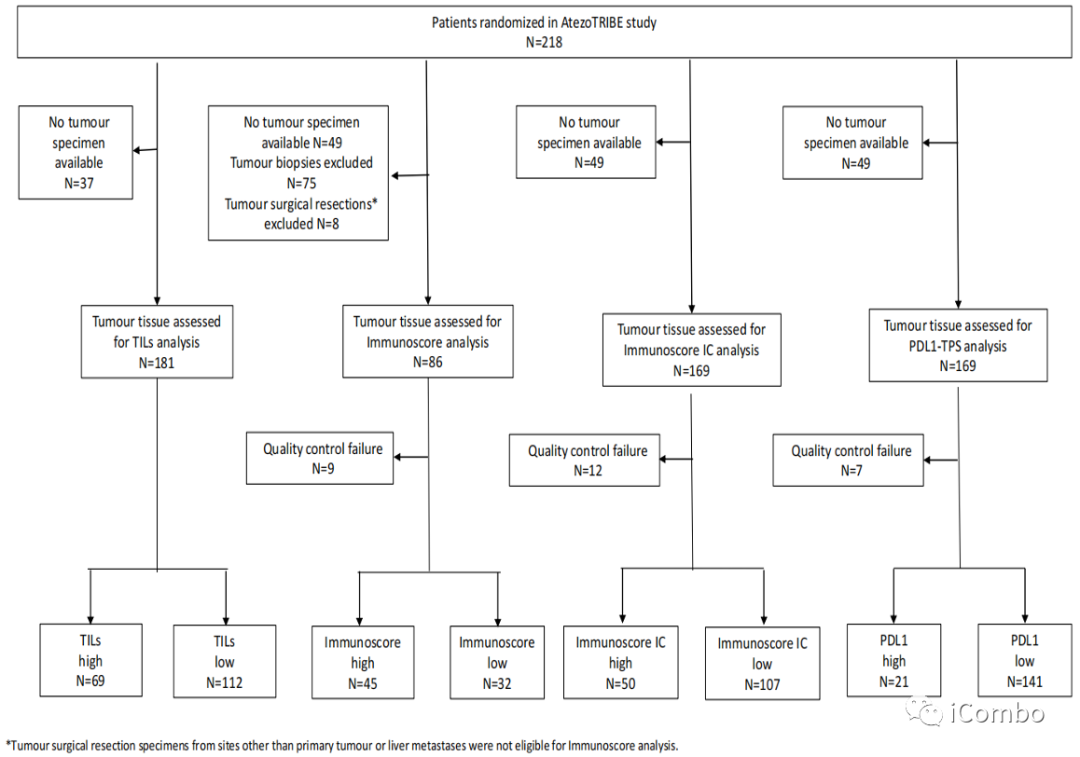
在纳入的218例患者中,分别有181例(83%)、77例(35%)、157例(72%)和162例(74%)标本成功检测了TILs、Immunoscore, Immunoscore-IC、PD-L1的表达,69例(38%)、45例(58%)、50例(32%)和21例(13%)肿瘤分别为高TILs、高Immunoscore,高Immunoscore-IC、高PD-L1。
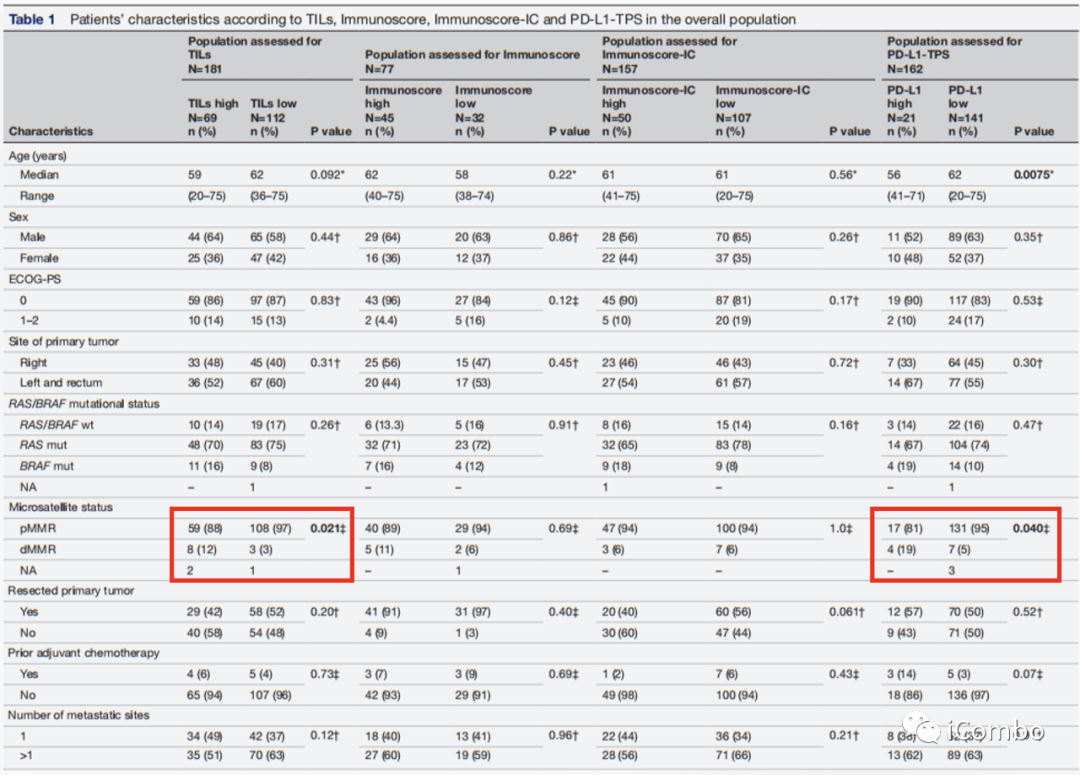
高TILs与低TILs相比,更多表现为dMMR(12% vs 3%, p=0.021)。
高PD-L1与低PD-L1相比,更多表现为dMMR(19% vs 5%, p=0.040)。
研究对象特征(续)
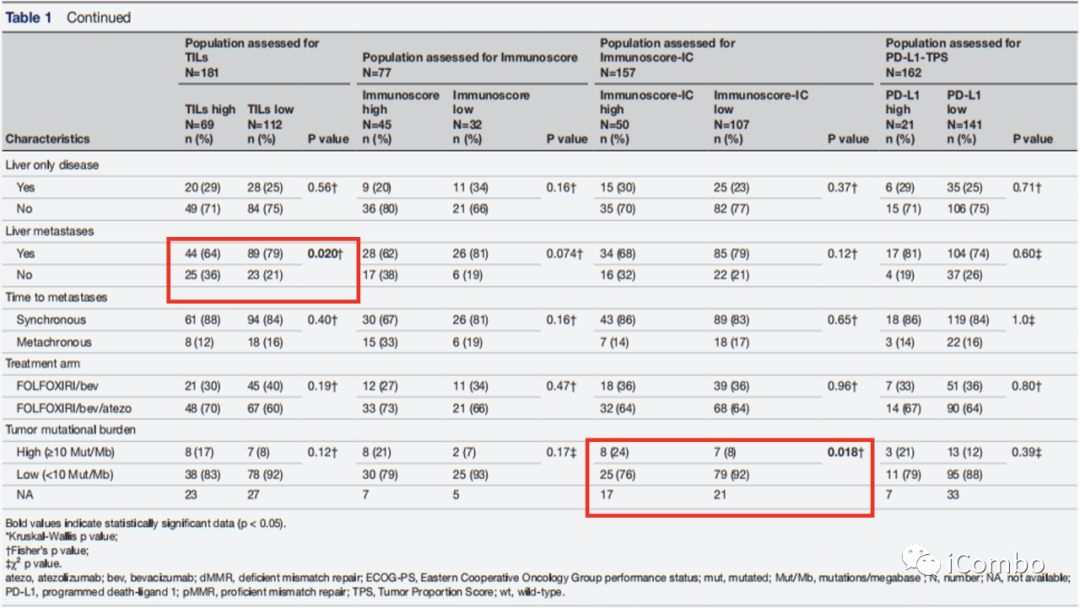
高Immunoscore-IC比低Immunoscore-IC有更高的TMB(24%vs8%,p=0.018)。
高TILs比低TILs的肝转移发生率较低(64% vs 79%,p=0.020)。
研究对象特征(pMMR)
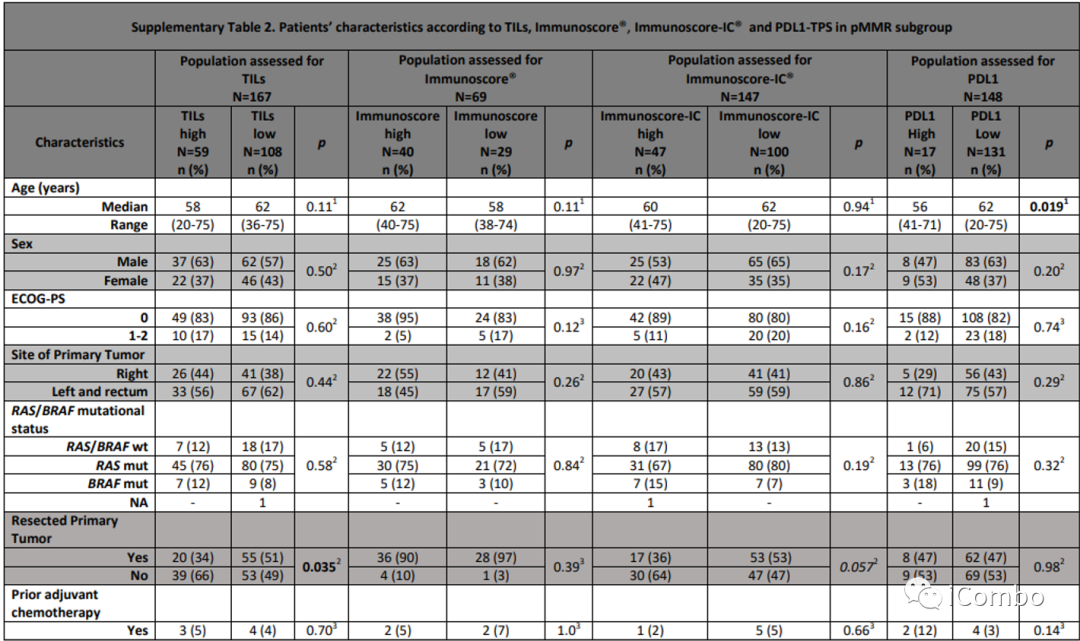
在pMMR人群中观察到与全人群一样的结果。
研究对象特征(pMMR;续)
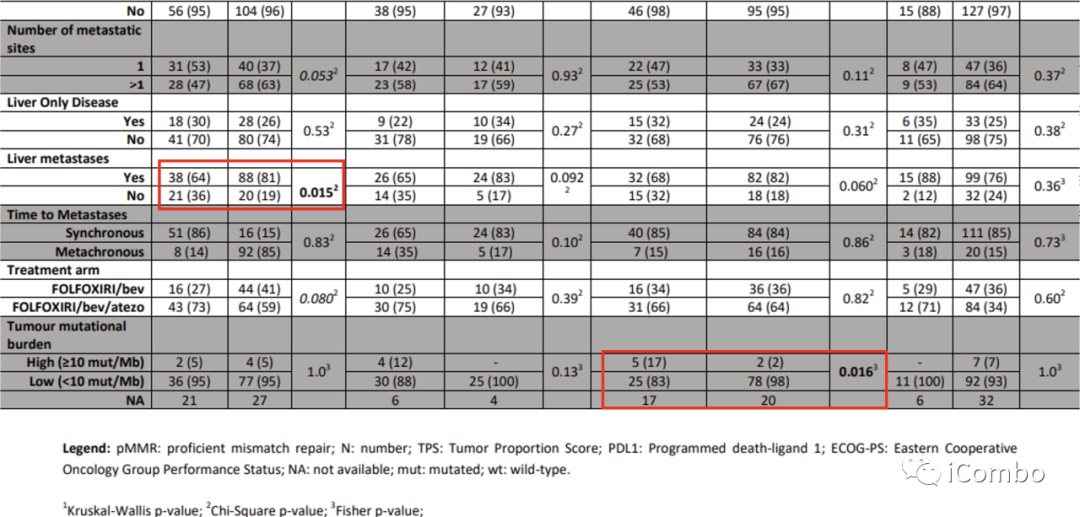
研究结果
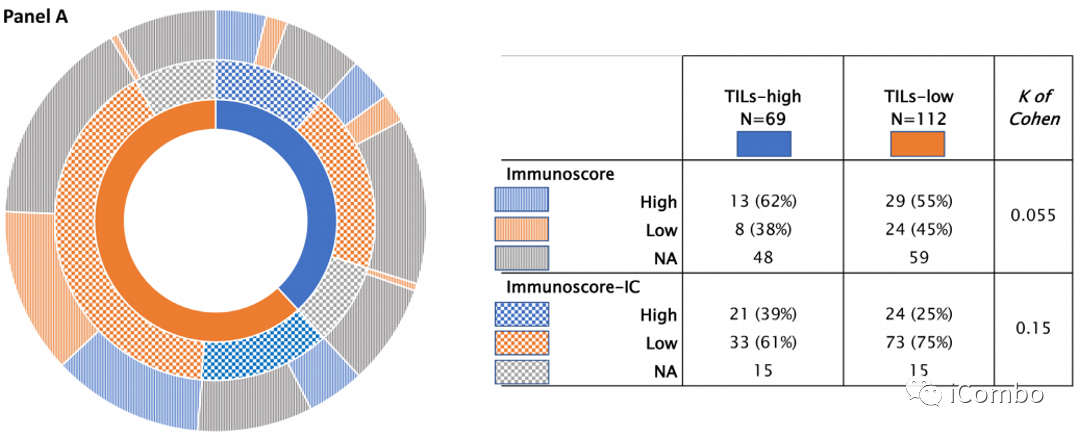
在高TILs(n=69)中,有Immunoscore的有21例(30%),有Immunoscore-IC的有54例(78%),其中13例(62%)为高Immunoscore,21例(39%)为高Immunoscore-IC。
在低TILs(n=112)中,有Immunoscore的有53例(47%),有Immunoscore-IC的有97例(87%),其中24例(45%)为低Immunoscore,73例(75%)为低Immunoscore-IC。
TILs与Immunoscore或Immunoscore-IC之间的一致性较差(K of Cohen=0.055 and 0.15)。
研究结果(pMMR)
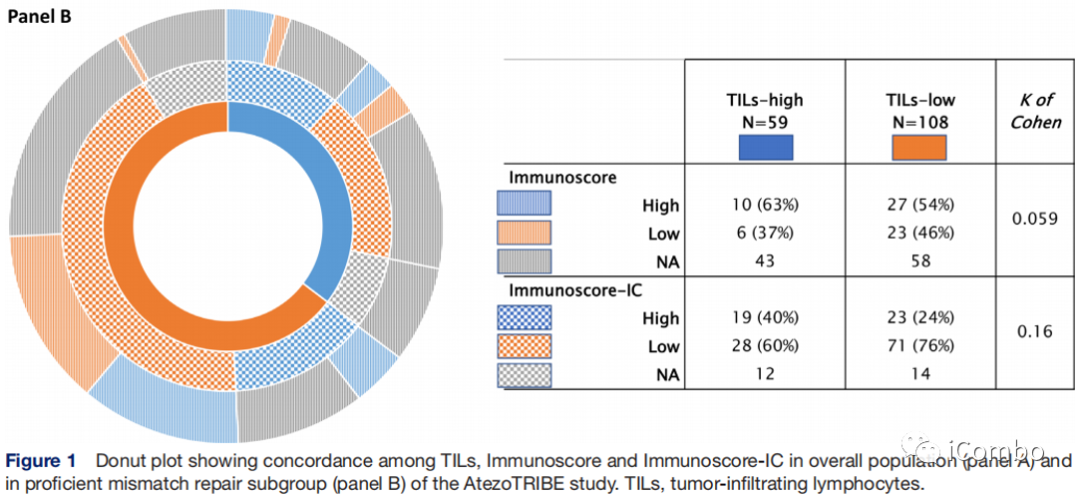
在pMMR人群中,TILs与Immunoscore或Immunoscore-IC之间的一致性较差,与全人群类似。
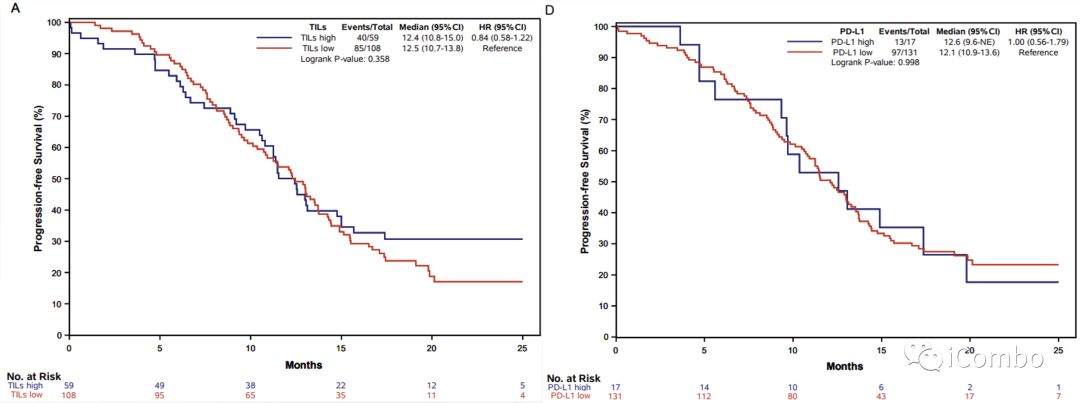
Supplementary Figure 2: Kaplan–Meier curves of progression-free survival according to TILs (panel A), Immunoscore® (panel B), Immunoscore-IC® (panel C) and PD-L1 expression (panel D) in the pMMR population of the AtezoTRIBE study.
在pMMR人群中,高TILs与低TILs肿瘤之间PFS无统计学差异(p=0.36)
在pMMR人群中,高PD-L1与低PD-L1肿瘤之间PFS无统计学差异(p=1.0)
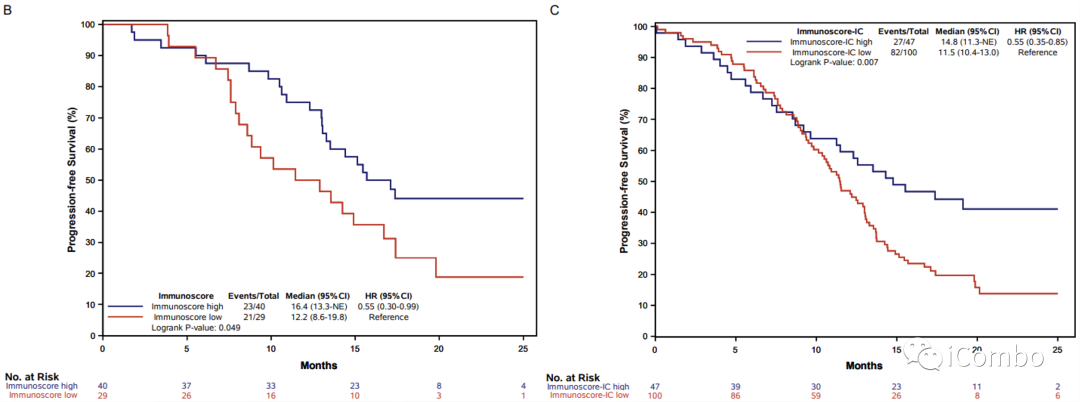
Supplementary Figure 2: Kaplan–Meier curves of progression-free survival according to TILs (panel A), Immunoscore® (panel B), Immunoscore-IC® (panel C) and PD-L1 expression (panel D) in the pMMR population of the AtezoTRIBE study.
在pMMR人群中,高Immunoscore与低Immunoscore之间PFS有统计学差异(16.4 vs 12.2;HR 0.55,95%CI 0.30-0.099);
在pMMR人群中,高Immunoscore-IC与低Immunoscore-IC之间PFS有统计学差异(14.8 vs 11.5;HR 0.55,95%CI 0.35-0.85;p=0.007)。
研究结果
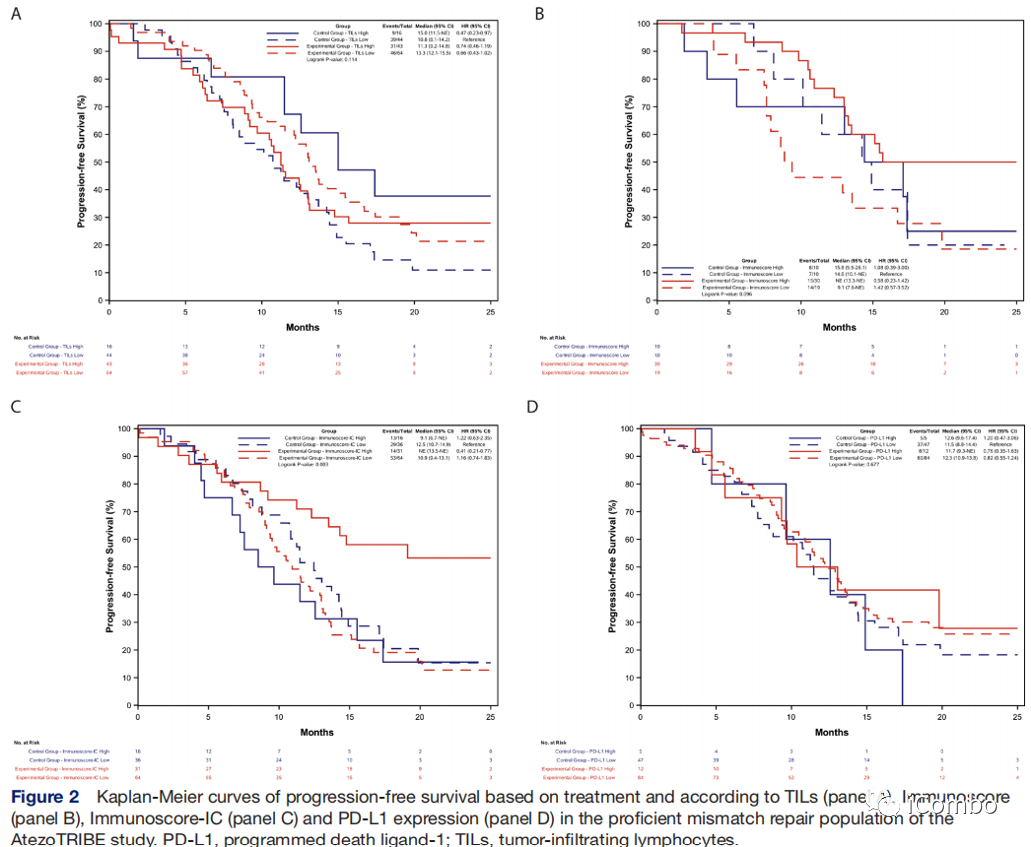
研究组与对照组之间高TILs与低TILs、高Immunoscore与低Immunoscore、高Immunoscore-IC与低Immunoscore-IC、高PD-L1与低PD-L1各亚组之间的PFS无显著差异。
在FOLFOXIRI/bev基础上配合ICIs的获益与PD-L1的表达无关(可能与可评估的病例数偏少有关)
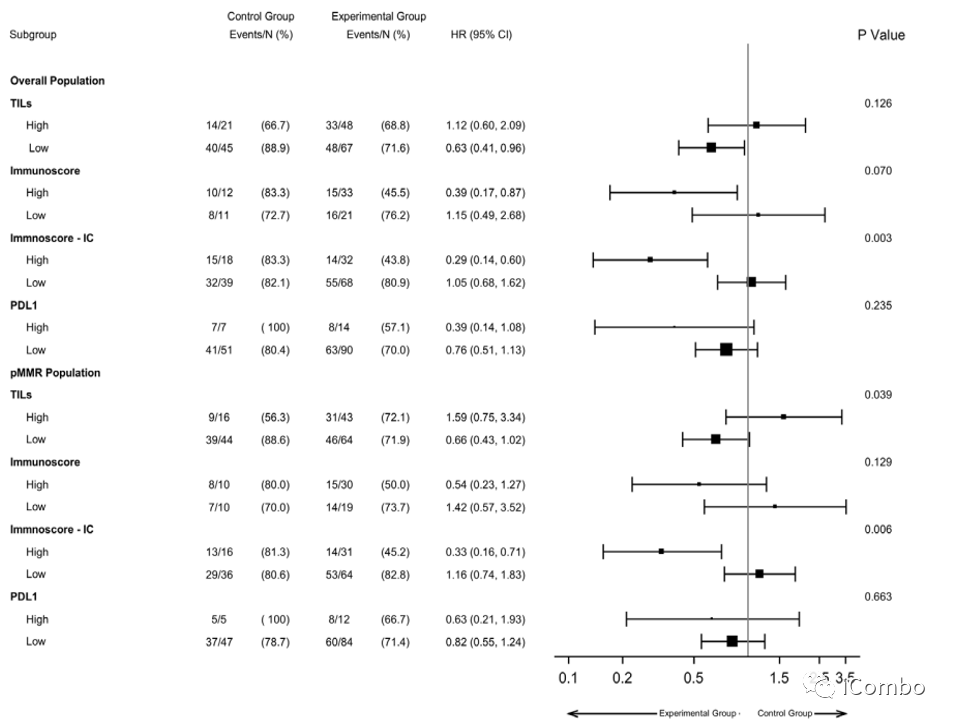
Figure 3 Forest-plot according to TILs, Immunoscore, Immunoscore-IC and PD-L1 expression of progression-free survival in the overall population and in the pMMR subgroup of the AtezoTRIBE study. PD-L1, programmed death ligand-1; TILs, pMMR, proficient mismatch repair; TILs, tumor-infiltrating lymphocytes.
高Immunoscore-IC肿瘤患者配合Atezo治疗显示出更高的PFS优势(p for interaction=0.006)。
在高Immunoscore肿瘤患者中,也观察到FOLFOXIRI/bev/Atezo的获益趋势(p for interaction=0.13)。
四种免疫生物标志物与治疗组在ORR方面无交互作用
研究结果(ORR)
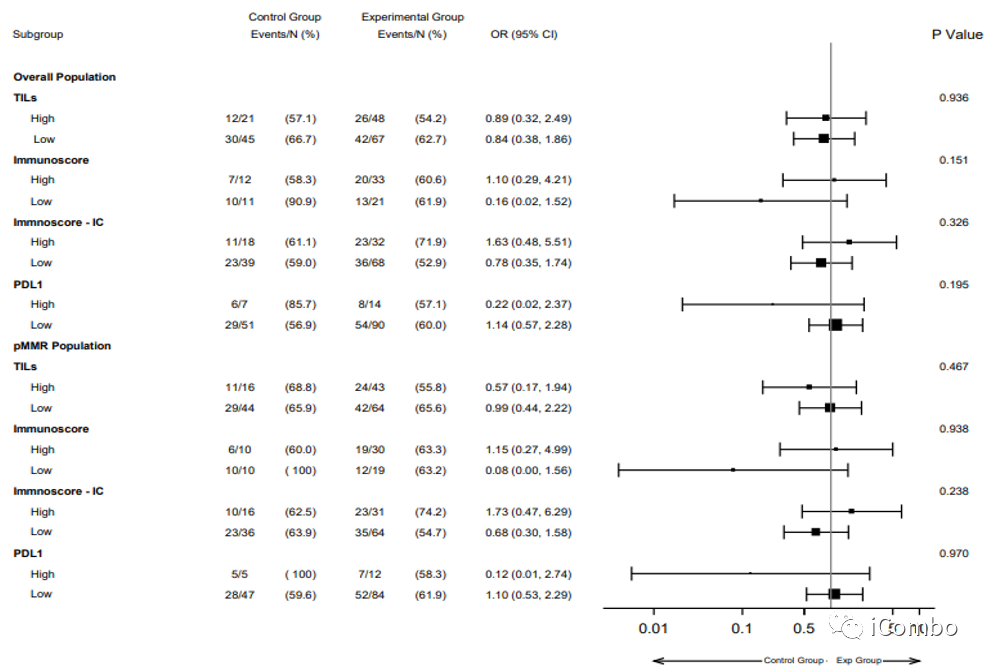
Supplementary Figure 3: Forest-plot according to TILs, Immunoscore®, Immunoscore-IC and PD-L1 expression of ORR in the overall population and in pMMR subgroup of the AtezoTRIBE study.
研究组与对照组之间高TILs与低TILs、高Immunoscore与低Immunoscore、高Immunoscore-IC与低Immunoscore-IC、高PD-L1与低PD-L1各亚组之间的ORR无显著差异。
研究结果(pMMR)
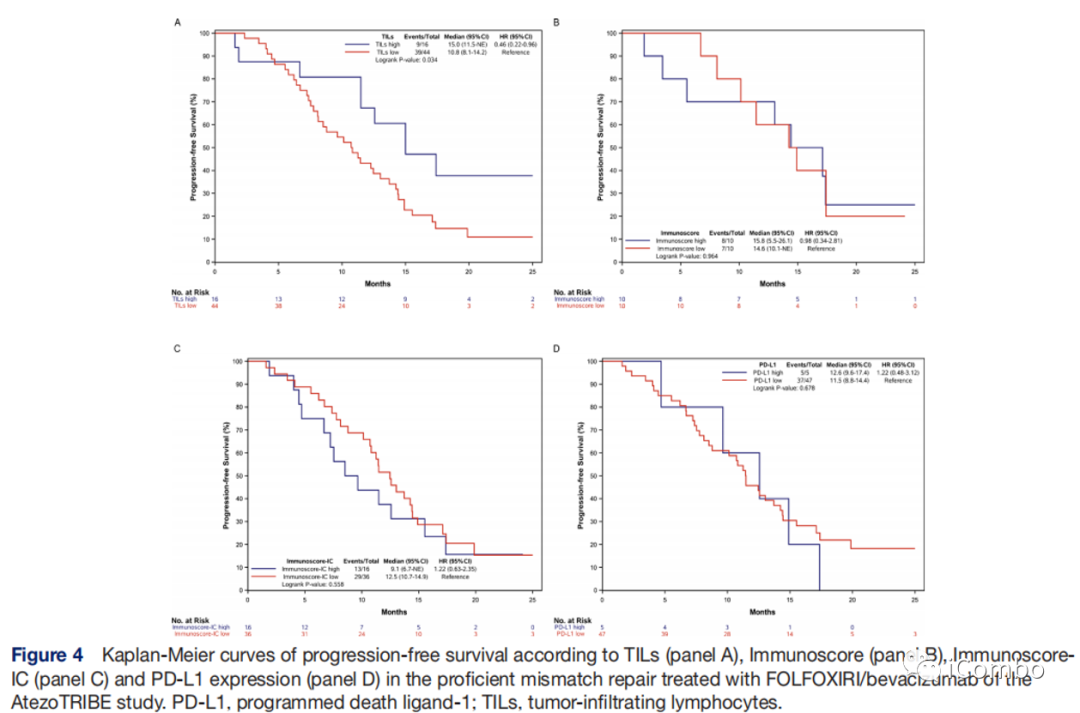
在pMMR人群中,高TILs比低TILs的PFS更长(15.0 vs 10.8个月;HR:0.46,95%CI:0.22-0.96;p=0.034)
Immunoscore、Immunoscore-IC、PD-L1表达亚组没有观察到差异。
研究结果
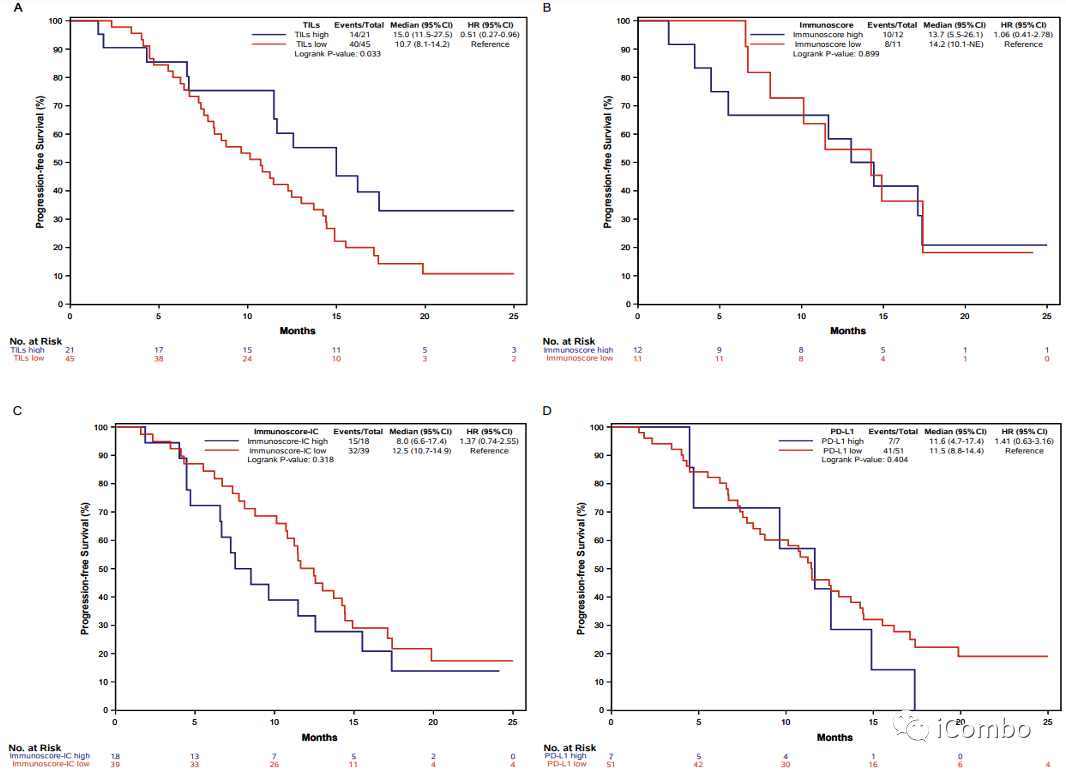
Supplementary Figure 5: Kaplan–Meier curves of progression-free survival according to TILs (panel A), Immunoscore® (panel B), Immunoscore-IC® (panel C) and PD-L1 expression (panel D) in the overall population treated with FOLFOXIRI/bev of the AtezoTRIBE study.
在AtezoTRIBE研究中使用FOLFOXIRI/bev人群中观察到与pMMR组人群一样的情况,高TILs比低TILs获得的PFS更长;Immunoscore、Immunoscore-IC、PD-L1表达亚组没有观察到差异。
研究结果(全人群)
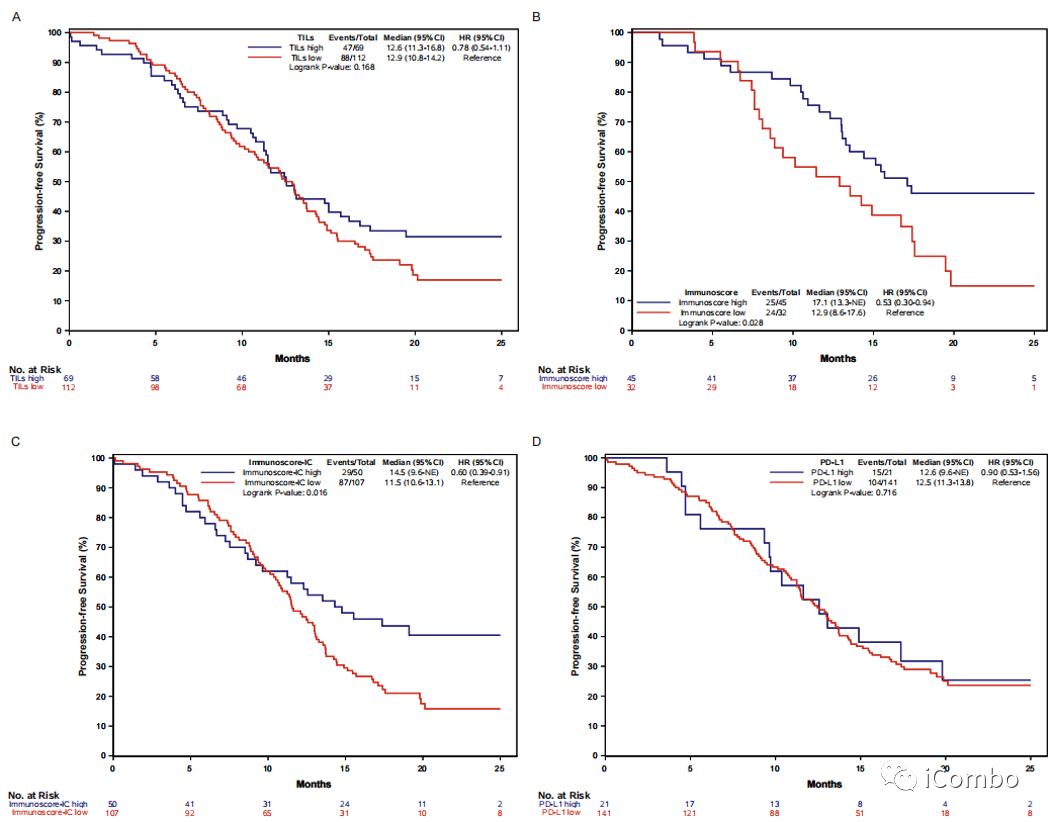
Supplementary Figure 4: Kaplan–Meier curves of progression-free survival according to TILs (panel A), Immunoscore® (panel B), Immunoscore-IC® (panel C) and PD-L1 expression (panel D) in the overall population of the AtezoTRIBE study.
在AtezoTRIBE研究全人群中观察;高Immunoscore、高Immunoscore-IC比低Immunoscore、低Immunoscore-IC获得的PFS更长。
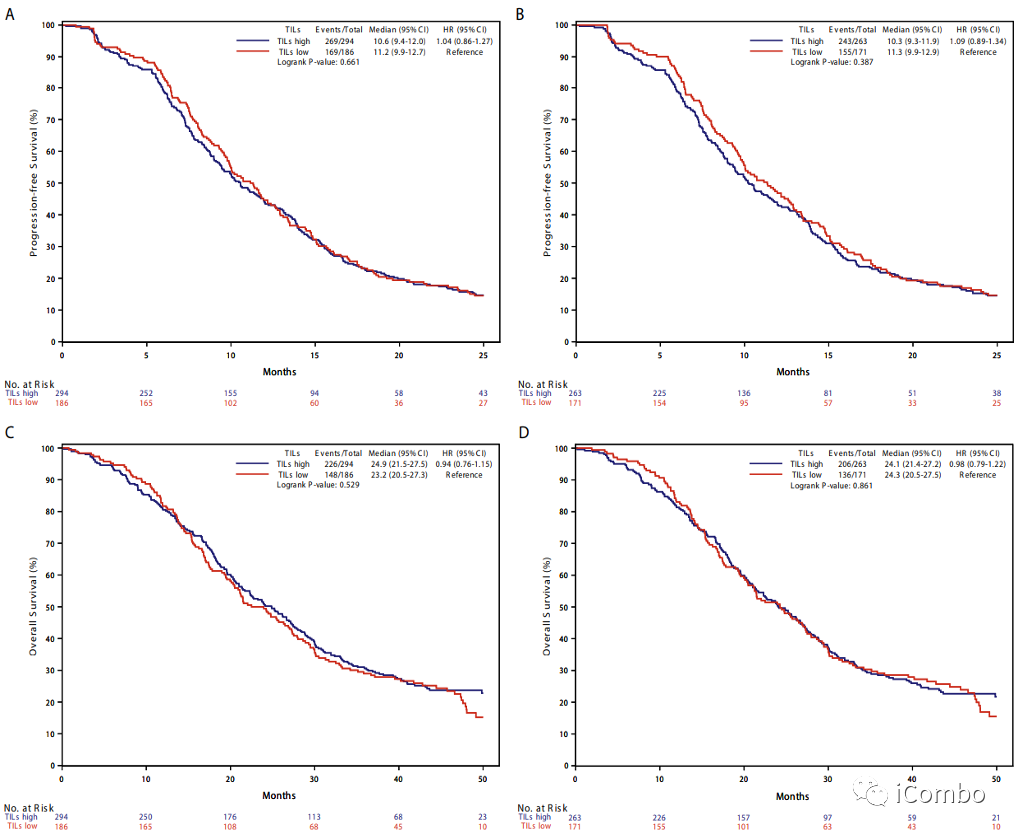
Supplementary Figure 6: Kaplan–Meier curves of progression-free survival and overall survival according to TILs in the overall population (panel A and C) and in the pMMR subgroup (panel B and D) of the TRIBE2 study.
为了验证TILs对预后的影响,作者评估了TRIBE2研究的患者样本。在434例pMMR/MSS肿瘤中,高TILs(N=263,61%)组和低TILs(N=171,39%)组在PFS和OS方面没有观察到差异。
图A与图C为全人群
图B与图D为pMMR人群
结论
采用Immunoscore-IC或Immunoscore对肿瘤免疫细胞浸润程度进行评估,可以识别pMMR mCRC中使用抗PD-L1单抗获益更大的人群。
Immunoscore-IC是预测mCRC配合ICIs获益的最佳预测因子。


