华工/华科合作ACS Nano:三维半导体异质结网络调控能量代谢促进骨再生血管生成
时间:2024-11-15 18:01:05 热度:37.1℃ 作者:网络
血管化不足是骨植入失败的主要原因。管理能量代谢对于实现血管化骨整合至关重要。鉴于骨的半导体特性和半导体异质结的电学特性,华南理工大学宁成云/于鹏&华中科技大学同济医学院附属陈莉莉设计了一种三维半导体异质结网络(3D-NTBH)植入物,目的是调节细胞能量代谢,从而促进血管生成以实现骨再生。三维异质结界面促进电子转移,并在纳米尺度界面建立内部电场。研究发现3D-NTBH显著加速了内皮细胞的糖酵解,从而快速提供能量以支持细胞代谢活动,并最终推动骨组织内的血管生成。分子动力学模拟表明,3D-NTBH有助于暴露纤维连接蛋白的Arg-Gly-Asp肽结合位点,从而调节内皮细胞的糖酵解。进一步的证据表明,3D-NTBH促进了体内早期血管网络的重建和骨再生。这项研究的发现为设计血管化植入物提供了一个有希望的研究视角。该研究题为“Three-Dimensional Semiconductor Network as Regulators of Energy Metabolism Drives Angiogenesis in Bone Regeneration”发表在《ACS Nano》。

方案1描述了三维半导体异质结网络(3D-NTBH)在骨植入表面构建的过程,该网络由单分散的Bi2O3纳米点和TiO2纳米线组成,能够在植入物表面形成具有三维结构分布的内部电场。3D-NTBH通过促进纤维连接蛋白的早期吸附和调节细胞外基质整合素与Arg-Gly-Asp(RGD)肽结合位点的暴露来增强细胞粘附和机械转导信号,加速内皮细胞的糖酵解过程,从而快速提供能量支持细胞代谢活动,并最终促进骨组织内的血管生成和骨整合。因此,3D-NTBH植入物通过调节细胞能量代谢和促进血管生成,为骨缺损治疗提供了一种有效的策略。
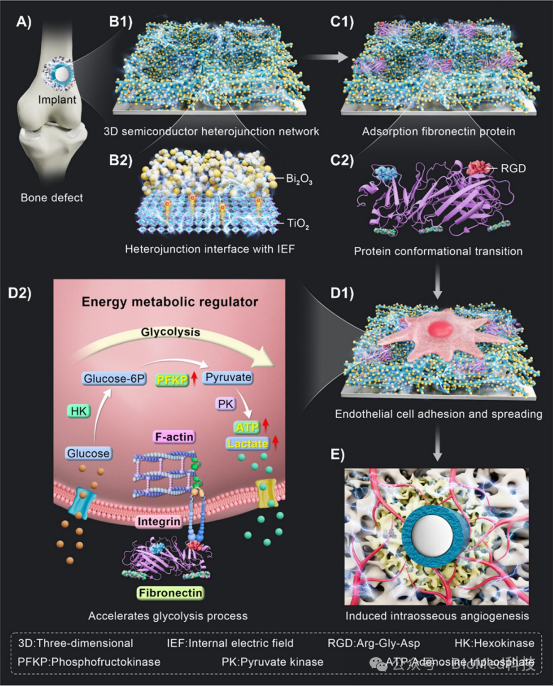
方案1. 3D钛白粉和铋氧化物半导体异质结网络(3D-NTBH)调控细胞能量代谢过程并诱导血管生成和骨整合
【3D-NTBH的构建和表征】
图1展示了三维半导体异质结网络(3D-NTBH)的构建和表征。这些结果证实了3D-NTBH由直径约50纳米、长度约数十微米的TiO2和TiO2/Bi2O3半导体异质结纳米线构成,形成了高度均匀的多级三维结构,且Bi2O3纳米点在TiO2纳米线上实现了原位生长和单点分散。高分辨率TEM图像显示了TiO2和Bi2O3之间的紧密界面接触,形成了三维网络结构。XPS分析进一步证实了Ti、O和Bi元素的存在,表明成功构建了具有三维网络分布的半导体异质结,预期能够在植入物表面实现半导体材料电学性质的空间分布。因此,通过在植入物表面构建半导体异质结,成功模拟了自然骨组织的结构和电学特性,为后续的血管生成和骨整合提供了基础。
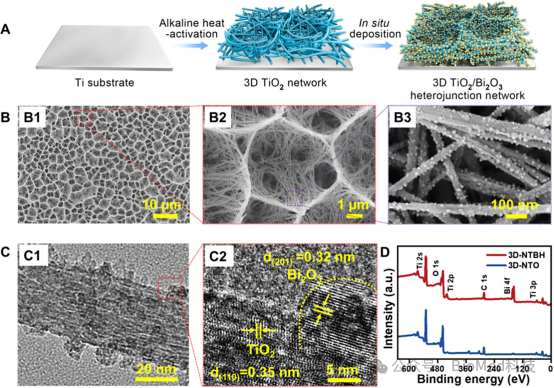
图1. 3D-NTBH的构建和表征
【与3D-NTBH相关的电学性质】
图2探讨了三维半导体异质结网络(3D-NTBH)的电学性质,包括TiO2和Bi2O3的能带结构、态密度、电荷密度分布以及TiO2/Bi2O3异质结界面的内建电场。通过密度泛函理论(DFT)计算,研究了TiO2和Bi2O3的基本结构单元在异质结界面处的电子结构和电荷转移,发现TiO2/Bi2O3异质结具有更密集的电子带结构和态密度,表明界面处电子转移得到促进,形成了内部电场。此外,通过有限元模拟研究了TiO2/Bi2O3异质结界面的内部电场分布,结果与DFT计算结果一致。结论是3D-NTBH不仅在界面处形成了内建电场,而且这种电场在三维网络中具有空间分布,这对于在骨重建过程中解决血管生成问题具有重要意义。
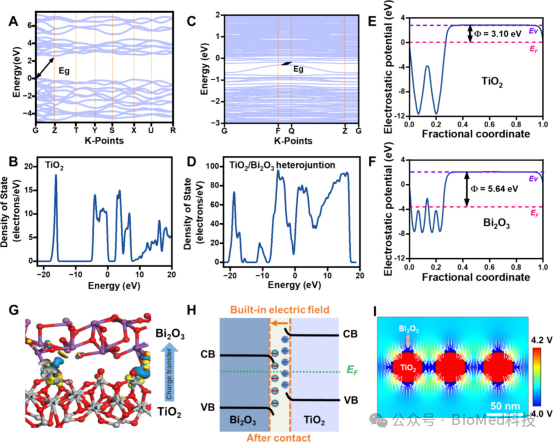
图2.与3D-NTBH相关的电学性质
【评估3D-NTBH介导的HUVECs糖代谢活性】
图3展示了三维半导体异质结网络(3D-NTBH)对人脐静脉内皮细胞(HUVECs)能量代谢影响的实验结果。通过RNA测序分析发现3D-NTBH显著影响了与能量代谢相关的基因表达,特别是糖酵解过程。Seahorse分析显示3D-NTBH显著增加了HUVECs的有氧糖酵解水平,表现为细胞外酸化率(ECAR)的增加。此外,糖酵解过程中的关键限速酶PFKP的荧光强度在3D-NTBH组中上调,同时HUVECs在3D-NTBH上的葡萄糖消耗、丙酮酸和乳酸生成以及ATP产生量均显著增加。结论是3D-NTBH通过增强糖酵解过程,快速提供能量,从而在HUVECs中发挥重要的能量代谢调节作用,特别是促进了糖酵解这一主要的能量供应途径。
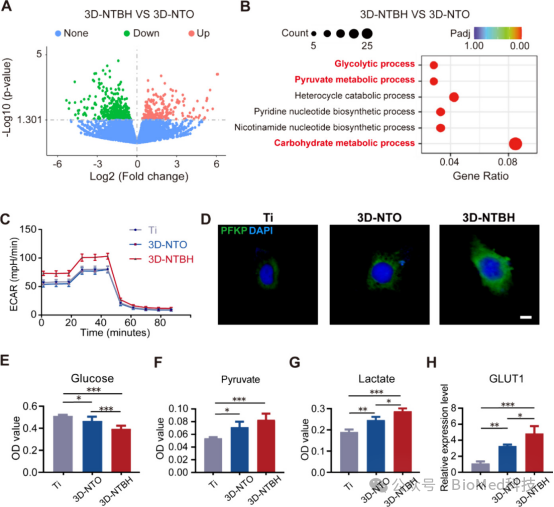
图3.评估3D-NTBH介导的HUVECs糖代谢活性
【3D-NTBH中HUVECs的血管生成行为】
图4展示了三维半导体异质结网络(3D-NTBH)对HUVECs血管生成行为的影响,包括管形成能力、迁移能力和伤口愈合能力的评估。实验结果表明,与3D-NTO和对照组相比,3D-NTBH显著增强了HUVECs的管形成能力,表现为更多的毛细血管样结构形成,以及在Transwell和伤口愈合实验中显示出更高的细胞迁移能力。此外,与血管生成相关的基因标记物(如VEGF、PDGFA和HIF1A)的表达水平在3D-NTBH组中显著上调,且VEGF的荧光强度也有所增加。因此,3D-NTBH通过调节HUVECs的糖酵解过程,增强了血管生成相关基因的表达和细胞的血管生成行为,从而在植入物表面促进了血管生成和骨再生。
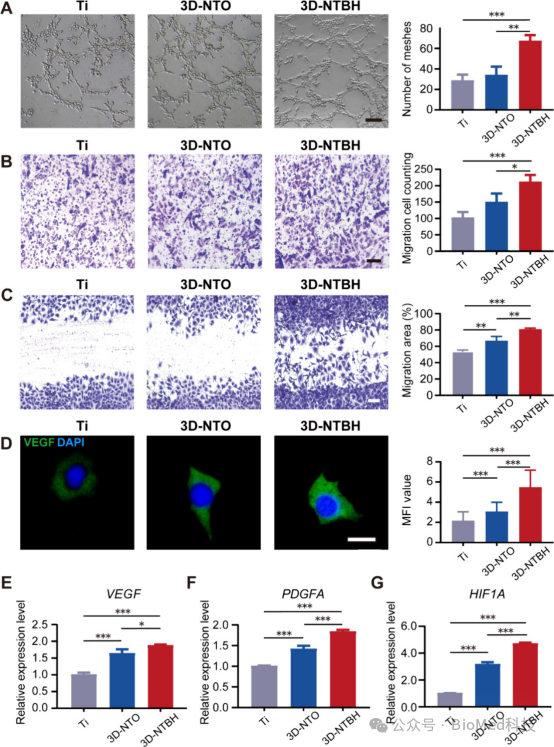
图4. 3D-NTBH中HUVECs的血管生成行为
【验证糖酵解活性在3D-NTBH诱导的血管生成中的核心作用】
图5探讨了3D-NTBH对HUVECs血管生成潜力的影响以及糖酵解活性在其中所起的核心作用。实验通过使用糖酵解抑制剂2-DG来处理HUVECs,发现3D-NTBH诱导的管形成能力、细胞迁移能力和伤口愈合速率的提升效果被显著逆转。这些结果表明,3D-NTBH通过激活葡萄糖代谢,增强了HUVECs的血管生成潜力,而糖酵解活性在3D-NTBH诱导的血管生成中起着关键作用。
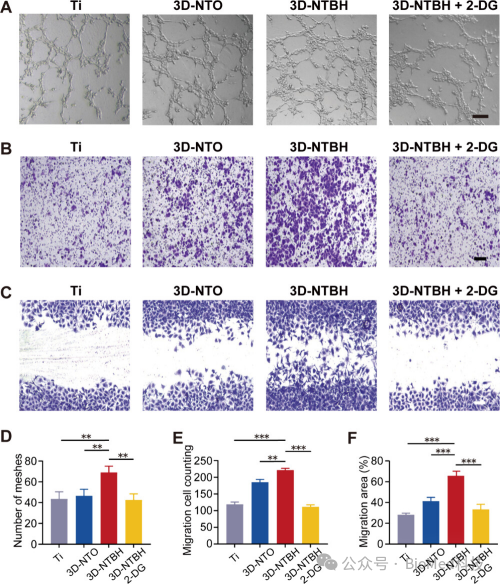
图5. 验证糖酵解活性在3D-NTBH诱导的血管生成中的核心作用
【评估3D-NTBH对FN蛋白吸附和RGD结构域暴露的影响】
图6研究了3D-NTBH对纤维连接蛋白(FN)吸附和细胞粘附以及随后的糖酵解过程的影响。实验结果表明,3D-NTBH表面对FN的吸附能力最强,并且能够增强FN中Arg-Gly-Asp(RGD)肽结合位点的暴露,从而促进细胞粘附和机械转导。通过分子动力学模拟和免疫荧光染色实验,发现3D-NTBH表面与FN的相互作用更强,且RGD与PHSRN之间的距离接近理想结合参数,有利于整合素结合。此外,3D-NTBH还通过增强细胞骨架蛋白的表达和细胞内信号传导,促进了HUVECs的糖酵解活动。结论是3D-NTBH通过调节FN吸附和RGD结构域的暴露,以及随后的细胞粘附和信号传导,加速了HUVECs的糖酵解过程,这对于促进血管生成和骨整合至关重要。
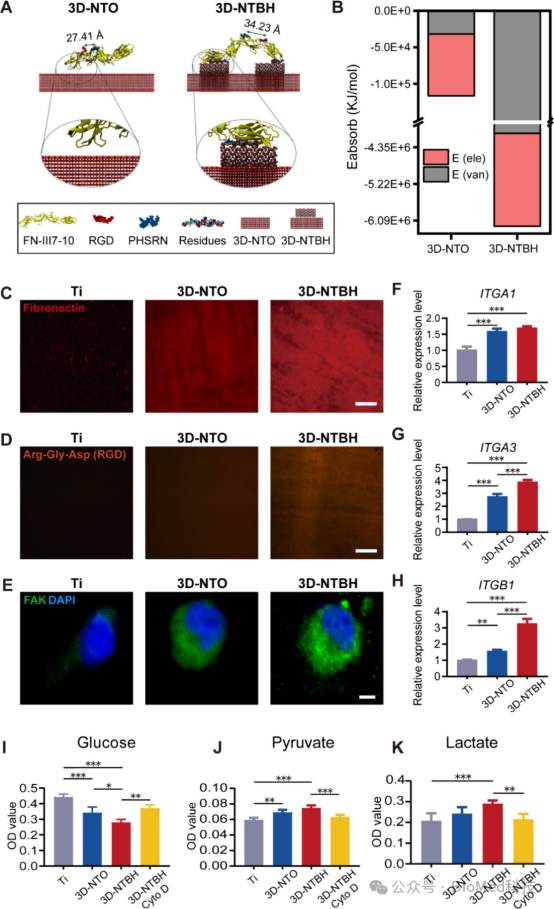
图6. 评估3D-NTBH对FN蛋白吸附和RGD结构域暴露的影响
【评估3D-NTBH植入物在早期体内骨再生中的血管生成】
图7展示了3D-NTBH植入物在体内早期骨再生过程中对血管生成的影响。通过Microfil灌注和微CT扫描技术观察到,与对照组相比,3D-NTBH组在植入物周围形成了更多的微血管和血管结构。免疫组化染色图像显示,在植入后第14天,3D-NTBH组的植入物周围区域有明显的柱状管、拱形结构和新形成的α-SMA阳性血管样结构增加,同时有大量VEGF阳性内皮细胞迁移至3D-NTBH植入物周围的区域。这些结果表明,3D-NTBH植入物能够促进早期植入后的血管生成行为,这对于植入物的成功和最终的骨整合至关重要。
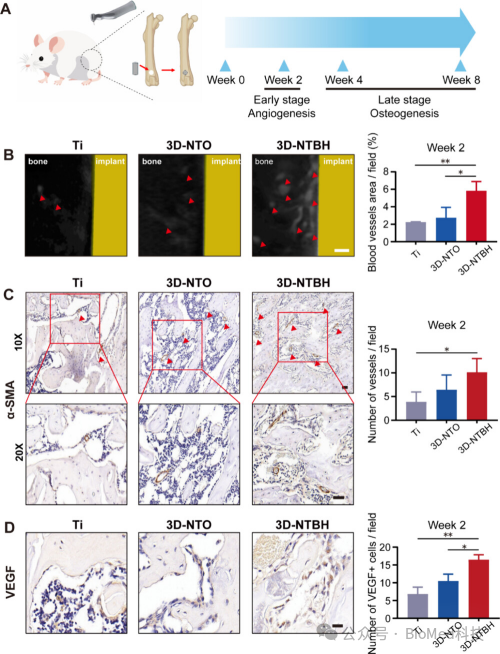
图7. 评估3D-NTBH植入物在早期体内骨再生中的血管生成
【体内评估3D-NTBH的成骨特性】
图8展示了3D-NTBH表面在体内对骨缺损修复能力的评价,通过Micro-CT分析显示3D-NTBH处理的植入物周围形成了连续且丰富的骨质,并且随着时间的推移,骨质和骨密度显著增加。组织学分析进一步揭示3D-NTBH组具有最大数量的新形成的骨组织,呈现出平坦、连续的结构以及最高的新骨厚度。Masson三色染色显示3D-NTBH组植入物周围沉积了大量的胶原蛋白。此外,OCN阳性成骨细胞的数量在3D-NTBH植入物周围也是最多的,表明其具有潜在的修复能力。这些结果共同支持了3D-NTBH植入物通过介导早期血管生成在促进新骨生成和骨整合中的关键作用。因此,3D-NTBH表面能够显著促进骨缺损的修复,增强新骨的形成和骨密度,从而提高了骨整合的效率和效果。
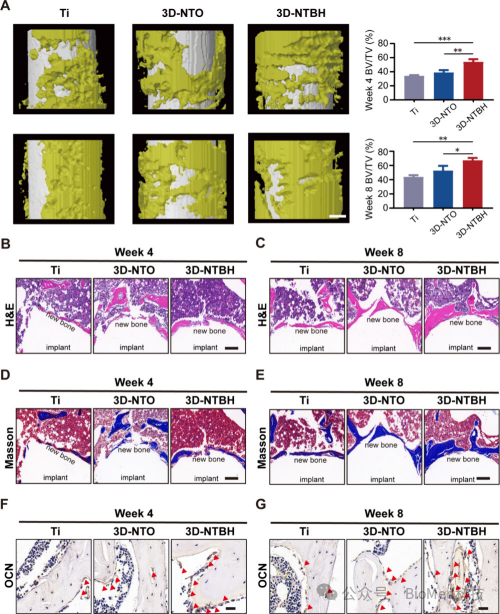
图8. 体内评估3D-NTBH的成骨特性
【小结】
该研究通过自组装三维结构和半导体异质结产生空间分布的内建电场,可以有效模拟血管周围骨微环境,为血管修复提供关键的生化线索,其中3D-NTBH显著增强了纤维连接蛋白的吸附和RGD序列的暴露,增强了细胞粘附和机械转导,此外,三维半导体异质结能加速糖酵解过程,从而快速提供能量,促进葡萄糖代谢重编程过程,加速早期血管生成和骨组织再生,揭示了利用功能半导体材料作为调节工具促进血管再生的潜在途径,为未来的临床应用和组织工程提供了理论基础和技术平台。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c09971


