BRAF、RAS和NF1“三重”野生型IV期黑色素瘤一线免疫治疗疗效如何?
时间:2024-11-11 17:00:18 热度:37.1℃ 作者:网络
没有 BRAF、NRAS 和 NF1 突变的黑色素瘤通常被称为“三重野生型(tWT)黑色素瘤”,占所有黑色素瘤的 5-10%,其临床特征和对治疗的反应仍不明确。本研究探索了迄今为止最大的多中心 tWT 黑色素瘤队列。DeCOG 前瞻性多中心研究 ADOREG/TRIM 的 3109 例黑色素瘤组织样本进行了 TERT 启动子和 29 个黑色素瘤相关基因靶向 NGS 测序,揭示了 292 例 tWT 黑色素瘤患者。分析临床特征和突变模式。此外,对 141 例接受抗 CTLA4 加抗 PD1 联合疗法或抗 PD1 单一疗法作为一线治疗的 AJCC IV 期 tWT 黑色素瘤患者进行亚组分析。包括 184 例皮肤黑色素瘤患者、56 例黏膜黑色素瘤患者、34 例肢端黑色素瘤患者和 18 例原发灶不明黑色素瘤(MUP)患者。33.2% 的 tWT 黑色素瘤携带 TERT 启动子突变,70.5% 的 tWT 黑色素瘤携带少于三个突变。对于 141 例 IV 期疾病患者,一线抗 CTLA4 加抗 PD1 联合疗法的 mPFS 为 6.2 个月(95% CI:4-9),mOS 为 24.8 个月(95% CI:14.2-53.4),无论黑色素瘤类型如何;一线抗 PD1 单一疗法的 mPFS 为 4 个月(95% CI:2.9-8.5),mOS 为 29.18 个月(95% CI:17.5-46.2)。已知的预后因素(如 TERT 启动子突变和 TMB)在接受抗 CTLA4 加抗 PD1 联合疗法或抗 PD1 单一疗法作为一线治疗的患者中分布相等,这两种疗法中没有哪种的 mPFS 或 mOS 较长。这两种疗法的 mPFS 和 mOS 均显著短于已知癌基因突变的黑色素瘤报告的数据。
研究背景
恶性黑色素瘤发生远处转移的潜能很高,是最具侵袭性的癌症之一,全球发病率不断上升。黑色素瘤通常起源于皮肤黑色素细胞,但也可能发生于黏膜和肢端部位,或者没有已知的原发性肿瘤(原发灶不明黑色素瘤,MUP)。
分子分析揭示了这种异质性肿瘤的基因图谱。根据最常见的基因变异,黑色素瘤通常分为 BRAF(∼50%),RAS(∼25%)或 NF1(∼15%)突变型或这三种突变均不存在(“三重野生型”,tWT)(∼5-10%)。这些突变(例如 BRAF V600 密码子突变)直接激活 MAPK 通路或阻碍抑制因子的下调,从而间接激活 MAPK 通路。除了这些癌基因激活突变外,在高达 71% 的黑色素瘤中还发现了 TERT(端粒酶逆转录酶)基因启动子区域的三种不同突变中的至少一种,因此是黑色素瘤中最常见的突变。
皮肤、黏膜、肢端黑色素瘤和 MUP 的不同突变模式与不同的病因和不同的临床特征相关:BRAF V600E/K 突变黑色素瘤常见于较年轻患者,NF1 突变黑色素瘤常见于较年长患者。黑色素瘤中 TERT 启动子突变(“pTERT”)的发生因解剖部位(肢端黑色素瘤(19%)vs.皮肤黑色素瘤(48%))和UV暴露而异。黑色素瘤中 TERT 启动子突变的存在与不良预后相关。日光暴露被认为会增加皮肤黑色素瘤和总体较多突变的风险,而其他黑色素瘤,特别是黏膜黑色素瘤,其发生与日光暴露无关。基因组结构变异在非/低日光暴露的肢端和黏膜黑色素瘤中更为常见。由于这些不同的起源解剖部位和突变特征,术语黑色素瘤被认为包括具有不同生物学的肿瘤。
目前晚期黑色素瘤患者的治疗方法包括酪氨酸激酶抑制剂(TKI)和免疫检查点抑制剂(ICI)。由于常规化疗缓解率较低,近年来已较少应用。TKI 靶向 MAPK 通路,是携带 BRAF 突变的局部晚期或转移性黑色素瘤患者的一种治疗选择。ICI 包括靶向程序性细胞死亡 1 及其配体(PD-1 / PD-L1)或细胞毒性 T 淋巴细胞抗原 4(CTLA-4)的抑制剂,通过激活宿主免疫系统导致黑色素瘤细胞被破坏。抗 CTLA4 加抗 PD1 联合疗法或抗 PD1 单一疗法都是获批的全身疗法,显著改善晚期黑色素瘤患者的结局。
黑色素瘤的突变模式被认为会影响对全身治疗的反应。高突变负荷与更好和更持久的治疗反应有关。然而,作为选定组,tWT 黑色素瘤对全身治疗的反应仍未得到更详细的评估。
本研究纳入了最大的多中心 tWT 黑色素瘤队列,以进一步表征这种罕见的肿瘤亚型,评估对已确立的免疫疗法的反应。
研究结果
患者特征
筛查了 3109 份组织学确诊皮肤、黏膜或原发灶不明黑色素瘤患者的肿瘤组织样本的 NGS 报告,这些患者来自来自德国埃森大学医院或其他参与皮肤病学合作肿瘤学组(DeCOG)前瞻性转化研究黑色素瘤组织登记处(ADOREG-TRIM)的德国大学医院,识别了 292 例在 2014 年至 2021 年期间首次诊断为黑色素瘤的三重野生型黑色素瘤患者。未发现以下突变的黑色素瘤被归类为三重野生型(tWT):BRAF T599、V600 或 K601,NRAS、HRAS 和 KRAS Q61、G12、G13,以及任何 NF1 突变。分析共纳入 292 例没有 BRAF、NRAS 和 NF1 这三个致癌基因突变(“三重野生型”,tWT)的黑色素瘤患者(表 1)。首次诊断黑色素瘤的中位年龄为 63.8 岁,52.1% 的患者小于 65 岁,46.6% 的患者为女性。首次诊断后整个队列的中位随访时间为 38.4 个月(范围 2.5 个月至 7.4 年)。样本包括以下四种“黑色素瘤类型”:184 例皮肤黑色素瘤、56 例黏膜黑色素瘤、34 例肢端黑色素瘤和 18 例原发灶不明黑色素瘤(MUP)。在我们的队列中,肢端黑色素瘤患者往往是首次诊断年龄最大的。黑色素瘤类型和性别存在显著相关性(p = 0.0003),黏膜黑色素瘤包含大量阴道黑色素瘤(n = 21)。
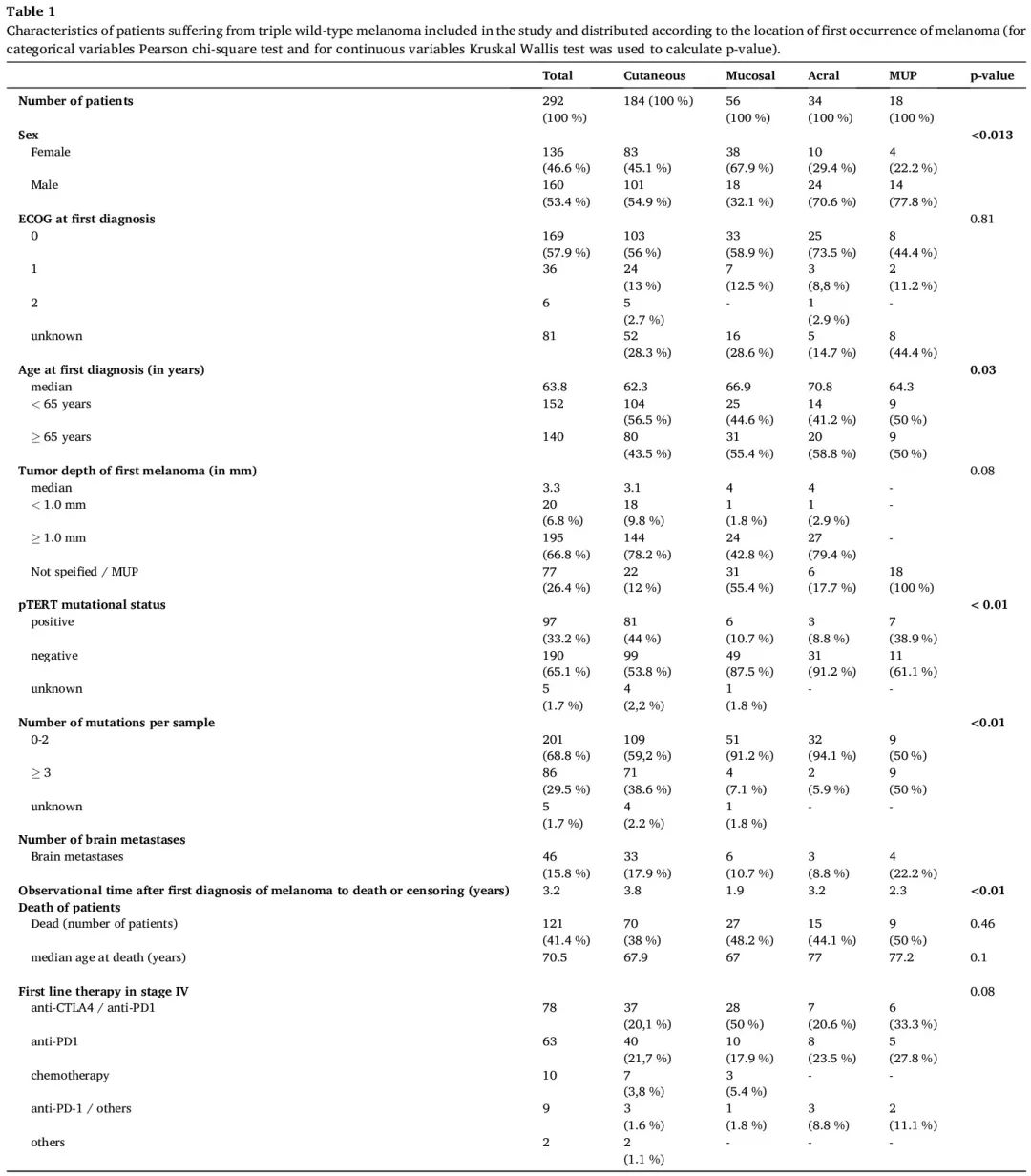
表1
皮肤tWT黑色素瘤和tWT-MUP比肢端和黏膜tWT黑色素瘤携带更多的突变
在 3109 例黑色素瘤样本中,除了三个致癌基因(BRAF、NRAS、NF1)外,分析了另外 26 个基因和 TERT 启动子。对于纳入的 292 例患者,发现每例黑色素瘤样本的突变数量与黑色素瘤类型存在显著相关性(p < 0.0001)。与 5.9% 的肢端和 7.1% 的黏膜 tWT 黑色素瘤样本相比,38.6% 的皮肤 tWT 黑色素瘤样本和 50% 的 tWT-MUP 样本携带超过 2 个突变。TERT 启动子突变(“pTERT”)是我们队列中最常见的突变(图 1),44% 的皮肤黑色素瘤、38.9% 的 MUP、8.8% 的肢端黑色素瘤和 10.7% 的黏膜黑色素瘤携带至少一种 pTERT 突变(表 1)。未发现黑色素瘤类型与某种突变或特定突变模式存在显著相关性。尽管如此,根据百分比,一些突变在某些黑色素瘤类型中更常见(例如 KIT 更常见于肢端和黏膜黑色素瘤)。
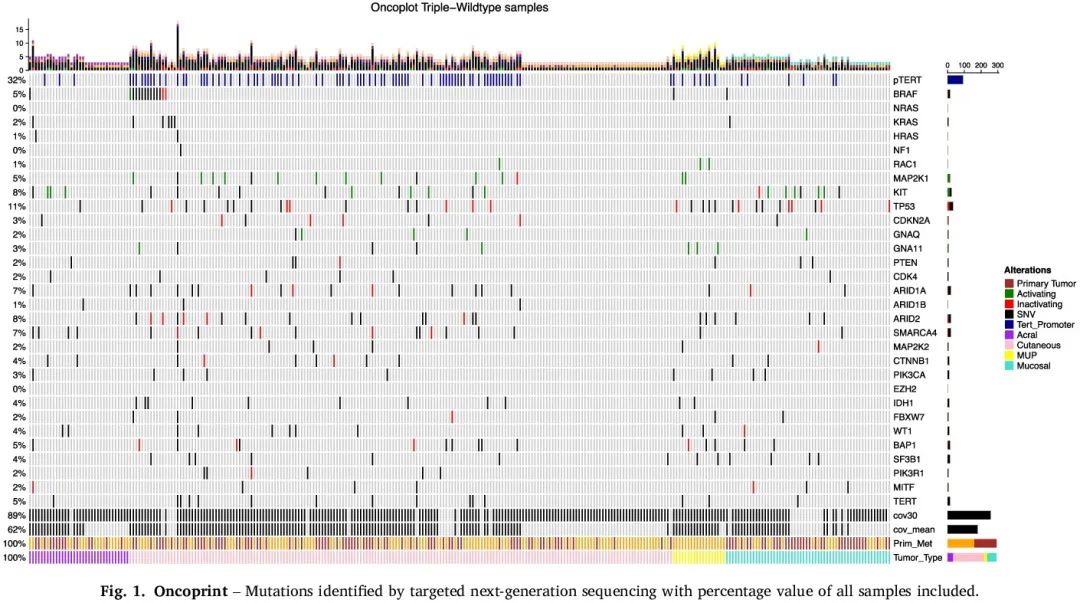
图1
患者特征与选择免疫疗法作为IV期一线治疗的相关性
免疫疗法(抗 CTLA 4 / 抗 PD1 联合疗法或抗 PD1 单一疗法)是我们队列中最常用的 IV 期一线治疗(141/292)。除了这两种免疫疗法外,一些患者接受了抗 PD1 疗法和额外药物(例如 LAG3)、化疗或其他全身药物(例如 LAG3 单一疗法)作为一线治疗(表 1)。黑色素瘤类型或基本患者特征与两种免疫疗法的选择没有额外的显著相关性。接受抗 CTLA 4 / 抗 PD1 联合疗法作为一线治疗的患者往往更年轻(表 2)。
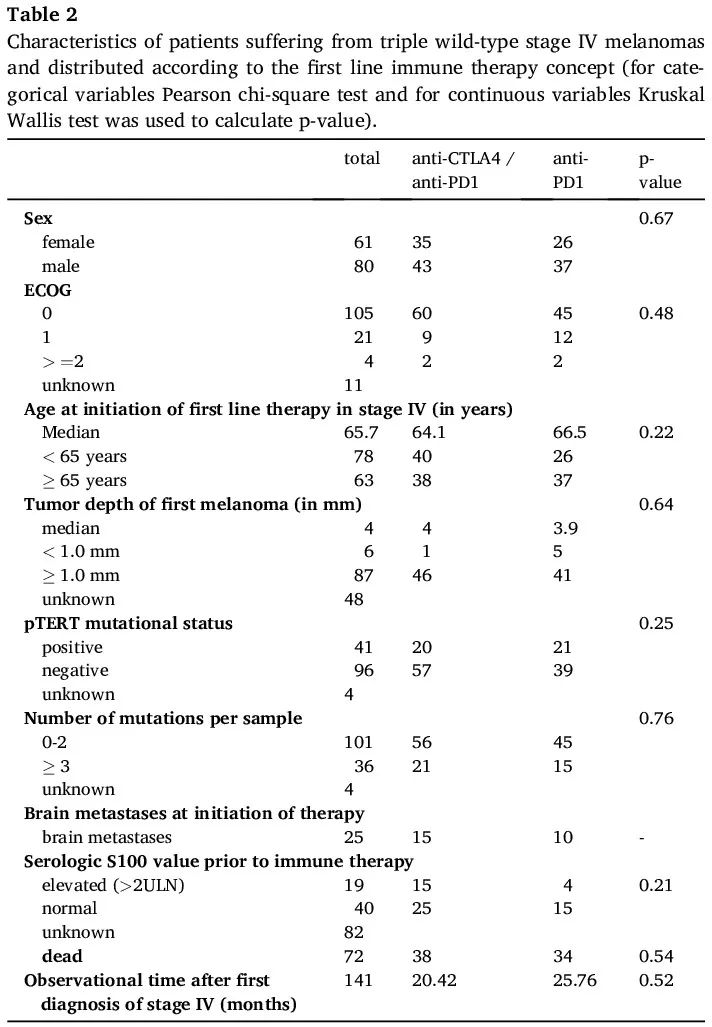
表2
21 例患者接受了化疗(n = 10)、抗 PD1 联合额外的全身疗法(“抗 PD1/其他”)(n = 9)或其他疗法(非进一步分类的研究药物)作为 IV 期一线治疗(表1)。在接受化疗的 10 例患者中,7 例患者原发肿瘤为皮肤黑色素瘤,3 例为黏膜黑色素瘤,IV 期患者年龄为 23.8 – 82 岁(女性患者n = 5,男性患者n = 5)。这些患者接受了达卡巴嗪(DTIC,n = 5)、达卡巴嗪和顺铂(n = 1)、紫杉醇(n = 2)或未进一步记录的多药化疗(n = 2)。这些疗法的缓解率为 8%,mPFS 为 3.6 个月(95% CI:0.5 – 28.3),mOS 为 4.9 个月(95% CI:0.8-66)。接受抗 PD1/其他作为一线治疗的 9 例患者包括 3 例皮肤黑色素瘤,3 例肢端黑色素瘤,1 例黏膜黑色素瘤和 2 例 MUP。与抗 PD1 一线治疗联用的全身疗法包括 LAG3 抑制剂(n = 4)、CD137 抑制剂(n = 1)、针对 IDO 的免疫调节疫苗(n = 2)、酪氨酸激酶抑制剂(n = 1)和 DTIC(n = 1)。在接受抗 PD1 /抗 LAG3 作为一线治疗治疗的患者中,缓解率为 17%,mPFS 为 4.7 个月(95% CI:3 - 未达到),mOS 为 19.6 个月(95% CI:10.4 - 未达到)。
IV期tWT 黑色素瘤患者两种一线免疫疗法的mPFS和mOS无显著差异
141/292 例患者接受了两种免疫疗法(抗 CTLA 4/抗 PD1 联合疗法或抗 PD1 单一疗法)中的一种作为 IV 期一线治疗。在这 141 例患者中,68 例患者(48.2%)接受了至少一种后续全身治疗。根据作为 IV 期一线治疗的免疫疗法类型,可以观察到中位无进展生存期(mPFS)和中位总生存期(mOS)的细微差异。抗 CTLA4/抗 PD1 联合疗法的 mPFS 为 6.2 个月(95% 置信区间(CI):4-9),1 年、2 年和 5 年 PFS 率分别为 28.3%(95%CI:18.2-39.5)、20.7%(95%CI:11.6-31.7)和 9.2%(95%CI:1.2-27.9)。抗 PD1 单一疗法的 mPFS 为 4 个月(95% CI:2.9-8.5),1 年、2 年和 5 年 PFS 率分别为 33.9%(95% CI:22.1-46)、24.7%(95% CI:13.9-36.)和 24.7%(95% CI:13.9-36)。在每种黑色素瘤类型中,使用联合疗法作为 IV 期一线治疗的 mPFS 往往长于抗 PD1 单一疗法,只有黏膜黑色素瘤一线抗 PD1 单一疗法的 mPFS 长于联合疗法(表3)。抗 PD1 单一疗法的中位总生存期(mOS)(29.2 个月(95% CI:17.5-46.2))长于联合疗法(24.8 个月(95% CI:15.2-53.4))。抗 PD1 单一疗法的 1 年、2 年和 5 年 OS 率分别为 74%(95% CI:60.2–83.3)、50.8%(95% CI:36.4–63)和 28.2%(95% CI:25.8–53.4),联合疗法的 1 年、2 年和 5 年 OS 率分别为 72.7%(95% CI:59.2–80.2)、53.3%(95% CI:40.6–64.5)和 31.9%(95% CI:15.4–49.8)(表 3)。
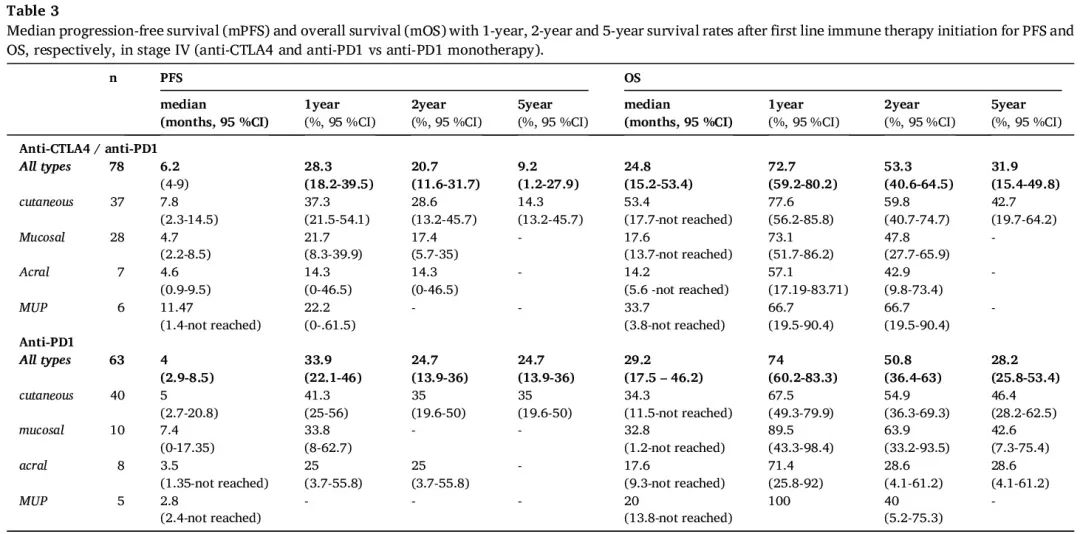
表3
为了进一步阐明两种一线免疫疗法的影响,我们还根据免疫疗法(图 2a),以及黑色素瘤类型、肿瘤突变负荷和 TERT 启动子突变的存在进行了 mPFS 和 mOS Kaplan-Meier 分析(图 2b)。两种一线免疫疗法的 mPFS 或 mOS 没有显著差异。在携带两个以上突变的黑色素瘤队列中,mPFS 较长(p = 0.02)。在两种一线免疫疗法中,均未发现特定突变模式或某种突变与较长的 mPFS 或 mOS 相关。两种免疫疗法的 mPFS 或 mOS 没有显著差异。
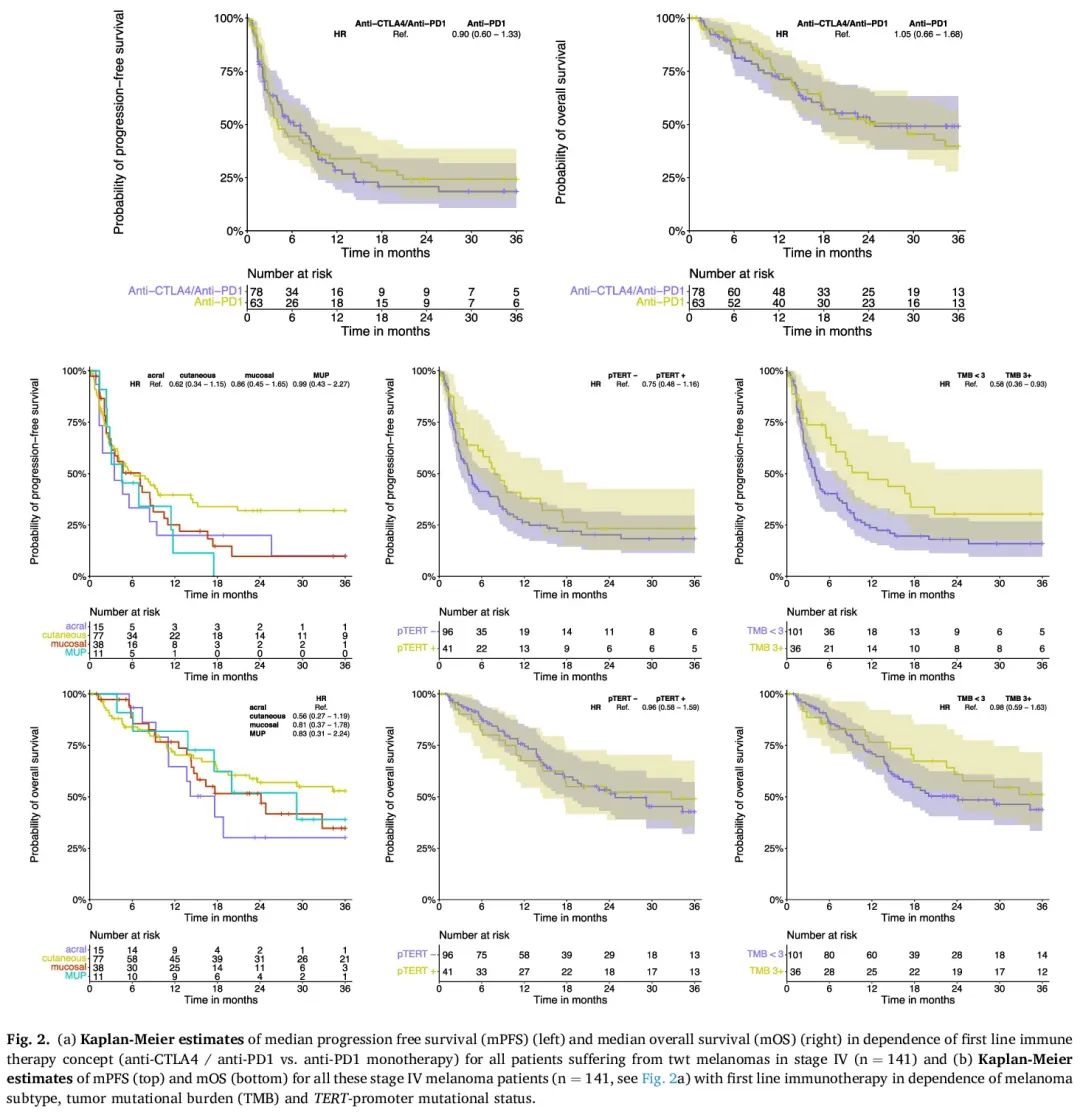
图2
在单变量 COX 回归中还分析了患者特征(例如肢端黑色素瘤组的高龄)对 mPFS 和 mOS 的影响。我们发现在接受抗 PD1 单一疗法作为 IV 期一线治疗的患者中,肿瘤突变负荷与 mPFS 相关。此外,在接受联合免疫疗法作为 IV 期一线治疗的黑色素瘤患者队列中,治疗开始前较高的 S-100 水平(至少是上限值的两倍)、患者性别、IV 期一线治疗开始时的年龄和 ECOG 评分与 mOS 相关(表4)。
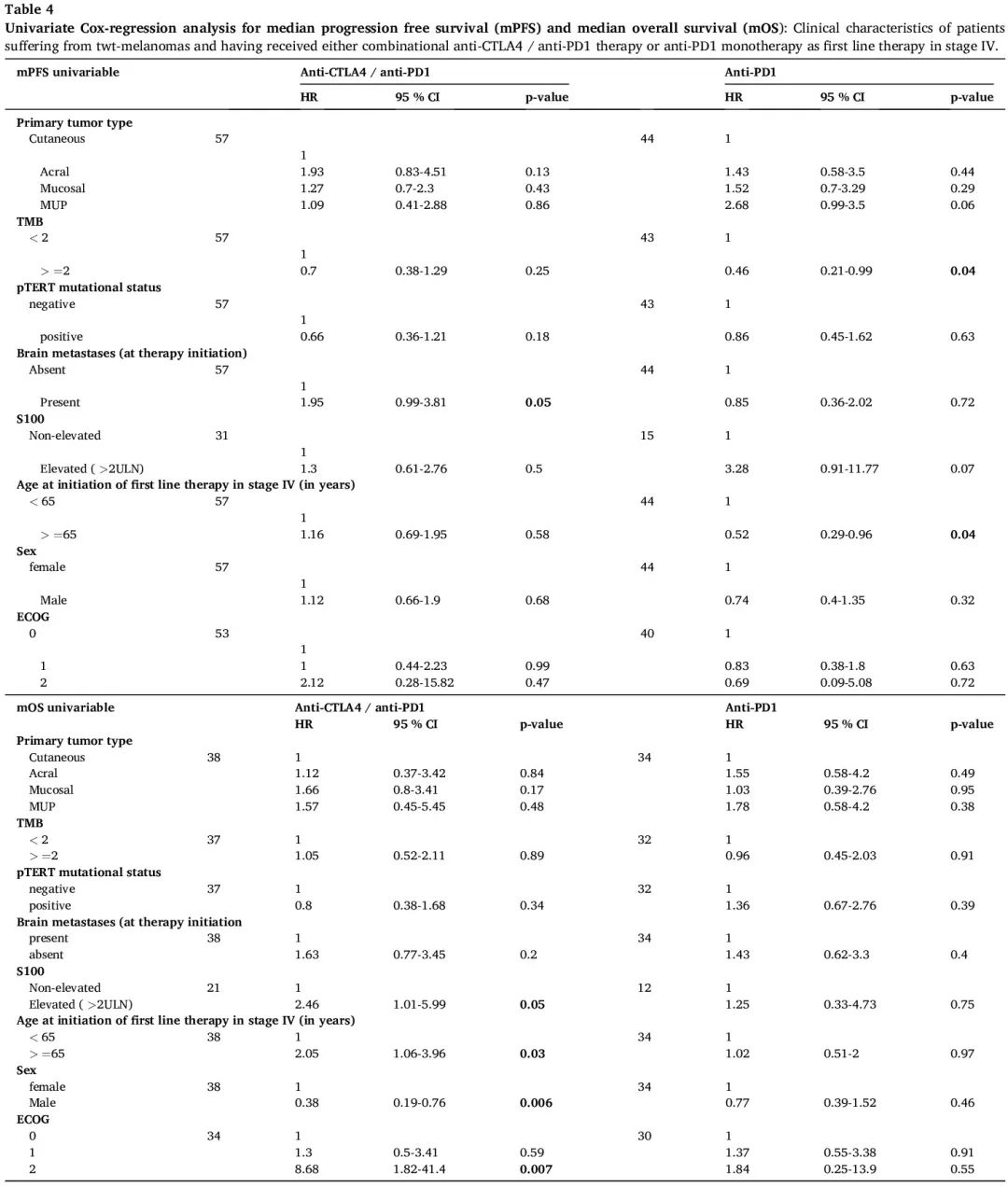
表4
讨 论
据我们所知,本研究报告了迄今为止最大的“三重野生型”(tWT)黑色素瘤队列,包括四个不同原发部位的色素瘤。在我们的研究中,皮肤 tWT 黑色素瘤和 tWT-MUP 比肢端和黏膜 tWT 黑色素瘤携带更多的突变,但未发现黑色素瘤类型与某种突变或特定突变模式的显著相关性。对于接受免疫治疗的 IV 期患者,抗 CTLA4 加抗 PD1 联合疗法和抗 PD1 单一疗法的 mPFS 或 mOS 没有显著差异。
黑色素瘤被认为是突变负荷最高的肿瘤之一,超过 50% 的黑色素瘤携带至少一种 BRAF 突变。如前所述,通常将黑色素瘤分为不同的组,包括携带 BRAF(∼50%)、RAS(∼25%)或NF1(∼15%)突变或这三种突变均不存在(“三重野生型”,tWT)(∼5-10%)。对于 tWT 黑色素瘤,GNAQ、GNA11、KIT、CTNNB1 或 EZH2 和 MDM2 扩增是假定的驱动突变。据描述,tWT 黑色素瘤携带较少的 UV 诱导的突变。
由于 tWT 黑色素瘤可能存在目前未知的驱动突变,我们探索了突变模式和每个样本的突变总数,两者均额外按黑色素瘤类型细分。未发现导致 tWT 黑色素瘤肿瘤发生的关键致癌基因突变,可能是由于我们队列中样本量少。关于先前描述为皮肤黑色素瘤中最常见突变之一的 TERT 启动子突变,在我们的队列中,其在皮肤 tWT-黑色素瘤和 tWT-MUP 中发生率较高,在肢端和黏膜 tWT-黑色素瘤中发生率较低。TERT 启动子区域突变可能是UV诱导的,但在非UV诱导的肿瘤(如胶质瘤)中也较为常见。
文献数据显示,黏膜和肢端黑色素瘤的突变总数较低,而皮肤黑色素瘤和 MUP 的突变总数往往较高。相应地,在我们队列中,每个样本的突变总数(“肿瘤突变负荷”,TMB)因黑色素瘤类型而异,50% 的 MUP、38.6% 的皮肤、5.9% 的肢端和 7.1% 的黏膜 tWT 黑色素瘤样本携带至少 3 种突变。
目前,所有 IV 期黑色素瘤患者都适合接受免疫治疗,包括抗 CTLA4 / 抗 PD1 联合疗法或抗 PD1 单一疗法,无论突变模式和黑色素瘤类型如何。在 Checkmate 076 中,无论突变模式的黑色素瘤的中位无进展生存期(mPFS)在一线抗 CTLA4/抗 PD1 疗法后为 11.5 个月(95% CI:8.7 - 19.3),在抗 PD1 单一疗法后 6.9 个月(95% CI,5.1 至 10.2),5 年 PFS 率分别为 36% 和 29%。在我们的队列中,mPFS 在抗 CTLA4 / 抗 PD1 疗法后为 6.2 个月(95% CI:4-9),在抗 PD1 单一疗法后为 4 个月(95% CI 2.9-8.5),5 年 PFS 率分别为 9.2% 和 24.7%(13.9-36)。在 Checkmate 076 中,晚期黑色素瘤患者一线抗 CTLA4/抗 PD1(72.1个月)的中位总生存期(mOS)长于一线抗 PD1(36.9 个月,95% CI:28.2 - 58.7),5 年OS率分别为 52% 和 44%。在我们的队列中,一线抗 CTLA4/抗 PD1 后 mOS 为 24.8 个月(95% CI:15.2-53.4),抗 PD1 单一疗法后为 29.2 个月(95% CI:17.5 – 46.2),5 年OS率分别为 31.9%(95% CI:15.4-49.8)和 28.24%(25.8-53.4)。我们 tWT 黑色素瘤队列的 mPFS 和 mOS 均比文献中报道的(例如 checkmate 076)短得多,无论突变状态如何。
由于与文献中描述的相比,mPFS 和 mOS 较短,无论采用哪种免疫疗法,我们评估了 mPFS 和 mOS 与黑色素瘤类型的相关性。在我们的队列中,接受抗 CTLA4/抗 PD1 疗法作为一线治疗的患者中有 47.4% 患有皮肤黑色素瘤,35.9% 患有黏膜黑色素瘤。仅关注我们队列中最大的亚组,即皮肤黑色素瘤患者,我们仍发现 mPFS(7.8 个月(95% CI:2.3-14.5))和 mOS(53.4 个月(95% CI:7.7- UCI未达到)都短于 Checkmate 076 报告的数据。尽管由于我们队列中的亚组规模较小,计算的 mPFS 和 mOS 的有效性可能受到限制,但我们观察到,黏膜和肢端黑色素瘤往往对免疫治疗反应不佳,例如,我们队列中 tWT 肢端黑色素瘤的 mPFS 与文献报道的 PFS 类似(抗 CTLA4/抗 PD1 后 5.4 个月(95% CI,3.4 至 11.7),抗 PD-1 后 4.1 个月(95% CI 3.7 至 5.9))。另一项研究表明,不同突变模式的黏膜黑色素瘤对免疫疗法表现出不同的反应,这可能导致我们研究中的高度差异。我们的研究包括大量阴道黑色素瘤(n = 21)。由于接受抗 PD1 单一疗法作为一线治疗的黏膜黑色素瘤亚组的人数较少,我们预计该亚组描述的较长 mPFS 是偶然的。MUP 亚组人数少也可能限制治疗评估的有效性,范围从一线抗 CTLA4/抗 PD1 治疗后 11.5 个月(95% CI:1.4 – 未达到)到一线抗 PD1 单一疗法后 2.8 个月(2.4 – 未达到),尽管通常报道 MUP 对免疫治疗反应较好。
我们还评估了突变模式对治疗反应的潜在临床相关性。皮肤黑色素瘤通常三个致癌基因(BRAF、NRAS、NF1)中至少一个发生突变,而黏膜和肢端黑色素瘤通常为预后不良的 tWT 黑色素瘤。很少有关于BRAF 和 NRAS 突变均阴性的黑色素瘤的研究。在最近的一项研究中,“双重野生型”黑色素瘤(无 BRAF 和 NRAS 突变)的 mPFS 和 mOS(5.3 个月)显著短于 BRAF 突变黑色素瘤(9.9 个月)。尽管如此,许多黑色素瘤,尤其是原发于黏膜或肢端区域的黑色素瘤,不携带 BRAF、NRAS 和 NF1 突变,而没有 NF1 突变可能对 PFS 和 OS 都有影响。另一项研究表明,NF1 突变的存在与否可能显著影响对免疫治疗的反应,提示评估 tWT 黑色素瘤对免疫治疗的反应时的潜在相关性。本研究发现,与已知癌基因突变的黑色素瘤报告的数据相比,IV 期 tWT 黑色素瘤患者两种免疫疗法(抗 CTLA4 加抗 PD1 联合疗法与抗 PD1 单一疗法)的 mPFS 和 mOS 均较短。因此,我们还探索了 TMB 和 TERT 启动子突变的存在对 mPFS 和 mOS 的影响。Kaplan-Meier 和 COX 回归分析显示,每个黑色素瘤样本中突变数较高可能倾向于较长的 mPFS 和 mOS。我们还关注了 TERT 启动子突变,其通常被描述为免疫治疗反应的潜在预后因素。我们没有观察到,与没有 TERT 启动子突变的黑色素瘤患者相比,携带 TERT 启动子突变的黑色素瘤患者在接受一线免疫治疗后有 mPFS 较长的趋势。此外,我们未发现可能与较好免疫治疗反应相关的某种突变或突变模式。
在我们的队列中,IV 期一线抗 CTLA4/抗 PD1 联合疗法的 mPFS 长于一线抗 PD1 单一疗法的 mPFS。而抗 PD1 单一疗法的 mOS 以及(1 年、2 年和 5 年)PFS 和 OS 率均较高。总体而言,两种免疫疗法的 mPFS 或 mOS 无显著差异。这两个队列的患者特征没有显著差异,但在抗 CTLA4 / 抗 PD1 队列中,患有黏膜黑色素瘤和(作为治疗开始前肿瘤间接标志物的)S-100 水平较高的患者比例更高。已知这两个特征倾向于疾病进展和死亡。然而,后续治疗的数量和类型等其他因素也可能对 OS 产生额外的影响。为了最大限度地降低我们队列中的混杂风险,我们在回归分析中对混杂因素进行了分层。我们无未识别可能对 mPFS 或 mOS 有影响的其他混杂因素(例如队列年龄)。
本研究有几个局限性。由于研究的回顾性和数据的缺失,未知的混杂因素可能没有得到充分处理和掩盖影响。由于样本量有限,一些估计值只是不精确地估计。此外,我们队列中 53% 的黑色素瘤样本是转移瘤,47% 的样本是原发性肿瘤。我们无法评估黑色素瘤样本来自转移瘤的患者的原发性肿瘤是否也是三重野生型。尽管如此,我们报告了最大的多中心 tWT-黑色素瘤队列,并且组规模小的局限主要限于进一步的亚组分析,而一些结果可以通过引用文献部分验证。另一个限制是很多转移组织是在不知道原发性黑色素瘤的分子模式的情况下分析的。原发性肿瘤和转移灶可能呈现不同的突变,普遍认为,如果存在相关驱动突变(即 BRAF、NRAS、NF1),通常存在于所有肿瘤细胞中,因此在原发性和转移性样本中都存在。在我们的队列中,很少分析来自不同部位的多个样本,因此无法对(原发性和转移性)样本之间的突变遗传模式进行一般比较。然而,对于一些有此类数据的患者,没有观察到先前描述的相关驱动突变。11 例患者至少分析了 2 个组织样本。在这些患者中,只有 3 例识别了原发肿瘤和转移灶(或两个转移灶)之间的基因变异,TP53、KIT、ARID1A和SMARCA4突变。这个小亚组分析强调,原发性黑色素瘤和转移瘤关于常见驱动突变(如 BRAF、NRAS 或 NF1)的分子模式是类似的,没有这些突变仍然可能诱导转移扩散。
本研究未发现这两种疗法中哪一种更优。本研究队列是迄今为止最大的 tWT 黑色素瘤队列,但在 IV 期选择两种疗法之一的决定仍应在跨学科肿瘤委员会中根据具体情况做出。尽管由于肿瘤的罕见性,前瞻性研究设计可能具有挑战性,但在未来的研究中应将 tWT 黑色素瘤作为一个亚组进行分析。由于疗法存在高度异质性以及一线化疗、抗 PD1 /其他和其他治疗亚组中的患者数量有限,关于这些疗法,我们无法总结进一步的建议。
已知的预后因素(如 TERT 启动子突变和 TMB)在两种一线免疫疗法队列中分布平均,未发现两种 IV 期一线免疫疗法(抗 CTLA4 加抗 PD1 联合疗法 vs 抗 PD1 单一疗法)中哪种的 mPFS 或 mOS 显著较长。这两种疗法的 mPFS 和 mOS 都显著短于已知癌基因突变(例如 BRAF 突变)的黑色素瘤。
参考文献:
Jansen P, Galetzka W, Lodde GC, Standl F, Zaremba A, Herbst R, Terheyden P, Utikal J, Pföhler C, Ulrich J, Kreuter A, Mohr P, Gutzmer R, Meier F, Dippel E, Weichenthal M, Placke JM, Landsberg J, Möller I, Sucker A, Paschen A, Hadaschik E, Zimmer L, Livingstone E, Schadendorf D, Ugurel S, Stang A, Griewank KG. Shortened progression free and overall survival to immune-checkpoint inhibitors in BRAF-, RAS- and NF1- ("Triple") wild type melanomas. Eur J Cancer. 2024 Sep;208:114208. doi: 10.1016/j.ejca.2024.114208. Epub 2024 Jul 6. PMID: 39018633.



