【衡道丨病例】病理诊断——深在性囊性胃炎
时间:2024-11-08 12:00:24 热度:37.1℃ 作者:网络
深在性囊性胃炎(gastritis cystica profunda,GCP)是一种罕见的胃黏膜腺体扩张并向黏膜下层生长的病变,由Franzin等在1981年首次报道。患者多为中老年男性,好发部位是胃窦、胃体,临床症状及体征无特异性,多数仅有轻微的消化系统症状,例如食欲不振、腹胀、腹痛等。GCP尚无统一的临床诊断标准,需结合胃镜、超声内镜等综合判断。
今天由徐州市第一人民医院病理科刘霞医生为大家带来一例深在性囊性胃炎的病例分享。
临床资料
患者女,年龄61,2023年10月因烧心、反酸、上腹阵发性隐痛等不适就诊徐州市第一人民医院消化内科门诊,常规检查未见明显阳性体征,建议行超声内镜(Endoscopic Uhrasonography ,EUS)和胃肠镜检查,EUS提示黏膜下层多发囊性低回声改变,范围直径 0.5-1.0cm(图1),胃镜提示:胃窦后壁近幽门见一黏膜下隆起,大小约1.3 cm×1.0×1.0cm,表面可见轻微凹陷(图2),遂在凹陷和交界区取活检以明确性质。病理回报慢性轻度萎缩性炎伴浅表糜烂,故经消化内科科室讨论, 一致认为虽然病理结果显示为炎性病变,但结合内镜及EUS表现不能完全排除间质瘤、平滑肌瘤、胃癌等肿瘤性病变,考虑到普通胃镜活检难以行大块切除病变,无法获得完整标本的局限性,建议患者行内镜黏膜下剥离术(endoscopic submucosal disp,ESD)切除治疗,同时也可规避最终病变完整切除后,诊断是良性病变而过诊采取的外科手术的风险。
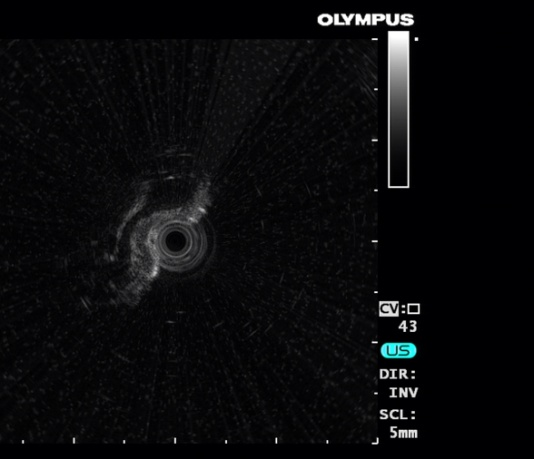
图1 EUS提示黏膜下层多发囊性低回声改变,范围直径0.5-1.0cm
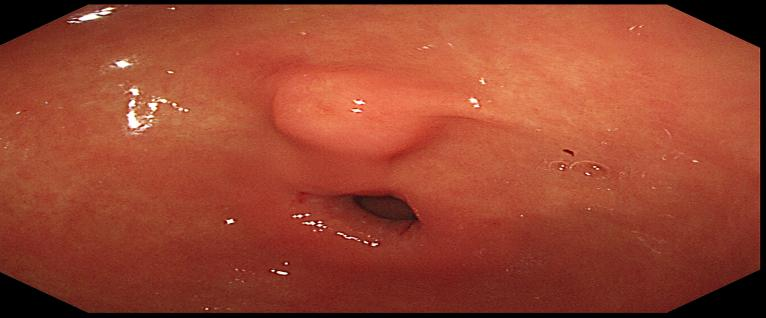
图2 胃窦后壁近幽门见一黏膜下隆起,大小约1.3cm×1.0×1.0cm,表面可见轻微凹陷
大体检查
病理送验标本大体示灰白色黏膜组织一块,大小1.9×1.5×0.3cm,距口侧0.5cm见一灰白色隆起,大小1.3 cm×1.0×1.0cm,质中(图3)。
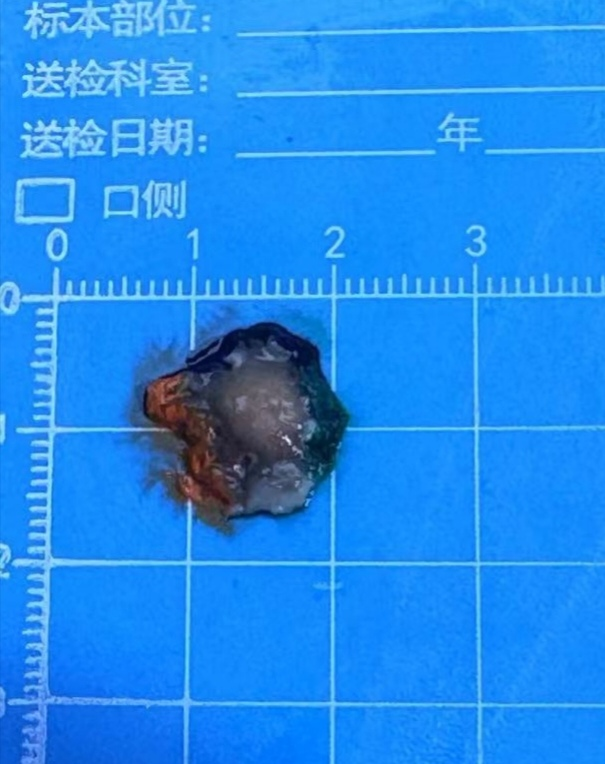
图3 ESD切除标本示黏膜下隆起,大小约1.3 cm×1.0×1.0cm
镜下所示
低倍镜下可见胃黏膜腺体囊性扩张,腺体间质轻度水肿、其内结缔组织增生、伴有淋巴细胞、浆细胞等浸润,扩张的胃体腺、幽门腺、或化生性腺体向黏膜深层或黏膜下生长,位于黏膜下层,表面黏膜腺体正常。高倍镜下示腺体细胞大小均匀一致、呈圆形或椭圆形,位于腺体基底部,形态温和,未见异型。免疫组化结果CK7( + ),CK20(-),Villin( + ),CDX-2( + ),Ki67(+;2%) 。病理诊断(胃窦后壁近幽门):深在性囊性胃炎(gastritis cystica profunda,GCP)
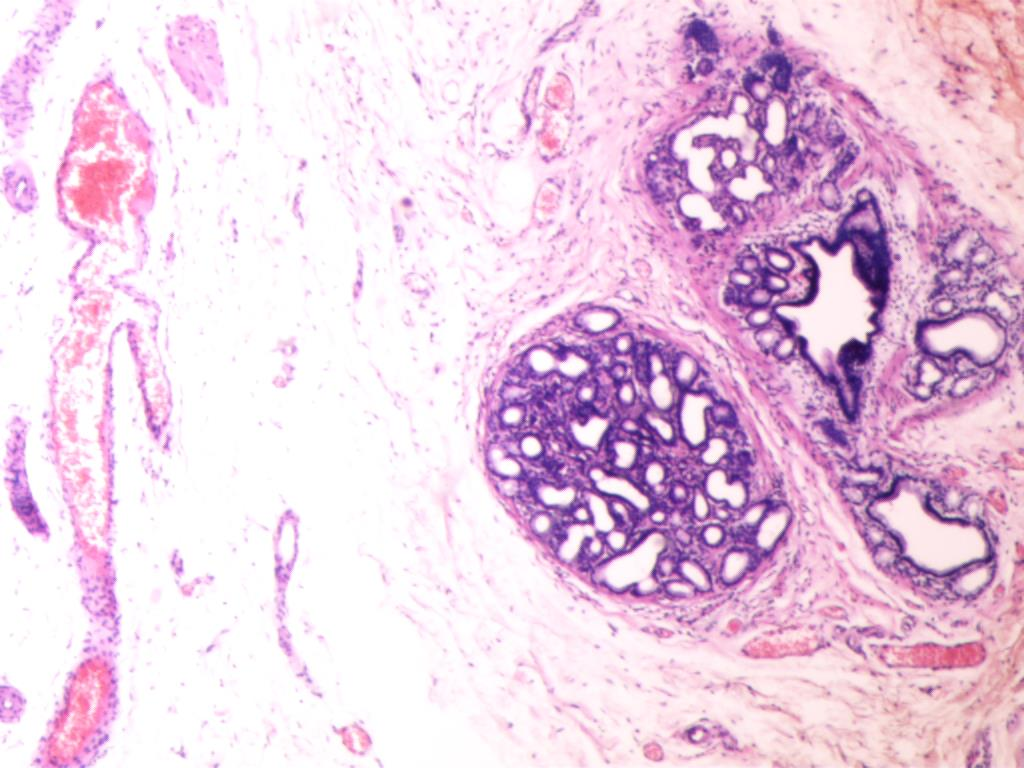
图4 光镜下胃黏膜腺体向黏膜深层或黏膜下生长,位于黏膜下层(HE×200)
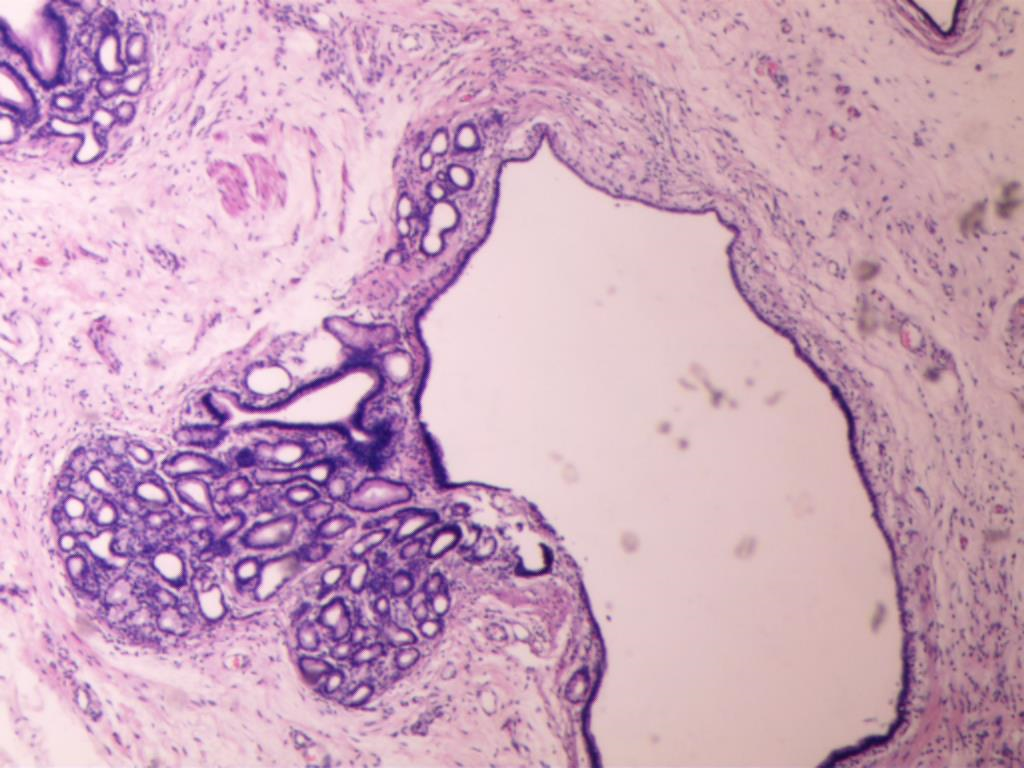
图5 光镜下胃黏膜腺体囊性扩张(HE×200)
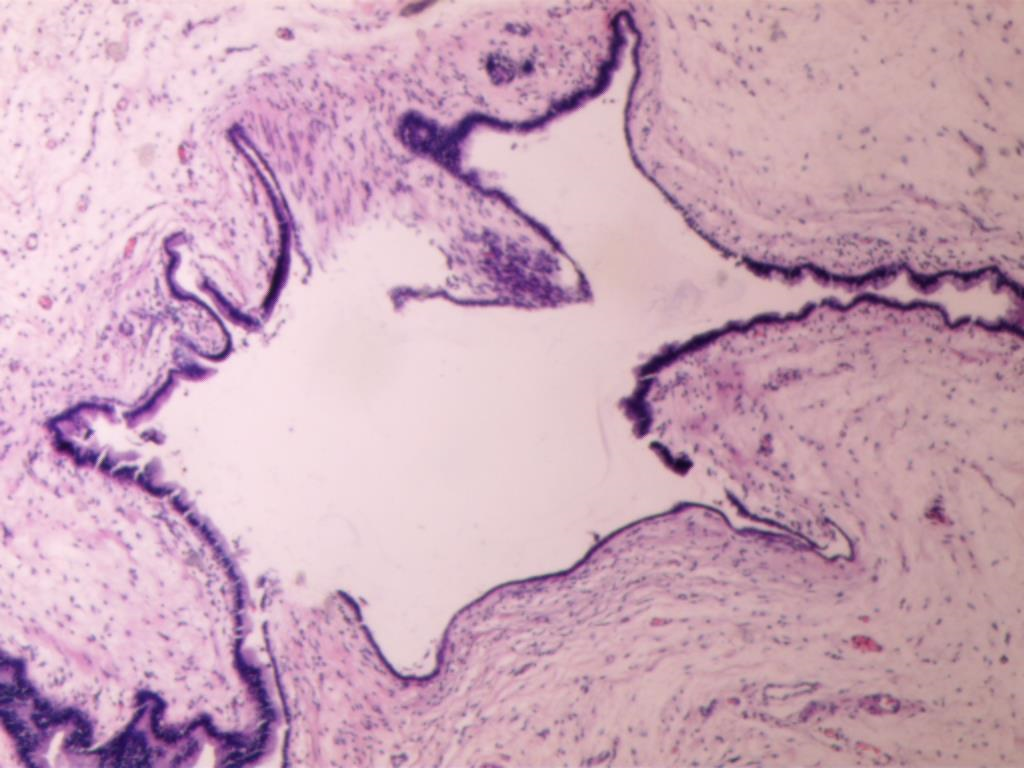
图6 光镜下示扩张的腺体细胞大小均匀圆形或椭圆形,位于腺体基底部,形态温和,未见异型(HE×200)
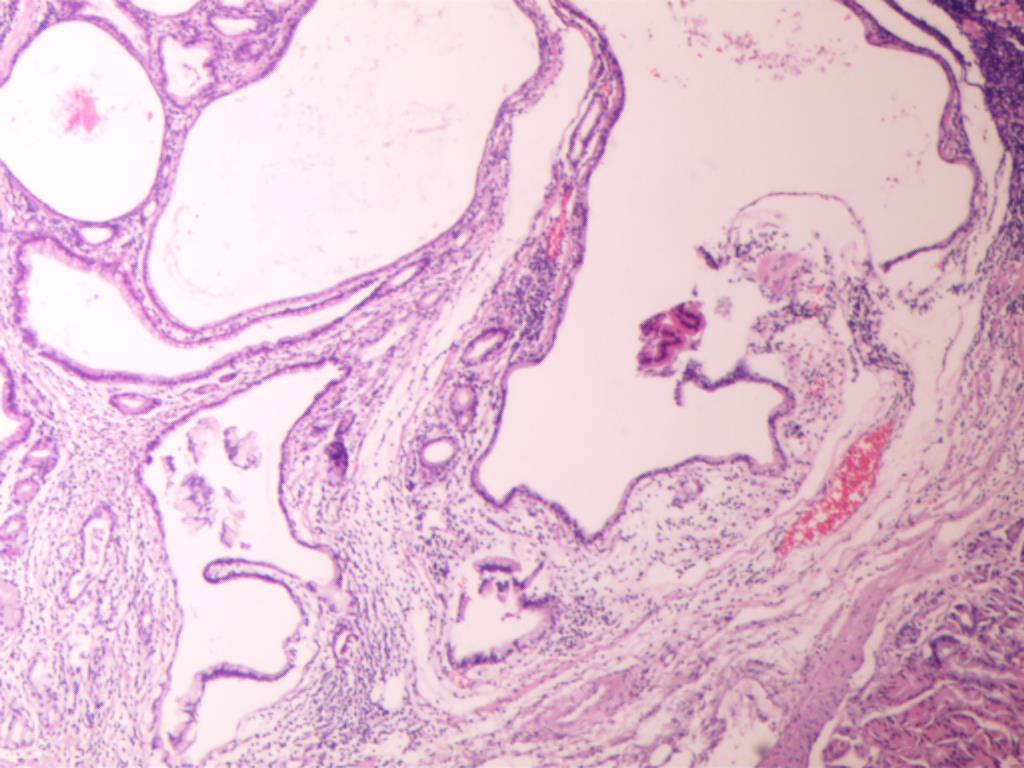
图7 光镜下扩张的腺体间质水肿、其内结缔组织增生、伴有淋巴细胞、浆细胞等浸润(HE×200)
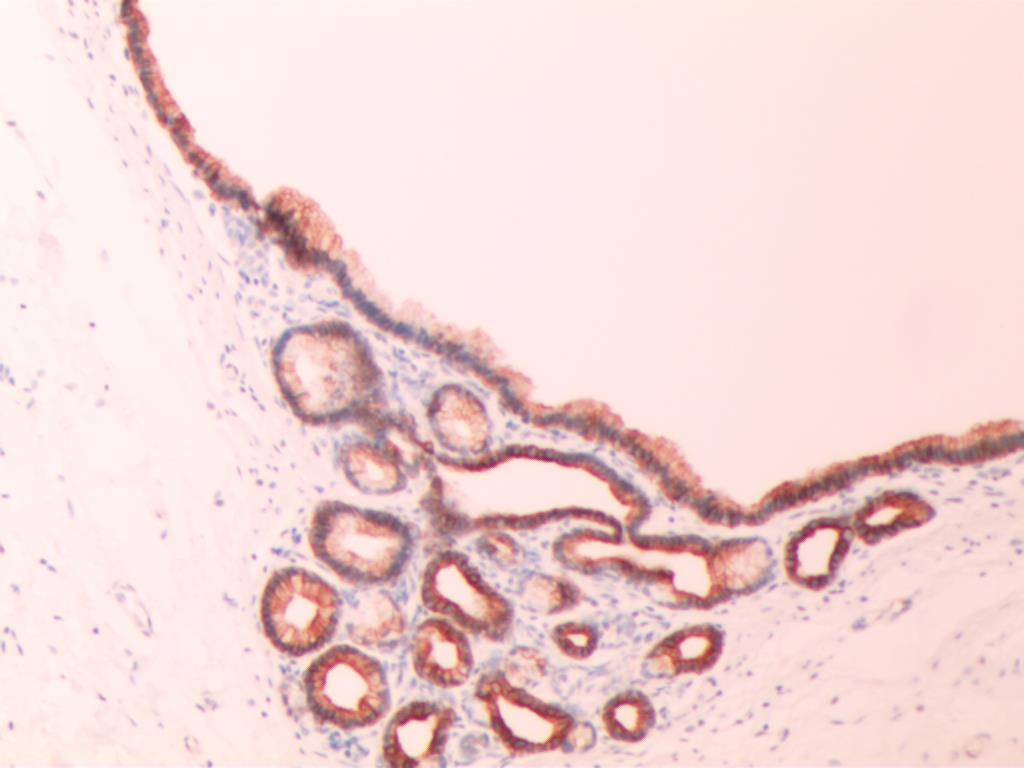
图8 CK7(+) (SP×200)
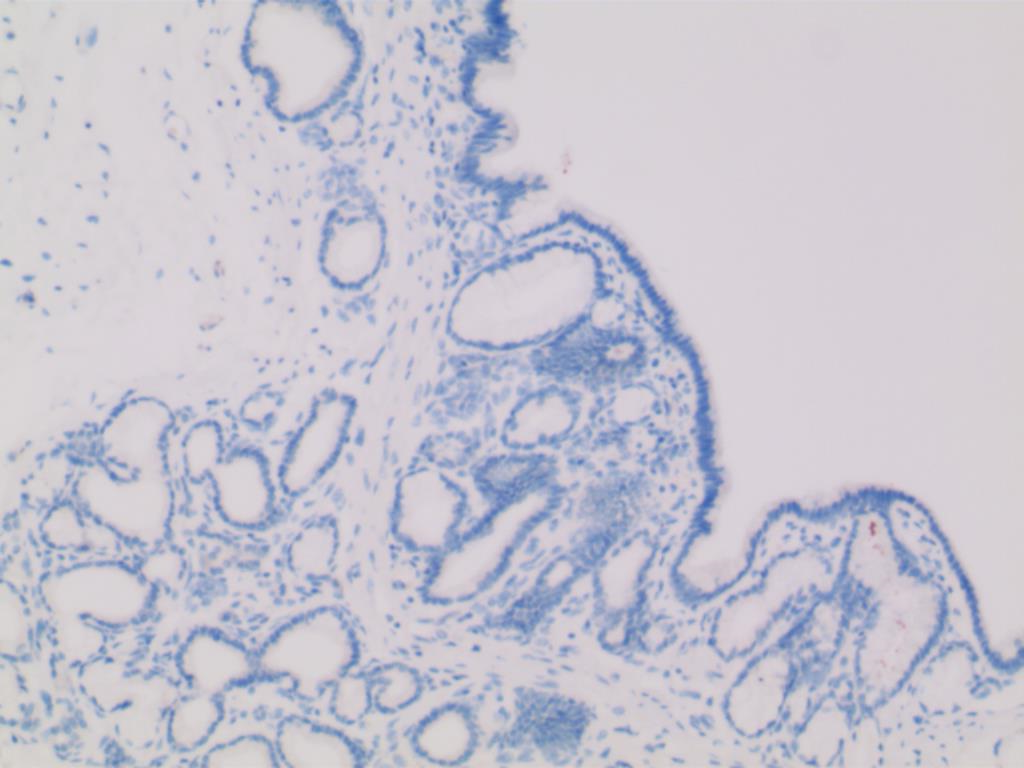
图9 CK20(-) (SP×200)
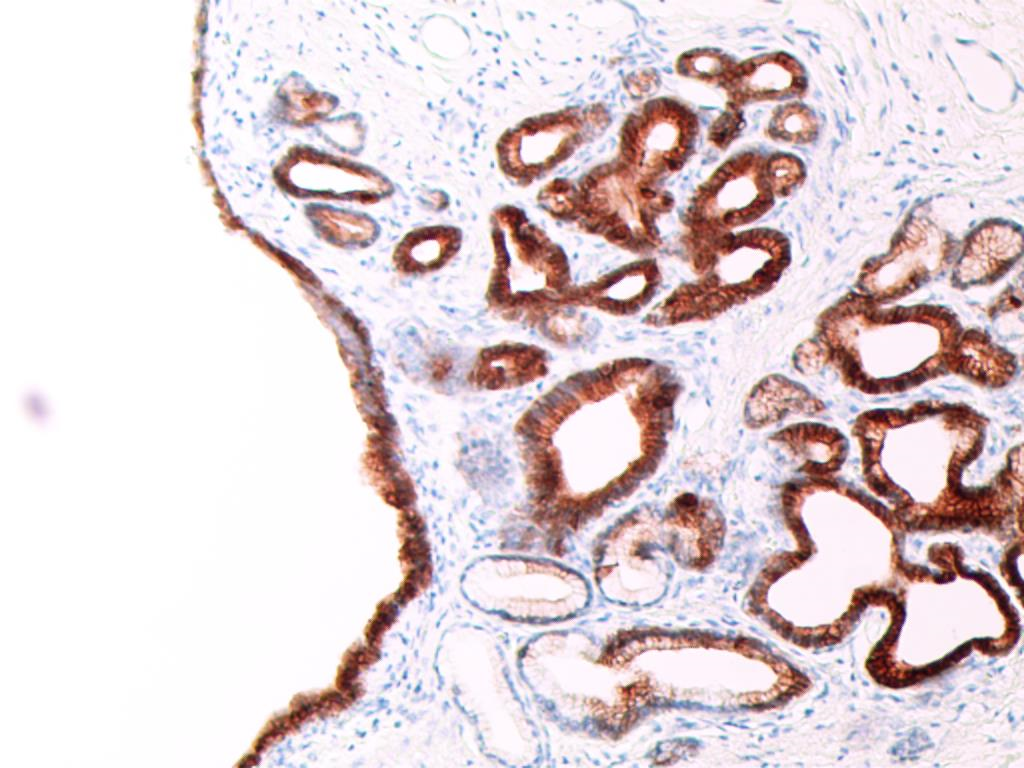
图10 Villin(+) (SP×200)
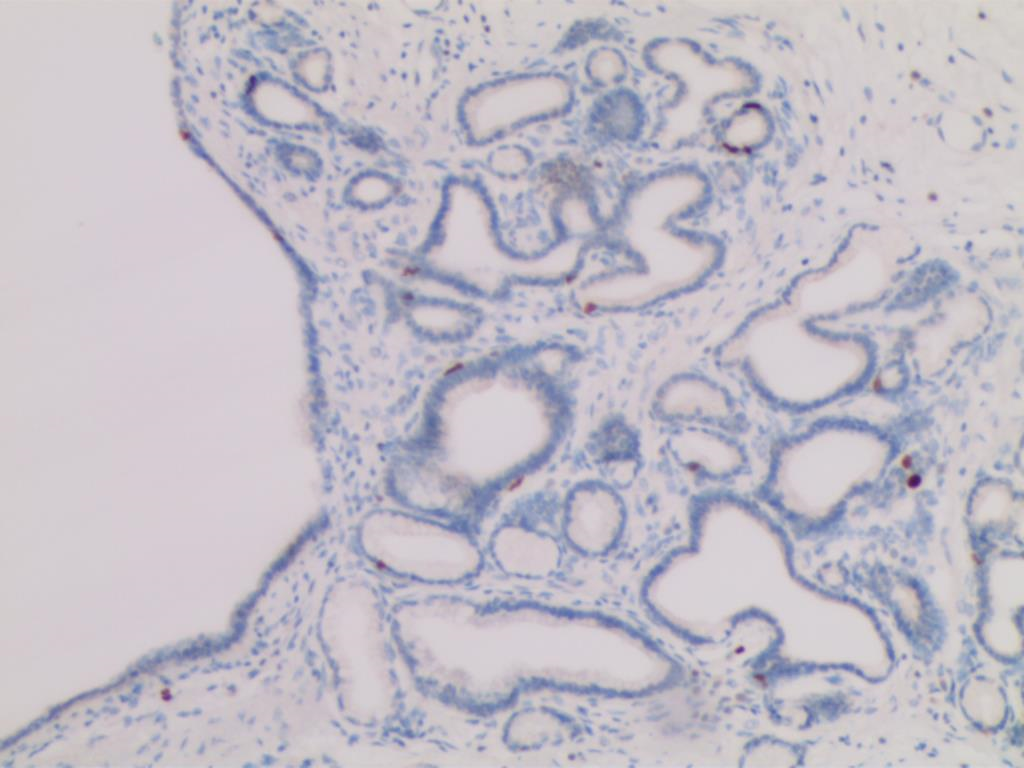
图11 Ki67(+;2%)(SP×200)
最终诊断
病理诊断(胃窦后壁近幽门):
深在性囊性胃炎(gastritis cystica profunda,GCP)
讨论
深在性囊性胃炎(GCP)是一种罕见的胃黏膜腺体扩张并向黏膜下层生长的病变,由Franzin[1] 等在1981年首次报道。
临床特征:
GCP 患者多为中老年男性,好发部位是胃窦、胃体,临床症状及体征无特异性,多数仅有轻微的消化系统症状,例如食欲不振、腹胀、腹痛等。GCP尚无统一的临床诊断标准,需结合胃镜、超声内镜等综合判断。内镜下GCP的表现不尽相同,多以0Ⅱ型为主,可有黏膜下的隆起或息肉样的隆起,有时仅见黏膜皱壁的粗大肥厚等,导致内镜下临床较易判断为胃间质瘤、淋巴瘤、平滑肌瘤等,故对于发生在胃黏膜呈浅表隆起型的病灶,内镜医生需考虑GCP的可能。超声胃镜对GCP的辅助诊断有一定意义,经典的表现是黏膜下层的低回声或无回声的囊腔。GCP的CT表现则是可以观察到不同程度的胃壁增厚伴黏膜下囊性肿块影,增强CT会出现“三明治”样强化或“蜂窝征”样改变[2]。而确诊的金标准则是病理学活检检查,但由于常规胃镜有时可能会因钳夹组织过浅,难以取到病变部位,病理结果多显示为胃黏膜的炎症改变,故取材的深度对GCP诊断至关重要,所以大多GCP 的发现是在胃黏膜ESD术和手术切除标本中。GCP 的病因和发病机制均尚未阐明,有研究表明可能是胃黏膜异位的表现,也有研究表明可能是后天严重的慢性胃炎、EB 病毒感染、幽门螺杆菌(HP)感染导致[3],而近年来,随着GCP在越来越多胃癌手术标本中的发现,陆续有相应的GCP与胃癌相关的报道,并在其标本中检查到Kcne2基因的缺失[4],亦有研究认为 GCP 可能是胃的癌前病变[7],颠覆了以往通常认为 GCP 是一种良性病变的认知,但至今,以上所有“研究结论”均存在争议,有待未来积累更多病例、行更大规模的研究。
镜下特征:
当前,以内镜或手术切除后标本的病理结果作为诊断的“金标准”,光镜下GCP的诊断标准示胃黏膜内的腺体向黏膜深层、下层或肌层生长,腺体不同程度的囊性扩张,腺体间的纤维结缔组织增生,可伴有淋巴细胞、浆细胞等炎细胞的浸润。
免疫组化特征:
无特异的组化特征,表达相应的胃标记,例如CK7,MUC5AC,MUC6等。一般Villin,CDX-2也会表达。
分子遗传学特征:
有文献报道在其标本中检查到Kcne2基因的缺失。
治疗和预后
关于GCP的标准化治疗策略尚无明确的共识及指南,对于单纯性GCP病变,现有多数观念认为其可能是一种癌前病变,但由于GCP缺乏典型临床症状等,内镜下难以直接确诊,临床数据均是回顾性研究,建议内镜下发现可疑GCP病变,结合病变范围积极选择内镜下手术及外科手术治疗。而对于GCP合并肿瘤性病变,更需采用积极治疗措施,结合初次内镜下评估和术前病理结果、及病变范围,选择最优的治疗方案。方式有ESD、EMR等,既往文献显示ESD、EMR具有损伤小、对胃部整体解剖结构破坏轻、术中并发症少、术后患者恢复快等优势,且完整切除率可达92%[5]。对于GCP合并浸润性胃癌、且影像评估肿瘤已浸润固有肌层或更深处的病变、或患者存在严重并发症无法行内镜下治疗时,应选择外科手术切除。同时,临床均需对GCP术后患者采取长期内镜随诊。
鉴别诊断
1、胃囊肿,主要有两类,一类是淋巴管扩张或黏膜内的幽门腺存留的腺体扩张造成的胃囊性病变,另一类是与胃炎、糜烂以及溃疡的黏膜缺损修复相关造成的囊性病变,与GCP最大的鉴别点是很少向黏膜下层以及更深的位置生长。
2、异位胰腺导管上皮囊肿典型的表现为可见异位的胰腺导管单房性囊性扩张,囊壁衬覆高柱状黏液上皮细胞,并可见胰腺正常组织(腺泡或胰岛)
3、支气管源性囊肿囊壁可见支气管腺体和软骨,衬覆假呼吸道的假复层纤毛柱状上皮
4、肠源性上皮囊肿衬覆上皮可见肠上皮分化,腺上皮呈锯齿状或者城墙样改变
参考文献及书籍
[1]FRANZIN G,NOVELLI P. Gastritis cystica profunda[J].Histo pathology,1981,5(5):535-547
[2]唐军,董江宁,韦超.等贲门小弯侧深在性囊性胃炎CT影像诊断一例[J].中华放射学杂志,2019,53(1):77-78.DOI:10.3760/cma.j.Issn.1005-1201.2019.01.017
[3]龚帅,杨世英,薛寒冰,等.深在性囊性胃炎40 例临床诊治分析[J].中华消化内镜杂志,2019,36( 7) : 483-486.
[4] ROEPKE T K,PURTELL K,KING E C,etal.Targeted deletion of Kcne2causes gastritis cystica profunda and gastric neoplasia[J].PLoS One,2010,5(7):e11451 .
[5]De Stefano F, Graziano GMP, Viganò J, Mauro A, Peloso A, Peverada J, Fellegara R, Vanoli A, Faillace GG, Ansaloni L. Gastritis Cystica Profunda: A Rare Disease, a Challenging Diagnosis, and an Uncertain Malignant Potential: A Case Report and Review of the Literature. Medicina (Kaunas). 2023 Oct 4;59(10):1770. DOI: 10.3390/medicina59101770. PMID: 37893488; PMCID: PMC10608487.


