Adv Sci:王坚成/代华平合作研究提出纳米药物对线粒体通透性转换孔治疗特发性肺纤维化的双重制动作用
时间:2024-11-07 09:00:34 热度:37.1℃ 作者:网络
线粒体通透性转换孔(mPTP)开放是特发性肺纤维化(IPF)中受损的II型肺泡上皮细胞(AECIIs)的关键标志。抑制AECIIs中的mPTP开放被认为是一种潜在的IPF治疗方法。
2024年10月30日,北京大学王坚成、中国医学科学院代华平共同通讯在Advanced Science 在线发表题为“Double Braking Effects of Nanomedicine on Mitochondrial Permeability Transition Pore for Treating Idiopathic Pulmonary Fibrosis”的研究论文。该研究提出了一种通过环孢菌素A(CsA)衍生的具有3D结构的可电离脂质(3D-脂质)结合环丝氨酸蛋白酶D(CypD)和siRNA下调线粒体钙单向转运体(MCU)表达对mPTP进行“双制动”的策略来治疗IPF。
3D-脂质和靶向siRNA的MCU(siMCU)与辅助脂质一起共组装形成稳定的3D-LNP/siMCU纳米颗粒(NP)。体外结果表明,这些NPs通过3D-脂质与CypD结合有效抑制mPTP开放,并通过siRNA下调MCU表达,从而减少损伤相关分子模式(DAMPs)的释放并抑制博来霉素诱导的A549细胞中的上皮-间质转化(EMT)过程。体内结果表明,3D-LNP/siMCU NPs有效改善了博来霉素诱导的肺纤维化(PF)小鼠模型中的胶原沉积、促纤维化因子的分泌和成纤维细胞活化。此外,与商业化的基于MC3的配方相比,优化的Opt-MC3/siRNA NPs加入了3D-脂质作为第五种成分,由于其稳定性增强和基因沉默效率更高,表现出对PF的优异治疗效果。总体而言,含有3D-脂质和siMCU的纳米药物将成为一种有前途的、潜在的IPF治疗方法。

特发性肺纤维化(IPF)是一种进展迅速、致死性的肺泡疾病,患者中位生存期为2-3年。其特点是成纤维细胞过度增生、细胞外基质过度沉积和肺泡结构破坏。根据世界特发性肺纤维化联合会的数据,每年约有122万新发病例。环境污染、病毒感染和吸烟被公认为IPF的主要潜在致病因素。尽管吡非尼酮(PFD)和尼达尼布等抗纤维化药物可以抑制IPF的进展,但其发病机制不明,导致IPF难以治疗或治愈。因此,迫切需要开发新的治疗策略。
IPF的发病机制与肺泡上皮细胞(AEC),特别是II型肺泡上皮细胞(AECIIs)的反复微损伤有关。在博来霉素(BLM)诱导的肺纤维化(PF)模型中,受损和功能失调的AECII发生上皮间质转化(EMT),导致过多的细胞外基质沉积和成纤维细胞活化。越来越多的证据表明,从线粒体释放的损伤相关分子模式(DAMP),如ROS,通过激活NF-κB/NLRP3轴诱导炎症和EMT,从而加速PF的进展。线粒体功能障碍是IPF发病机制中受损AECII的一个关键标志,以线粒体通透性转换孔(mPTP)的开放和随之而来的DAMP释放为标志。
mPTP是位于线粒体(IMM)内膜上的一种非特异性、电压依赖性复合孔道,由多种蛋白质(环丝氨酸蛋白酶D(CypD)、腺嘌呤核苷酸转移酶(ANT)和电压依赖性离子通道(VDAC))组成。在衰老、氧化应激、钙(Ca2+)超载等病理条件下,CypD从线粒体基质易位到IMM并与ANT结合,从而形成由VDAC和ANT组成的隧道状结构。据报道,环孢菌素A(CsA)可以与IMM中的CypD结合,阻碍CypD与ANT的相互作用,从而抑制mPTP开放,减轻线粒体功能障碍,用于治疗心肌缺血再灌注损伤、中风、创伤性脑损伤等。CsA抑制mPTP开放对治疗特发性肺纤维化(IPF)的肺部影响尚未见报道。因此,CsA与CypD结合抑制AECII中mPTP开放的作用可能是治疗IPF的潜在策略。
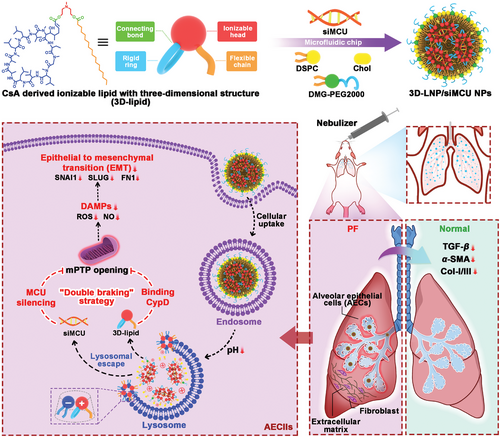
利用微流控芯片将环孢素A(CsA)衍生的具有3D结构的可电离脂质(3D-脂质)与靶向siRNA(siMCU)的线粒体钙单向转运体(MCU)和其他辅助脂质共组装,形成稳定的脂质纳米颗粒(LNP),称为3D-LNP/siMCU纳米颗粒(NP)。(图源自Advanced Science )
此外,调节线粒体Ca2+(mtCa2+)转运提供了另一种抑制mPTP开放的策略。mtCa2+的转运过程由位于IMM中的线粒体钙单向转运体(MCU)复合物控制。在正常生理条件下,MCU可以将Ca2+从细胞质转运到线粒体基质中,以刺激Ca2+依赖性三羧酸(TCA)循环脱氢酶,从而促进线粒体三磷酸腺苷(ATP)的产生并支持细胞的能量需求。然而,过表达的MCU会诱导mtCa2+过度积累,然后触发mPTP开放,最终导致DAMPs的释放。据报道,食管癌和帕金森病的发病机制与MCU过表达引起的mtCa2+过度积累有关。然而,MCU在IPF患者AECII中的作用尚不清楚。因此,下调AECIIs中的MCU表达水平为治疗IPF提供了另一种有效的策略。
综合以上讨论,作者假设CsA与CypD结合和siRNA下调MCU表达对mPTP开放的“双制动”作用将协同抑制DAMP的释放,从而抑制EMT过程并减弱IPF的进展。有趣的是,作者在预实验中意外地发现了具有优异稳定性和溶酶体逃逸能力的CsA衍生的可电离脂质,它们被用于载有siRNA的脂质纳米颗粒(LNP)。在这里,具有3D结构的CsA衍生的可电离脂质(3D-lipid)被用于使用微流控芯片包装MCU靶向siRNA(siMCU),以及其他辅助脂质,以形成稳定的3D-LNP/siMCU纳米颗粒(NP)用于治疗IPF。如图1所示,肺部给药后,3D-LNP/siMCU NPs被内化到AECIIs中,通过3D-脂质与CypD结合并下调MCU表达,对mPTP开放产生抑制作用,从而抑制AECIIs的DAMPs释放和EMT过程。此外,3D-脂质进一步作为第五种组分加入基于Dlin-MC3-DMA(MC3)的商业配方(MC3/siRNA NPs)中,形成优化的Opt-MC3/siRNA NPs,从而增强其对IPF的治疗潜力。在BLM诱导的PF小鼠模型中评估了NPs的体内治疗效果。此外,本研究首次证明IPF患者肺组织中的AECIIs中存在MCU的过表达。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405406


