Molecular Neurodegeneration:阿尔茨海默病小鼠模型中抗β淀粉样蛋白免疫治疗诱导的微出血与血管炎症和脑血管损伤的关系
时间:2024-11-01 11:01:31 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)的一个主要病理特征是β淀粉样蛋白(Aβ)在大脑中的沉积。针对Aβ的被动免疫治疗被认为是一种潜在的治疗策略,能够通过清除Aβ沉积来减缓或逆转AD进展。尽管一些大型临床试验证明了Aβ免疫治疗的疗效,如减少Aβ沉积和改善认知功能,然而,相关成像异常(ARIA)特别是脑水肿(ARIA-E)和微出血(ARIA-H)等不良事件限制了其广泛应用。Aβ免疫治疗如何导致血管通透性增加、血脑屏障(BBB)破坏以及微出血的具体机制仍然不清楚。本研究使用AD小鼠模型,探讨Aβ免疫治疗引发的免疫反应和血管损伤的机制,特别关注微出血的发生及其与血管炎症和外周免疫细胞浸润的关系。

本研究使用了PDAPP和hTau APP KI阿尔茨海默病小鼠模型,模拟Aβ免疫治疗对脑血管的影响。PDAPP小鼠在23个月大时接受抗Aβ抗体(3D6)的皮下注射,持续三个月,每周注射一次。此外,还使用了IgG作为对照。研究中通过组织学染色、数字空间蛋白质组分析(DSP)和RNA原位杂交等技术,详细评估了免疫治疗对血管结构、平滑肌细胞、血脑屏障完整性以及周围免疫反应的影响。通过Prussian Blue染色分析微出血的发生,通过免疫荧光技术评估血管平滑肌细胞、纤维蛋白原、VEGF和水通道蛋白4(AQP4)的表达变化。同时,使用DSP技术分析血管周围的免疫细胞亚群,并探讨其在血管损伤中的作用。
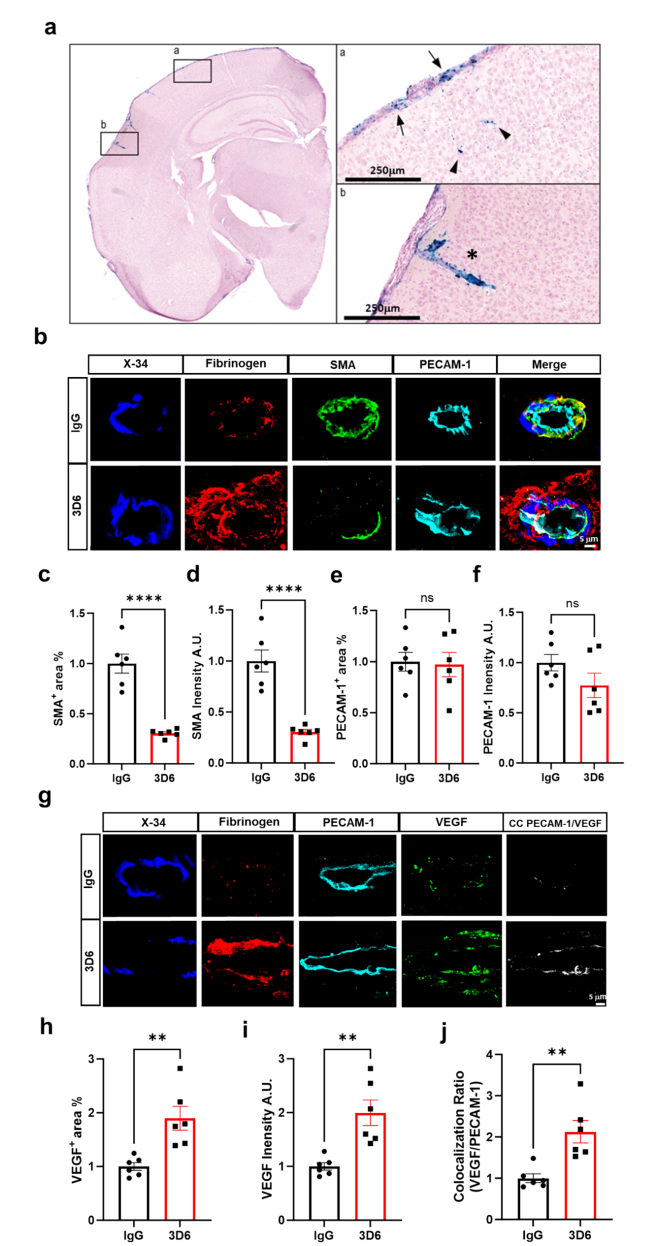
图1. 3D6处理诱导PDAPP小鼠中平滑肌细胞的丢失
研究发现,3D6免疫治疗显著增加了PDAPP小鼠大脑中的微出血,尤其是在软脑膜和穿透血管区域。Prussian Blue染色显示,接受Aβ抗体治疗的小鼠大脑中微出血面积显著增加,与血管Aβ负荷呈负相关。此外,抗Aβ治疗还导致血管平滑肌细胞显著丢失,尤其是在软脑膜血管中,SMA(平滑肌肌动蛋白)的表达显著减少,而内皮细胞标志物PECAM-1的表达保持不变,表明血管内皮细胞在血管病变中的保存较好。
血脑屏障破坏的证据表现在纤维蛋白原外渗的显著增加,尤其是在接受抗Aβ治疗的小鼠大脑皮层和软脑膜中。此外,VEGF的表达也显著增加,尤其是在血管周围的星形胶质细胞中,这可能作为一种代偿机制,试图增强血管通透性。同时,AQP4和胶质纤维酸性蛋白(GFAP)的表达在软脑膜和穿透血管区域显著上调,表明Aβ免疫治疗可能引发了星形胶质细胞对血管损伤的响应。
通过DSP分析进一步揭示了抗Aβ免疫治疗引发的复杂免疫反应。研究发现,在血管Aβ沉积区域,尤其是软脑膜,T细胞、B细胞和巨噬细胞显著积聚。CD19标记的B细胞和CD3标记的T细胞在接受Aβ抗体治疗的小鼠血管周围显著增加,CD4+辅助性T细胞和CD8+细胞毒性T细胞的表达也显著增加,表明适应性免疫反应与血管损伤密切相关。此外,研究还发现,纤维化标志物纤维连接蛋白在免疫治疗后显著上调,与巨噬细胞标志物CD45和F4/80的共定位增加,这表明巨噬细胞在血管损伤后可能通过诱导纤维化反应促进组织修复。
RNA原位杂交分析显示,抗Aβ治疗诱导了两类TREM2+巨噬细胞的显著积累,这些巨噬细胞包括来源于单核细胞的CD74+巨噬细胞和组织驻留的Mrc1+巨噬细胞。TREM2是巨噬细胞的重要受体,与Aβ清除和免疫调节有关。研究发现,TREM2的表达显著上调,尤其是在Aβ沉积的血管周围,这与临床试验中发现的TREM2激动剂抗体加剧ARIA的结果相一致。

图2. Aβ免疫治疗与PDAPP小鼠中星形胶质细胞AQP4表达增加相关
本研究通过AD小鼠模型,详细阐述了Aβ免疫治疗引发的血管损伤和免疫反应机制。研究发现,抗Aβ治疗导致了显著的微出血和血脑屏障破坏,这与血管平滑肌细胞丢失、免疫细胞浸润和纤维化反应密切相关。尤其是T细胞的激活与平滑肌细胞丢失的发生高度相关。此外,巨噬细胞在组织修复和纤维化过程中扮演了关键角色,TREM2+巨噬细胞的积累进一步揭示了其在免疫治疗中的重要作用。尽管Aβ免疫治疗在清除Aβ沉积方面表现出一定疗效,但其引发的血管副作用,如ARIA,可能限制其临床应用。未来的研究应进一步探讨不同免疫细胞亚群在血管损伤中的具体作用机制,并探索如何减少Aβ免疫治疗带来的不良反应,优化治疗方案。
原始出处:
Taylor, X., Noristani, H. N., Fitzgerald, G. J., Oluoch, H., Babb, N., McGathey, T., Carter, L., Hole, J. T., Lacor, P. N., DeMattos, R. B., & Wang, Y. (2024). Amyloid-β (Aβ) immunotherapy induced microhemorrhages are linked to vascular inflammation and cerebrovascular damage in a mouse model of Alzheimer’s disease. Molecular Neurodegeneration, 19:77. https://doi.org/10.1186/s13024-024-00758-0


