Adv Sci:海军军医大学朱江波/郭佳铭/刘冰合作发现Cu-IR783纳米粒子的智能抗肿瘤治疗诊断平台的声动力
时间:2024-10-05 17:00:37 热度:37.1℃ 作者:网络
活性氧(ROS)介导的声动力疗法(SDT)因其高组织穿透深度而在治疗深部肿瘤方面具有越来越大的潜力。然而,声敏剂在正常组织中不可避免的积累不仅使原位SDT难以实现,而且还会在正常组织中诱发声动力效应。
2024年9月27日,海军军医大学朱江波、郭佳铭及刘冰共同通讯在Advanced Science 在线发表题为“Tumor Microenvironment Activated Cu Crosslinked Near-Infrared Sonosensitizers for Visualized Cuproptosis-Enhanced Sonodynamic Cancer Immunotherapy”的研究论文。该研究报告了一种称为Cu-IR783纳米粒子(NPs)的智能抗肿瘤治疗诊断平台的声动力和近红外(NIR)成像性能的钝化和选择性激活策略。
由于IR783与Cu离子之间的配位键因响应肿瘤微环境(TME)而断裂,IR783的选择性激活仅发生在肿瘤组织中以实现可视化的原位SDT。肿瘤特异性释放的Cu离子不仅通过Cu+介导的类Fenton反应实现了ROS生成的级联放大,而且还通过Cu+诱导的DLAT寡聚化和线粒体功能障碍引发了杯状凋亡。更重要的是,免疫抑制的TME可以通过大大增强的ROS水平和高效的杯状凋亡来逆转,最终诱导免疫原性细胞死亡,从而促进强大的全身免疫反应,以消灭原发性肿瘤并抑制远处肿瘤。这项工作为以可控方式整合SDT,CDT和杯状凋亡以实现可视化的原位抗肿瘤治疗提供了独特的范例。

虽然手术、化疗、放疗等传统治疗方法对胶质母细胞瘤显示出一定的积极作用,但肿瘤复发、转移等问题也较为突出。近年来,纳米医学的发展为克服耐药性、提高肿瘤靶向性、降低毒副作用提供了可能,例如利用活性氧(ROS)抗击癌症的纳米技术受到了广泛的关注。ROS在肿瘤进展过程中是一把双刃剑,低水平的ROS参与肿瘤的发生发展,而高水平的ROS则启动癌细胞的氧化应激反应,导致细胞凋亡。利用外源刺激或内源化学反应产生ROS的新型肿瘤治疗方法已被广泛研究,包括光动力疗法(PDT)、声动力疗法(SDT)和化学动力疗法(CDT)。其中,SDT由于组织穿透深度较大(>10cm)可以克服PDT固有的缺陷,而且空化效应可以促进纳米药物通过血管渗透到肿瘤内部,特别是提高血脑屏障(BBB)的通透性,从而增强GBM的治疗效果。
通过分析SDT的作用机制,SDT的疗效很大程度上取决于声敏剂的性能及其对肿瘤微环境(TME)的调控。为了克服以TiO2为代表的无机声敏剂的局限性,人们探索了许多策略,通过引入氧空位或掺杂金属离子来降低TiO2的带隙,通过构建具有匹配带隙结构的异质结来抑制电子-空穴对的复合。针对TME的制约,将具有多种酶模拟催化活性的纳米酶引入声敏剂体系,不仅可以消耗过表达的谷胱甘肽(GSH),还可以缓解严重缺氧,从而实现ROS生成的级联放大。在此基础上,进一步引入具有过氧化物酶(POD)模拟催化活性的纳米酶,通过内源性Fenton/类Fenton反应产生羟基自由基(•OH),实现外源性SDT与内源性CDT的联合。虽然多种联合治疗策略可以增强SDT的疗效,达到“1+1>2”的治疗效果,但SDT仍然面临以下需要克服的挑战。
首先,声敏剂的研发通常只注重提高ROS的生成效率,而忽略了声敏剂的生物相容性,存在潜在的安全性问题;其次,声敏剂在静脉给药后全身分布,不具有主动靶向能力,也会在正常组织中诱发声动力效应,对正常组织或器官造成不可逆的损伤;第三,声敏剂在SDT过程中是否在肿瘤中蓄积难以可视化监测。为了解决以上问题,设计一种智能声敏剂,使钝化的声敏剂和荧光探针的声动力活性与成像能力只能在TME中被激活,实现可视化的原位SDT,是一个重大挑战。
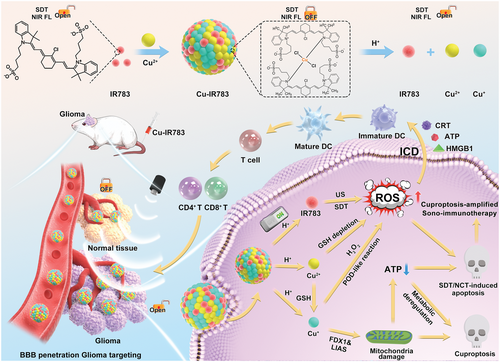
具有声动力活性和近红外成像能力“开/关”功能的智能纳米组装体Cu-IR783 NPs的制备示意图,以及可视化原位SDT/CDT结合杯突下垂用于癌症治疗诊断的机制。(图源自Advanced Science )
除了SDT,金属离子介导的肿瘤治疗也受到了广泛关注,如铜死亡、铁死亡、细胞焦亡、金属免疫治疗等。生物系统通常通过进化保守的稳态机制来调节Cu离子水平,但过量的Cu离子会产生毒性并导致细胞死亡。铜死亡的机制主要归因于过量的Cu离子通过与脂蛋白结合,诱导脂化蛋白聚集,抑制线粒体的代谢功能,最终导致细胞死亡。通过分析铜死亡的机制不难发现,如何提高Cu离子在肿瘤细胞内的聚集水平是影响治疗效果的关键因素。由于Cu离子在细胞内的浓度有限,需要频繁给药来提高Cu离子在肿瘤组织中的蓄积水平,以增强治疗效果。但与SDT类似,Cu细胞凋亡诱导的细胞死亡不具有高选择性,全身分布的Cu离子也会在正常组织中诱导Cu细胞凋亡。因此,迫切需要开发涉及声敏剂和Cu离子的多功能智能纳米系统,不仅可以实现声动力活性的钝化,还可以实现声敏剂和Cu离子的TME响应性释放。
在本文中,作者首次报道了基于Cu2+和IR783声敏剂的配位能力,构建了具有钝化声动力活性和NIR成像能力的智能纳米组装体Cu-IR783纳米粒子(NPs)。IR783作为一种商业化的近红外成像剂,可作为治疗诊断用的近红外声敏剂,然而,由于游离IR783在血液循环时间短、肿瘤蓄积有限,其系统性分布的特点使其无法实现原位可视化的SDT。经过简单的组装过程,得到的Cu-IR783NPs与游离IR783相比,由于粒径增大引起的EPR效应,表现出更高的肿瘤蓄积性。在正常生理条件下,Cu-IR783NPs的近红外成像和声动力学能力被钝化,而在酸性TME中,由于IR783与Cu离子之间的配位键断裂,NIR成像、SDT和CDT的选择性活化仅发生在肿瘤组织中,从而避免了对正常组织的副作用。
此外,由于释放的IR783和Cu离子尺寸较小,TME响应性Cu-IR783解离实现了深度肿瘤穿透,体现了具有尺寸变形能力的纳米组装体的智能性。TME响应性释放的IR783由于激活的NIR成像能力和声动力活性而实现了可视化的原位SDT。此外,释放的Cu离子不仅通过Cu+介导的类Fenton反应实现ROS生成的级联放大,而且还通过Cu+诱导的DLAT寡聚化和线粒体功能障碍引发肿瘤特异性杯状凋亡。更重要的是,TME激活的Cu-IR783 NPs引起的ROS水平大幅提高和高效杯状凋亡逆转了免疫抑制的TME并触发ICD以刺激全身免疫反应。由于这些有利的特点,以可控的方式整合SDT、CDT和cuproptosis可以实现智能、可视化、原位的抗癌策略,同时最大限度地减少副作用。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202407196

